核桃蛋白酶解过程中香气成分的动态变化
2022-03-17范誉川
李 开,范誉川,丁 岚,曾 鸣,宋 昊,
(1.北京一轻研究院有限公司,北京 101111;2.北京市食品工业研究所,北京 100075)
核桃(Juglans regiaL.),胡桃科胡桃属,与扁桃、腰果和榛子称为世界著名的“四大干果”[1],在我国栽种面积广,年产量居世界首位。核桃具有极高的营养价值和独特的风味,核桃仁含有61%~74%的油脂,15%~19%的蛋白质,8%~13%的碳水化合物[2]。核桃蛋白的氨基酸种类齐全,包含8种必需氨基酸,其中,精氨酸和谷氨酸的含量较高,是重要的优质蛋白质来源[3]。通过蛋白酶解技术制备核桃蛋白肽越来越受到学界和工业界的关注,研究发现,核桃蛋白肽具有抗氧化、降血压、提高免疫力、降尿酸、增强记忆和改善睡眠等功效[4-7]。
核桃蛋白的三级结构在酶的作用下逐渐解离,肽键水解,生成能够被人体更容易吸收的低聚肽、氨基酸。核桃蛋白酶解相关研究主要集中在核桃肽的工艺优化[8-10]、核桃活性肽的分离鉴定[11-14]和酶解产物的活性分析[15-17]等。核桃蛋白酶解制备核桃肽的原料不论是核桃粕还是核桃蛋白粉,都有一定量的脂肪残留,随着酶解过程的进行,脂肪暴露在空气中发生氧化降解生成醛类和酮类等挥发性化合物[18],生成的游离氨基酸发生Strecker降解也能产生醛类和酮类化合物[19],另外游离氨基酸还会和脂肪氧化产物发生化学反应[20],引起核桃蛋白酶解液的香气成分发生变化,影响核桃肽产品最终的感官品质,例如,含硫化合物含量的增加会导致异味的产生[21]。目前,研究核桃肽的酶解工艺中关注的指标为核桃蛋白水解度、分子量分布及肽含量,而核桃蛋白酶解过程中香气成分变化的研究几乎为空白[17]。
本研究以核桃蛋白为研究对象,采用Protamex®蛋白酶进行酶解,通过顶空固相微萃取-气相色谱-质谱联用技术(headspace solid-phase microextractiongas chromatography-mass spectrometry, HS-SPMEGC-MS),结合相对气味活度值(relative odor activity value, ROAV)和主成分分析(principal component analysis,PCA)分析核桃蛋白在酶解过程中的挥发性成分的动态变化规律,为核桃蛋白肽的工业化生产中风味品质的控制提供理论支持。
1 材料与方法
1.1 材料和仪器
核桃蛋白 武汉林宝莱生物科技有限公司;Protamex®蛋白酶 丹麦诺维信公司;C7~C30正构烷烃、α-甲基肉桂醛 色谱纯,美国西格玛奥德里奇公司;其他试剂 均为分析纯。
7890A-5975C气相色谱质谱联用仪 美国安捷伦科技公司;CTC自动进样器 广州智达实验室科技有限公司;SPME萃取头(50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷) 美国Supelco公司;IKA RCT digital集热式磁力搅拌器 德国艾卡仪器设备公司。
1.2 实验方法
1.2.1 核桃蛋白酶解 参考本实验室优化得到的酶解条件,按照质量分数为5%的比例将核桃蛋白加入蒸馏水中,搅拌均匀,将pH用1 mol/L的NaOH溶液调节至7.0,按照5000 U/g(酶相对于蛋白的比例)加入Protamex®蛋白酶,于50 ℃水浴锅中酶解5 h,在 0、1、2、3、4和 5 h时取样,进行挥发性成分检测,重复测定3次。
1.2.2 SPME方法 对文献[22]的方法适当修改,吸取5 mL核桃蛋白酶解液,置于20 mL顶空进样品中,加入 1.0 g NaCl、10 μL 内标(0.45 mg/L 的α-甲基肉桂醛),密封。设置自动进样器程序为:50 ℃平衡30 min后,插入SPME萃取头萃取50 min,最后在 GC-MS进样口240 ℃解析5 min,进行 GC-MS分析。
1.2.3 GC-MS方法 参考文献[22]的方法,气相色谱柱为 DB-WAX石英毛细管柱(30 m×0.32 mm,0.25 μm),进样口温度为 240 ℃;升温程序为:40 ℃保持 3 min,以 5 ℃/min 升至 120 ℃,保持 4 min,然后以10 ℃/min 升至200 ℃,保持4 min,再以20 ℃/min升至 240 ℃,保持 8 min;He流速为 1.0 mL/min,不分流进样。
质谱条件为:电子电离(electron ionization,EI)源,电子能量70 eV,传输线温度240 ℃,离子源温度230 ℃,母离子285 m/z,激活电压1.5 V,质量扫描范围35.00~500.00 m/z,溶剂延迟3 min。
未知化合物定性通过对质谱碎片信息与NIST11谱库(匹配度大于80)比对得出化合物信息,并将化合物的保留指数(retention index,RI)与文献值进行验证。RI是根据改进的Kovats法计算得出的,C7~C30正构烷烃标准品用与样品分析同样的仪器条件进行GC-MS分析,利用得到的烷烃保留时间计算出未知化合物的保留指数[23]。同时,各化合物的浓度采用α-甲基肉桂醛为内标进行半定量分析。

式中:tn和tn+1为碳数为n、n+1的正构烷烃的保留时间(min);ti为tn与tn+1之间的第i个化合物的保留时间(min)。

式中,Cx、Ci分别为样品挥发性化合物和内标化合物的浓度(μg/L);Sx、Si分别为样品挥发性化合物和内标化合物的峰面积。
1.2.4 关键香气成分评价 采用ROAV评价酶解过程各挥发性化学成分对核桃蛋白香气的贡献,对样品总体香气贡献最大的组分ROAV为100[24-25],其余组分的ROAV计算公式如下:

式中,Ct、Ti分别是各化合物的浓度及其感官阈值;Cmax、Tmax是对总体香气贡献最大的化合物的浓度及其感官阈值。
1.3 数据处理
采用SAS软件对实验数据进行单因素方差分析(GLM法)、多重比较(Duncan法)和主成分分析,以P<0.05(差异显著)作为差异显著性判断标准。
2 结果与分析
2.1 核桃蛋白酶解过程中挥发性成分的变化
2.1.1 挥发性成分种类与含量分析 如图1、图2、图3所示,核桃蛋白粉酶解前共检出55种挥发性化合物,组成及含量见表1,其中醛类化合物18种,含量为 16.10 μg/L;醇类化合物 17 种,含量为 3.35 μg/L;酮类化合物10种,含量为 2.84 μg/L;酯类化合物5 种,含量为 0.98 μg/L;烷烃 2 种,0.23 μg/L;呋喃、萜烯及其他化合物各1种。大多数化合物在之前对核桃香气的研究中都有过报道,鲜核桃仁中香气成分数量比干核桃仁中的香气成分少,特别是鲜核桃仁中醛酮类化合物较少,这是因为加工过程中会发生脂肪酸的氧化降解和α-氨基酸的Strecker降解[26-28]。经过Protamex®蛋白酶酶解后,前3 h的酶解液都分别检测出68种挥发性化合物,4和5 h的酶解液检测出67种化合物。相对于酶解前,酶解后,醛类化合物增加了3种,醇类化合物增加了1种,酮类化合物还是10种;酯类化合物前3 h新增加了1种,而4、5 h比前3 h减少1种;另外新增加了3种吡嗪类化合物、1种酚类化合物和1种硫醚。酶解过程中,香气化合物种类数基本一致,但是各种化合物的含量有一定的差异。

图1 核桃蛋白酶解过程中挥发性成分的总离子流图Fig.1 Total ion chromatogram of volatile components during enzymatic hydrolysis of walnut protein
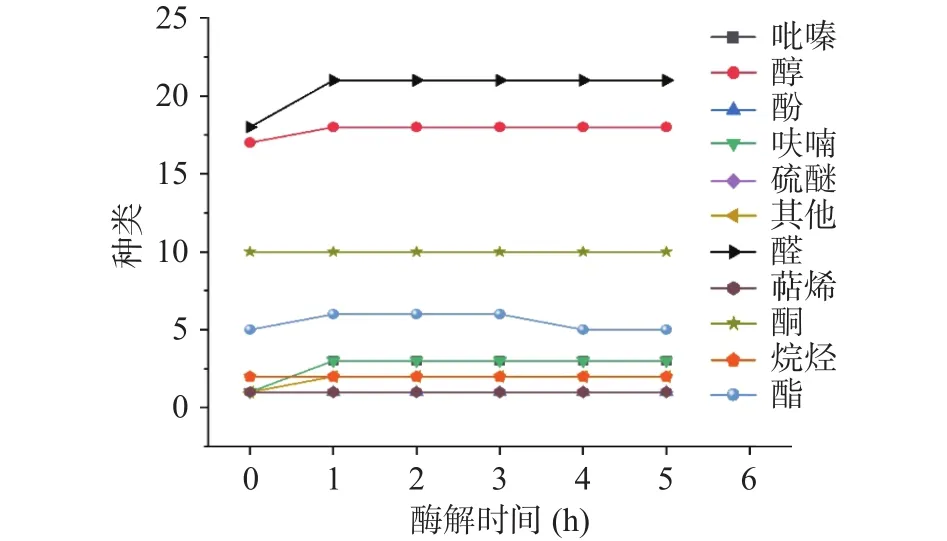
图2 核桃蛋白酶解过程中挥发性成分种类的变化Fig.2 Varieties analysis of volatile components during enzymatic hydrolysis of walnut protein

图3 核桃蛋白酶解过程中挥发性组分含量的变化Fig.3 Content analysis of volatile components during enzymatic hydrolysis of walnut protein
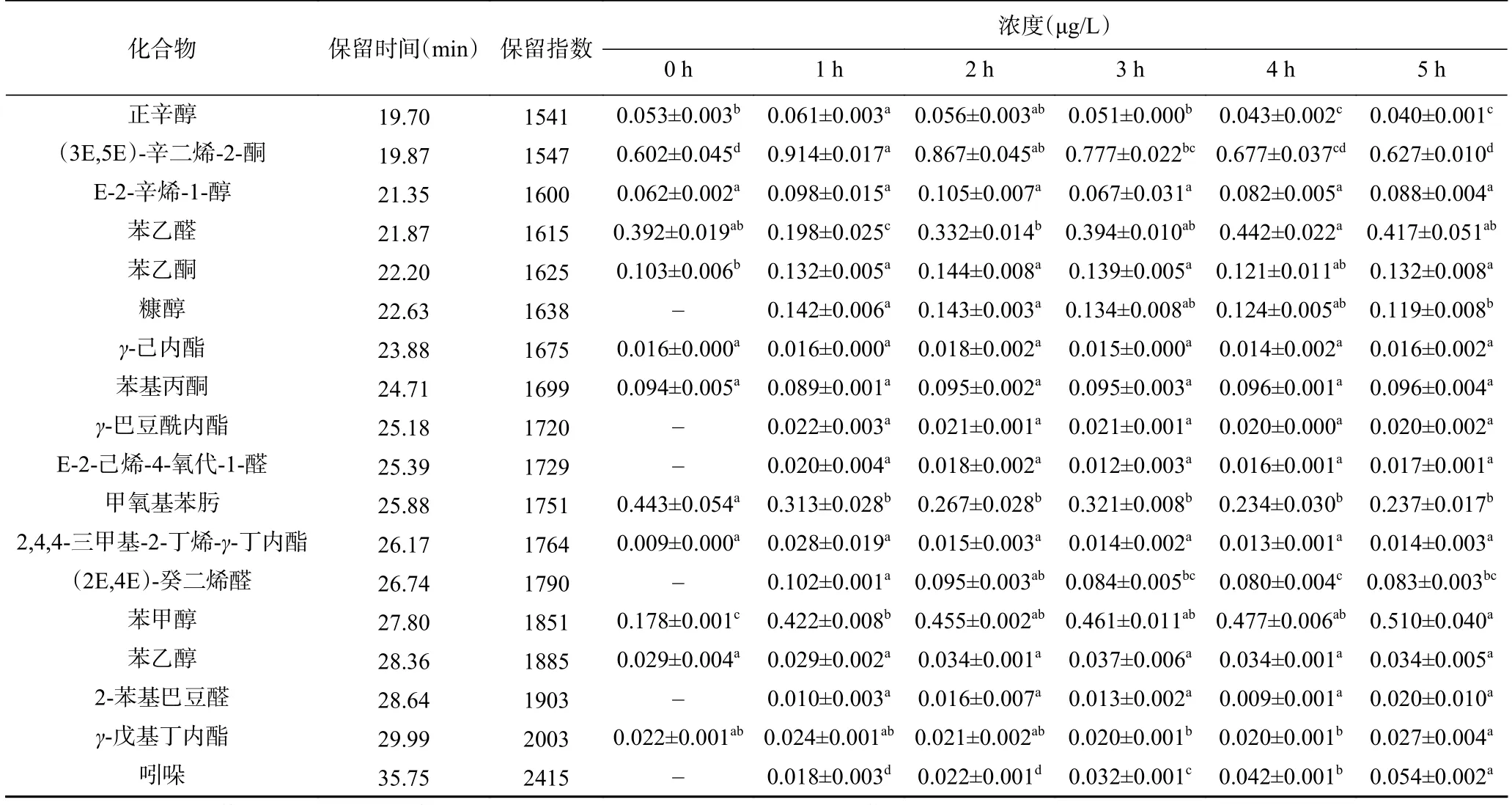
2.1.2 醛类化合物分析 核桃蛋白酶解过程中挥发性化合物的含量变化见表1,醛类化合物是核桃蛋白在酶解前后种类最丰富、含量最多的挥发性物质,而且酶解后种类增加,含量是先减少后增加。坚果中醛类化合物一般是在加工处理过程中由Maillard反应、Strecker降解、亚油酸、亚麻酸的氧化降解生成,具有清香、果香和坚果香的特征风味[29]。酶解前醛类化合物含量比较多的为苯甲醛(6.270 μg/L)、正己醛(6.253 μg/L)、3-甲基戊醛(0.824 μg/L)和正庚醛(0.630 μg/L),酶解后含量有明显变化。其中,苯甲醛具有苦杏仁、坚果香[19],含量从最初逐渐增加到5 h的14.250 μg/L,来源于苯丙氨酸的Strecker降解,并且苯甲醛一直为酶解液中含量最多的化合物;而正己醛和3-甲基戊醛的含量在酶解1 h分别降低至2.304、0.351 μg/L,酶解 1~5 h 过程中无显著变化(P<0.05);正庚醛的含量酶解 5 h 降至 0.104 μg/L。异戊醛的含量从酶解前的0.158 μg/L逐渐增加至1.247 μg/L;Z-4-庚烯醛未在酶解液中检出,还有一些化合物含量明显降低,可能是由于酶解前含量极低,在酶解过程中持续加热导致挥发;另外,酶解过程中新增加了4种醛类化合物,分别是具有果香的2-甲基-2-丁烯醛、具有脂肪香的(2E,4E)-癸二烯醛、具有坚果香的2-苯基巴豆醛和E-2-己烯-4-氧代-1-醛[30]。

表1 核桃蛋白酶解过程中挥发性成分及含量变化Table 1 Changes in volatile components and their contents during enzymatic hydrolysis of walnut protein
2.1.3 醇类化合物分析 醇类化合物的总量从酶解前的3.35 μg/L升高至酶解1 h时的3.89 μg/L,然后缓慢降低至 5 h 的 2.61 μg/L(见图3)。1-辛烯-3-醇具有蘑菇香气[30],是最初及酶解1~4 h时含量最高的醇类化合物,且含量随着时间明显降低;正己醇、正戊醇、3-甲基-2-丁醇在酶解前后的醇类化合物中也占据了很大的比例,同样酶解5 h后显著降低(P<0.05)。苯甲醇和2-乙基己醇的含量酶解5 h后显著升高(P<0.05),甚至在5 h时苯甲醇是酶解液香气成分中醇类含量最高的化合物。另外,糠醇只在酶解液中发现,它来源于Maillard反应中糖类的降解,是Maillard反应的重要的中间体,所以随着酶解的进行,酶解5 h后糠醇的含量显著降低(P<0.05)。
续表 1
2.1.4 酮类化合物分析 酮类化合物一般是由氨基酸分解和多不饱和脂肪酸热氧化降解生成,酶解后含量先升高后逐渐降低。例如,3-辛烯-2-酮、2-庚酮、2-辛酮具有不同的果香和花香[30],它们的含量经过酶解 5 h 后显著降低(P<0.05);(3E, 5E)-辛二烯-2-酮的含量经过酶解先升高再降低,最终(5 h)与酶解前(0 h)没有显著差异(P<0.05),但是酶解后其含量为酮类化合物最高。与酶解前相比,酶解5 h后苯乙酮的含量显著升高(P<0.05),另外,3-甲基-2-丁酮的含量在酶解后未检出,新增加了青草香的3-庚烯-2-酮。
2.1.5 酯类及其他化合物分析 酯类化合物与酮类化合物共存时,能调节和平衡酶解液的整体风味特征,随着酶解的进行,酯类化合物的总含量是逐渐降低的。酶解前含量最高的3-甲基-2-丁醇乙酸酯,酶解4 h后在酶解液中未检出;另外,新增加了γ-巴豆酰内酯,具有甜香和青香风味[30]。酶解前后烷烃的种类不变,含量都显著降低(P<0.05)。萜烯类化合物只有D-柠檬烯一种,呈现令人愉悦的柠檬香气,之前的研究发现,D-柠檬烯对核桃的香气有非常重要的贡献,相对含量高达12.50%[28];虽然在酶解过程中含量有所波动,但是最终含量与酶解前没有显著差异(P<0.05)。酶解前杂环类化合物只有2-正戊基呋喃,而在酶解液中检测出了8种,新增加的有呋喃类、吡嗪类、酚类和吲哚。呋喃类化合物来源于氨基酸的分解以及与还原糖之间的Maillard反应,不含硫的呋喃类化合物主要是甜香、水果香、坚果香和焦香。2-正戊基呋喃具有类似火腿的香气,从酶解前的0.082 μg/L 显著增加到酶解 5 h 时的 1.310 μg/L(P<0.05),是呋喃类化合物中含量最高的,2-乙基呋喃具有强烈的焦香味和甜香味[30]。吡嗪类化合物具有明显的焙烤香气,对食品风味的形成贡献较大,是由α-氨基酮类化合物自身缩合或者两种α-氨基酮类化合物之间缩合生成对应的烷基吡嗪,取代基的数量与参与反应的α-氨基酮的类别决定[31]。
2.2 核桃蛋白酶解过程中关键香气成分的变化
核桃蛋白在酶解过程中各阶段的香气风格是由香气成分的含量及其香气阈值共同决定的,一般来说,ROAV越大,该化合物对香气贡献的程度越大。为了分析核桃蛋白在酶解过程中关键香气成分的变化,结合文献已经报道的化合物在水中的香气阈值[32-35],计算出主要香气成分的ROAV,见表2。

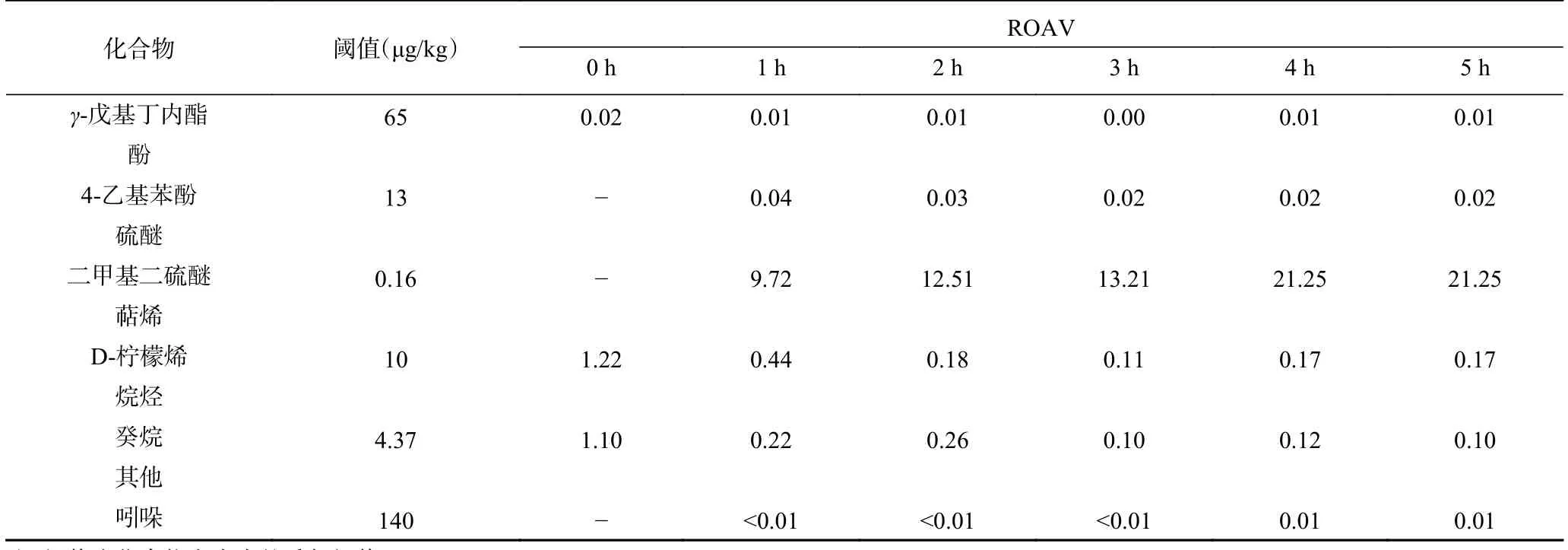
表2 酶解过程中香气成分ROAV的变化Table 2 ROAV changes of aroma components during enzymolysis
酶解前,核桃蛋白的关键香气成分(ROAV≥1)有21种,其中1-辛烯-3-醇、异戊醛、正戊醛、正己醛、正庚醛、Z-4-庚烯醛、正辛醛、正壬醛和E-3-戊烯-2-酮的ROAV大于10,对核桃蛋白的整体风味贡献很大;同时,正己醇、芳樟醇和E-2-辛烯-1-醇等11种化合物对核桃蛋白的整体风味起修饰作用(0.1≤ROAV<1)。由此可见,果香、花香和蘑菇香构成了核桃蛋白的主体香气,同时带有一定的油脂香和青草香。
随着酶解的进行,有的化合物的ROAV逐渐降低,从关键香气成分变为修饰成分,例如3-甲基-1-戊醇、正庚醇、正辛醛和E-2-辛烯醛等;同时,一些化合物的ROAV逐渐升高成为关键香气成分,例如2-乙基呋喃、2-正戊基呋喃和二甲基二硫醚。酶解液的关键香气成分主要是异戊醛、二甲基二硫醚、(2E,4E)-癸二烯醛、1-辛烯-3-醇和正己醛等13种化合物,另有11种化合物起修饰作用,这使得酶解液的主体香气为花香和果香。二甲基二硫醚来源于含硫氨基酸(例如半胱氨酸、甲硫氨酸)的降解,先通过Strecker反应生成硫醇,再通过氧化反应生成,它为酶解液带来了较重的洋葱香和大蒜香,在蛋白类产品中含硫挥发性成分往往是产生异味的关键因素[36]。
续表 2
2.3 主成分分析
为了更好地研究酶解过程中的关键香气成分,对ROAV≥1的关键香气成分进行了主成分分析,结果见表3,前两个主成分的累计贡献率达到了95.85%,因此前两个主成分就能很好地概括原始数据的大部分信息。从图4可见,第一主成分中正戊醛、正壬醛、正庚醛、正己醛、D-柠檬烯、正辛醛、3-辛烯-2酮、3-甲基-2-丁醇乙酸酯、E-2-辛烯醛、癸烷、苯乙醛、Z-4-庚烯醛、1-辛烯-3-醇、3-甲基-1-戊醇和 2-庚酮具有较大的正系数,二甲基二硫醚和异戊醛具有较大的负系数;第二主成分中2-乙基己醇、2-乙基呋喃、(2E,4E)-癸二烯醛和2-正戊基呋喃的系数最大,Z-4-庚烯醛和二甲基二硫醚的系数最小。从图5可以看出,第一主成分能很好地将酶解前和酶解后区分开,说明酶解前后醛类化合物的差异比较明显;第二主成分能将1、2 h与3、4和5 h区分开,说明2-乙基己醇、2-乙基呋喃、(2E,4E)-癸二烯醛、2-正戊基呋喃、Z-4-庚烯醛和二甲基二硫醚对酶解液的香气构成具有重要的影响,这与徐永霞等[19]研究的复合蛋白酶酶解蓝蛤的结果类似,生成的呋喃类化合物对酶解液增香作用明显。酶解3、4和5 h的载荷距离比较接近,说明3~5 h酶解液的香气趋于稳定、特征比较一致。
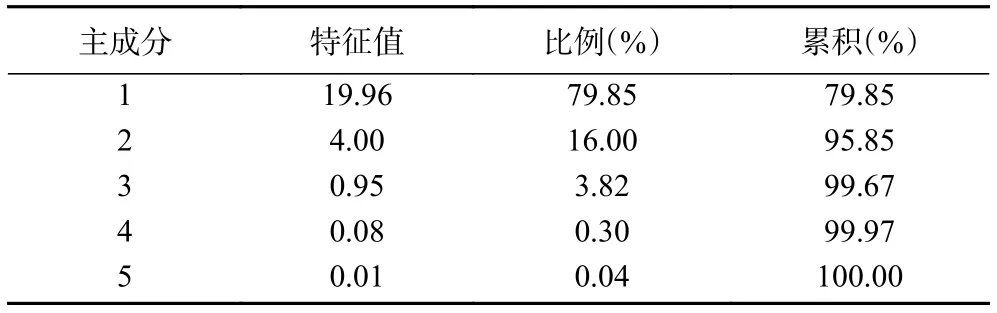
表3 主成分分析相关矩阵的特征值Table 3 Eigenvalues of PCA correlation matrix

图4 酶解过程中关键香气成分的PCA载荷图Fig.4 PCA loading plot of key aroma components during enzymolysis

图5 不同酶解时间的PCA得分图Fig.5 PCA score plot of different enzymolysis time
3 结论
采用HS-SPME-GC-MS分析了Protamex蛋白酶对核桃蛋白在酶解过程中的挥发性成分的动态变化情况,并结合ROAV值和PCA分析确认了酶解过程中的关键香气成分。酶解初始时共检测出55种挥发性成分,在酶解过程中检测出67~68种挥发性成分。通过对香气成分的ROAV值进行分析,核桃蛋白酶解前的关键香气成分为正戊醛、1-辛烯-3-醇和异戊醛等21种化合物,随着酶解的进行,关键香气成分逐渐转变为异戊醛、二甲基二硫醚和(2E,4E)-癸二烯醛等13种化合物。PCA分析结果表明,酶解液香气结构的改变主要受2-乙基己醇、2-乙基呋喃、(2E,4E)-癸二烯醛、2-正戊基呋喃、Z-4-庚烯醛和二甲基二硫醚的浓度变化的影响,酶解至3 h时,香气特征趋于稳定。研究结果将为核桃蛋白肽工业化生产中的品质控制提供理论依据。
