基于网络药理学探讨溪黄草治疗酒精性肝损伤的作用机制
2022-03-17刘文彬钟景斌
刘文彬,钟景斌,王 晖,
(1.广东药科大学生命科学与生物制药学院,广东省生物活性药物研究重点实验室,广东广州 510006;2.广东药科大学中药学院,广东广州 510006)
随着经济的发展,人民生活水平得到了显著改善,我国酒精类饮料的产量和消耗量随之迅速增长,我国已成为全球饮酒量上升最快的国家[1]。酒精性肝损伤发病率也呈逐年上升的趋势,已成为仅次于肝炎病毒感染的第二大肝病[2]。酒精性肝损伤病情初期一般表现为酒精性脂肪肝,随后逐步发展为酒精性肝炎、酒精性肝纤维化和酒精性肝硬化,严重酗酒还可能导致广泛肝细胞坏死甚至肝衰竭[3]。
溪黄草为唇形科植物线纹香茶菜的干燥全草,俗称熊胆草、血风草、黄汁草等,是广东民间习用草药,具有清热利湿、退黄、凉血散瘀之功能,多用于黄疸性肝炎、急性胆囊炎等疾病[4]。大量研究证实溪黄草具有明确的保肝作用,如许琼梅等[5]报道溪黄草水提物对CCl4诱导的肝纤维化模型大鼠具有一定的保护作用,其作用机制可能与调节脂质代谢、减轻肝脂质过氧化损伤、抗氧化应激反应、抑制炎症因子释放及TGF-β1蛋白表达等有关。叶秋莹等[6]研究发现溪黄草水提物对小鼠酒精性肝损伤有明显的保护作用,作用机制与调整抗氧化酶系统有关,但未探讨其作用机制。溪黄草主要含有萜类、挥发油类、黄酮类[7]、甾醇类、酚类、香豆素类等多种化学成分[8]。何国林等[9]报道在体外溪黄草总二萜可通过保护肝脏线粒体、调控肝脏内源性抗氧化酶系统等作用发挥保肝功能。郑玉峰等[10]报道溪黄草黄酮能通过调节 MMP-9、TIMP-1、TGF-β及 PPARγ的表达抑制非酒精性脂肪性肝纤维化的发生、发展。溪黄草同属植物蓝萼香茶菜来源的蓝萼甲素通过TGF-β1/Smad信号通路抑制肝星状细胞的活化,从而发挥治疗治疗肝纤维化的作用[11]。目前,溪黄草对酒精性肝损伤保护作用的物质基础和机制尚不明确,限制了其在解酒保肝中的应用。
因此,本研究采用小鼠急性酒精肝损伤模型,观察溪黄草对小鼠酒精肝损伤的保护效果,并首次采用网络药理学方法分析其潜在有效成分和作用机制,并对相关靶点进行了实验验证。通过本研究有助于进一步明确溪黄草对急性酒精性肝损伤的保护作用及其可能的作用机制,以期为该产品的进一步开发研究和临床应用提供科学依据。
1 材料与方法
1.1 材料和仪器
昆明小鼠 40只 SPF级,雌性,体重18~22 g,10~12周龄,购自广州中医药大学实验动物中心,实验单位使用许可编号:SYXK(粤)2017-0125,小鼠饲养温度20~26 ℃,相对湿度为 50%~60%,每日光照/黑暗时间12 h;溪黄草饮片 湖北金贵中药饮片有限公司提供,经广东药科大学马鸿雁副教授鉴定为溪黄草(Rabdosia serra);水飞蓟宾 大连美仑生物技术有限公司;红星二锅头酒 北京红星股份有限公司;苏木素-伊红染液 武汉谷歌生物科技有限公司;BCA蛋白定量试剂盒 美国 Pierce公司;anti-βactin抗体、anti-CYP2E1抗体、anti-Nrf2抗体 武汉博士德生物工程有限公司;生化指标检测试剂盒均购至于南京建成。
MD SpectraMax M2全波长酶标仪 美国 MD公司;3K15低温高速离心机 德国SIGMA;Tanon-5200凝胶成像系统 上海天能科技有限公司;超低温冰箱 中科美菱;JJ-12J脱水机 武汉俊杰电子有限公司;JB-P5包埋机 武汉俊杰电子有限公司;RM2016病理切片机 上海徕卡仪器有限公司;正置光学显微镜 日本尼康。
1.2 实验方法
1.2.1 溪黄草提取液制备 称取20 g溪黄草,加入100 mL去离子水,浸泡过夜,煎煮2 h,多层纱布过滤去除固体残渣,合并滤液,旋蒸浓缩,得到溪黄草浸膏,保存于4 ℃冰箱备用,临用时用纯水配置相应浓度溪黄草提取液[5]。
1.2.2 溪黄草提取液对酒精性肝损伤的改善作用
1.2.2.1 动物分组、造模给药 40只雌性昆明小鼠随机分为空白组、模型组、溪黄草组、阳性对照组各10只。除空白组外,其余各组按0.1 mL/10 g灌胃52°白酒进行造模,复制酒精性肝损伤模型[12],连续造模10 d,每次造模1 h后,空白组、模型组给等体积蒸馏水,溪黄草组给药剂量(相当于4 g溪黄草生药/kg)、阳性对照组灌胃水飞蓟宾(50 mg/kg),共 10 d,造模期间无动物死亡。溪黄草组给药剂量根据《中药药理研究方法学》(第2版)方法折算。
1.2.2.2 肝组织病理观察 待实验结束后,取肝脏组织分为两份,用滤纸吸干血迹,一份固定于4%的多聚甲醛,并包埋于石蜡中,切片厚度4 μm,HE染色后,显微镜下观察肝脏组织的病理变化。另一份迅速投入液氮中,再转入-80 ℃冰箱保存备用。
1.2.2.3 生化指标检测 实验结束后(最后一次灌胃结束后禁食12 h,自由饮水),小鼠眼球取血,离心分离血清。采用试剂盒法测定谷氨酸脱氢酶(Glutamic acid dehydrogenase,GDH)、谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、还原型谷胱甘肽(Reduced glutathione,GSH)、天冬氨酸氨基转移酶线粒体同工酶(Mitochondrial aminotransferase,m-AST)、乙醇脱氢酶(Alcohol dehydrogenase,ADH)、谷胱甘肽过氧化物酶(Glutathione Peroxidase ,GSH-Px)、过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)和丙二醛(Malondialdehyde,MDA)。
1.2.2.4 Western blotting检测Nrf2、CYP2E1蛋白表达 取肝脏组织匀浆,加入裂解混合液,并离心(4 ℃,12000 r/min,15 min)。通过 BCA法测定蛋白浓度。在10% SDS-PAGE凝胶电泳上分离,然后转移到PVDF膜上,室温封闭1.5 h,接着在4 ℃下与一抗孵育过夜:次日用TBST洗涤3次后,加入山羊抗兔IgG HRP作为二抗,室温下孵育2 h,用 TBST洗膜3次,使用ECL化学发光显色,采用Tanon化学发光成像分析系统显影,image J软件分析蛋白条带、计算灰度值。
1.2.3 溪黄草提取液改善酒精性肝损伤的网络药理学研究
1.2.3.1 溪黄草成分收集及靶点预测 利用Cancer HSP(https://tcmspw.com/CancerHSP.php)、BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm/)数据库检索溪黄草化学成分信息,结合文献补充溪黄草成分。再通过PubChem (https://pubchem.ncbi.nlm.nih.gov/) 数据库获取溪黄草成分的SMILES信息,并将其导入 Swiss ADME(http://www.swissadme.ch/)进行 ADME的筛选,以 GI absorption、Drug likeness为条件,对于未符合数据库ADME要求的成分,但有相关文献支撑其药理活性的成分也纳入活性成分中进行靶点预测,通过ADME筛选的成分由Swiss Target Prediction(http://www.swisstargetprediction.ch/) 数据库获取潜在靶点信息,同时,将成分的CAS号输入TCMSP获取每个成分的OB、DL信息[13]。
1.2.3.2 酒精性肝损伤疾病靶点收集及交集靶点获取 从 GeneCards(https://www.genecards.org/)、Dig-See(http://210.107.182.61/geneSearch/)数据库中以“Alcoholic liver injury”为关键词进行检索,获取酒精性肝损伤的靶点。将两数据库的疾病靶点与成分靶点利用 image GP(http://www.ehbio.com/)获取交集靶点,并进行韦恩图可视化[14]。
1.2.3.3 交集靶点PPI网络构建与可视化分析 将“1.2.3.2”项的交集靶点导入STRING(https://stringdb.org/),选择“Homo sapiens””类型,运行得到PPI相互作用网络;设置interaction score为0.4,PPI数据输出格式为“TSV”,并将其导入Cytoscape3.7.0中进行Network Analysis拓扑分析,并构建PPI网络可视化,利用插件CytoHubba根据度值(Degree)大小筛选关键靶点,最后构建PPI网络可视化。
1.2.3.4 交集靶点的GO分析与KEGG富集 通过DAVID 6.8 (https://david.ncifcrf.gov/)对交集靶点进行GO富集与KEGG通路富集分析,设置P<0.05进行筛选,对溪黄草治疗酒精性肝损伤的靶点进行生物过程和通路分析,并进行可视化[15]。
1.2.3.5 活性成分-交集靶点-关键通路作用网络构建将1.2.3.1项的活性成分、1.2.3.2项的交集靶点、1.2.3.3项的关键通路导入Cytoscape3.7.0中,构建活性成分、靶点、通路的作用关系,在该网络中,节点(node)分别代表成分、靶点、通路,而相互作用关系以边(edge)来表示,构建相互作用网络探究溪黄草治疗酒精性肝损伤的多成分,多靶点、多治疗途径的作用机理[16]。
1.3 数据处理
应用SPSS20.0软件进行统计学分析。数据以平均值±标准差(±s)表示,各组间比较采用单因素方差分析,P<0.05 表明差异有统计学意义。
2 结果与分析
2.1 溪黄草对酒精性肝损伤的改善作用
2.1.1 溪黄草对酒精性肝损伤小鼠肝脏病理组织的影响 肝脏HE染色显示,空白组小鼠肝小叶结构清晰、具有典型辐射状结构,胞质均匀、红染,结构完整,细胞界线清晰,肝板排列整齐规则,肝细胞圆润、饱满、无变性且呈多边形;细胞核大小正常,核质分布均匀;模型组肝小叶界限不清,肝细胞索紊乱,肝细胞出现广泛气球样变性,大小不一,胞质空泡化,可见几处局灶性坏死,并伴有炎性细胞浸润等病理改变;与模型组相比,阳性给药组、溪黄草组小鼠肝脏未见气球样变,少见汇管区有炎性细胞浸润,大部分肝细胞接近正常形态,肝脏结构损伤程度明显减轻,见图1。

图1 溪黄草对酒精性肝损伤小鼠肝脏病理组织的影响(HE 染色,200×)Fig.1 Effect of Rabdosia serra on liver histopathology of mice with alcoholic liver injury (HE staining, 200×)
2.1.2 溪黄草对酒精性肝损伤小鼠肝功能的影响AST和ALT是主要的肝脏细胞功能酶[17],m-AST和GDH为肝细胞线粒体特异酶,均可特异性地反映肝损伤的程度[18]。与空白组相比,模型组小鼠肝脏中ALT、AST、m-AST、GDH蛋白表达水平极显著上调(P<0.01),提示酒精性肝损伤造模成功;溪黄草组AST、m-AST、GDH蛋白表达水平显著低于模型组(P<0.05或P<0.01),提示溪黄草具有较好的保肝作用。水飞蓟宾组ALT和AST显著低于溪黄草组(P<0.05或P<0.01),m-AST 和 GDH 两组无统计学差异,见表1。

表1 溪黄草对酒精性肝损伤小鼠肝功能的影响Table 1 Effect of Rabdosia serra on liver function in mice with alcoholic liver injury
2.1.3 溪黄草对酒精性肝损伤小鼠酒精相关代谢酶和抗氧化指标的影响 在饮酒初期,肝脏主要依靠酒精相关代谢酶ADH、CAT代谢酒精。与空白组相比,模型组小鼠肝脏中ADH和CAT蛋白表达水平极显著下调(P<0.01);溪黄草组ADH和CAT蛋白表达水平显著高于模型组(P<0.05或P<0.01),提示溪黄草对肝脏酒精相关代谢酶的活性具有促进作用。溪黄草组和水飞蓟宾组在ADH和CAT无统计学差异。见表2。

表2 溪黄草对酒精性肝损伤小鼠酒精相关代谢酶的影响Table 2 Effect of Rabdosia serraon alcohol related metabolic enzymes in mice with alcoholic liver injury
现代医学认为当饮酒过量时,将引起机体酒精代谢酶活性、抗氧化性以及脂质氧化等一系列异常反应,进而导致肝脏的功能性损伤[19]。机体内的抗氧化防御体系分为非酶类的抗氧化物质(GSH)和酶类抗氧化物质(SOD、GSH-Px)[20]。SOD和 GSH-Px作为肝脏氧化活性酶,参与酒精代谢过程中产生的ROS的氧化代谢,其值大小能够反映肝脏的受损情况[21]。MDA为脂质过氧化的终产物,其值能够间接反映机体组织过氧化的损伤程度。因此,SOD、GSHPx、GSH和MDA是反映肝脏氧化损伤的重要指标[22]。由表3可知,与空白对照组相比,模型组小鼠肝脏中SOD和GSH-Px、GSH蛋白表达水平表达极显著下调(P<0.01),MDA蛋白表达水平极显著上调(P<0.01)。溪黄草组SOD和GSH-Px、GSH蛋白表达水平显著高于模型组(P<0.05 或P<0.01),MDA 蛋白表达水平显著低于模型组(P<0.05)。本研究结果显示溪黄草对酒精性肝损伤具有较好的抗氧化应激作用,这与何国林等[9]研究溪黄草总二萜调控肝脏内源性抗氧化酶系统等作用发挥保肝功能的结果类似。溪黄草组和水飞蓟宾组在SOD、GSH-Px、GSH和MDA无统计学差异。
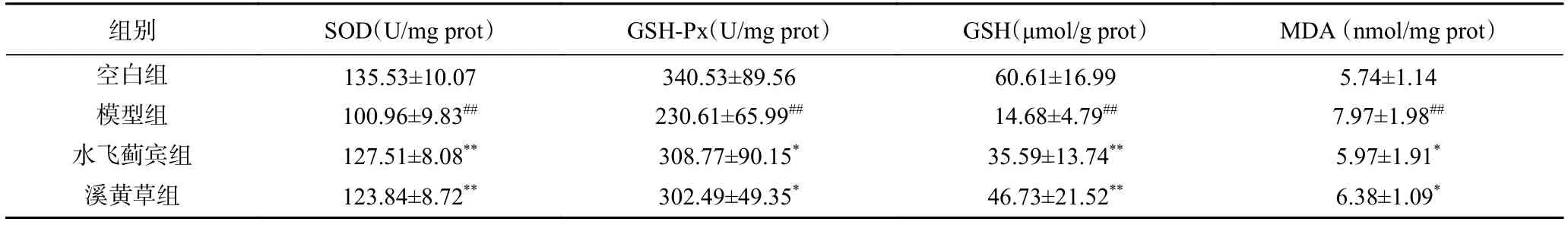
表3 溪黄草对酒精性肝损伤小鼠抗氧化指标的影响Table 3 Effects of Rabdosia serra on antioxidant indexes in mice with alcoholic liver injury
2.2 溪黄草治疗酒精性肝损伤的网络药理学研究
中药具有多靶点和多组分的特点,网络药理学通过多向药理学、蛋白组学、功能基因学、网络可视化等技术,可用于揭示中药的多组分与机体的复杂作用[23],并预测其潜在的作用机制,越来越多的研究者将该方法运用于中药的药理学研究[24-25]。
2.2.1 溪黄草成分获取与靶点收集 经过筛选后,以“溪黄草”为关键词在Cancer HSP、BATMAN-TCM数据库筛选出符合靶点预测的活性成分5个,同时,由文献补充12个成分,共收集溪黄草17个活性成分,信息见表4。由Swiss Target Prediction数据库预测17个成分的靶点,经去重,获得431个成分靶点。

表4 溪黄草活性成分Table 4 Active components of Rabdosia serra
2.2.2 疾病靶点构建 从GeneCards(紫圈)、DigSee(蓝圈)数据库分别收集到5230、217个相关疾病靶点,将疾病靶点(黑圈)与成分靶点取交集获得34个溪黄草治疗酒精性肝损伤潜在的共同靶点,见图2。
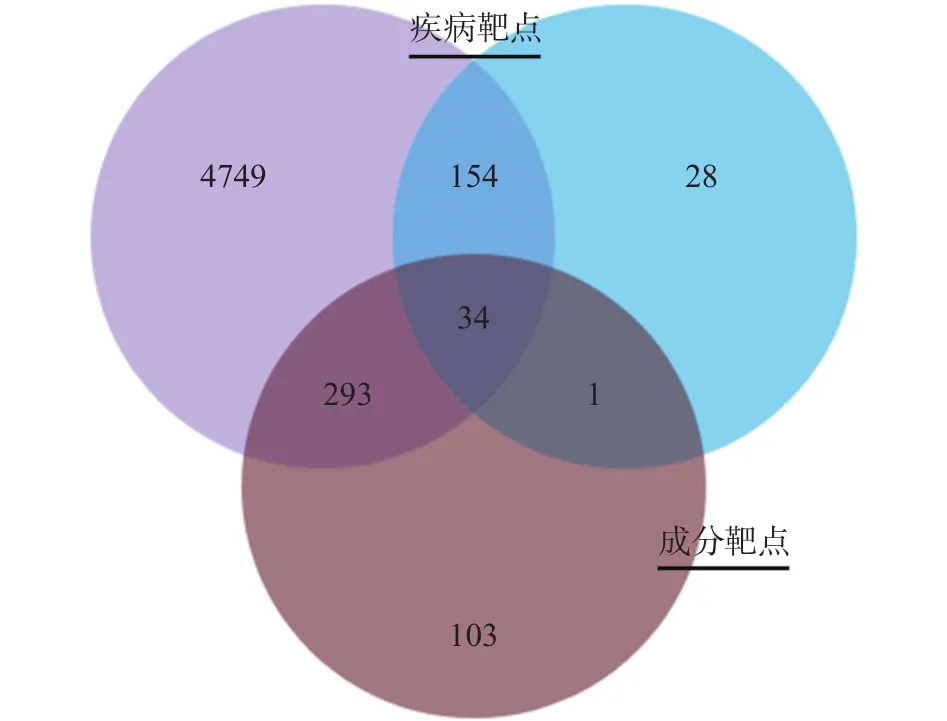
图2 共同靶点韦恩图Fig.2 Wayne diagram of common target
2.2.3 PPI网络构建 由String数据库构建的PPI网络导入Cytoscape3.7.0中,得到33个节点,155条边的 PPI网络,平均度值(degree)为7.42,以 degree≥7.42为筛选条件,筛选出18个关键靶点,利用Cyto-Hubba根据degree大小显示不同的颜色,颜色越深表示degree越大,该靶点作用关系越重要。在该网络中,节点为靶点,边表示靶点之间的相互作用关系,见图3。

图3 PPI网络构建与关键靶点筛选Fig.3 PPI network construction and key target screening
2.2.4 GO生物功能注释与KEGG富集通路分析结果 对溪黄草治疗酒精性肝损伤的34个共同靶点通过DAVID数据库进行GO功能富集与KEGG通路分析,由GO富集显示得到生物学功能条目58个(P<0.05),其中,生物过程(BP)为 44 条,细胞组成(CC)为 4 条,分子功能(MF)为 10 条,见图4。34 个靶点参与炎症应答、免疫响应、IL-8和一氧化氮生物合成过程的调控、自噬的负调控、细胞因子分泌的正调控、参与活性氧代谢过程、调控内在凋亡信号通路等发挥关键治疗作用的生物过程;在分子功能方面,发挥调节丝氨酸型内肽酶活性、血红素结合、类固醇激素受体活性、过氧化物酶活性、趋化因子受体活性、氧化还原酶活性、脂多糖结合等功能作用,提示溪黄草通过体内的多种生物学过程发挥治疗酒精性肝损伤的作用。KEGG通路富集得到(P<0.05)23条信号通路,提示溪黄草活性主要涉及调控PI3K-Akt信号通路、乙型肝炎、肿瘤坏死因子信号通路、细胞因子-细胞因子受体相互作用、细胞凋亡通路、NF-κB信号通路、缺氧诱导因子-1信号通路、Toll样受体信号通路、非酒精性脂肪性肝病通路、脂肪细胞因子信号通路等关键通路发挥抗酒精性肝损伤治疗作用,见图5。

图4 GO功能注释分析Fig.4 GO function annotation analysis

图5 关键KEGG通路富集分析Fig.5 Enrichment analysis of key KEGG pathways
2.2.5 活性成分-靶点-关键通路作用网络构建 由溪黄草活性成分、共同靶点、关键通路构建相互作用网络,见图6。该网络中包含61个节点,151条边,紫色倒三角代表活性成分、深红色椭圆形表示靶点、深绿色方形代表关键通路,边表示成分、靶点、通路三者的作用网络关系。利用Network Aanlyzer 插件对该网络进行拓扑数据分析,平均度值(Degree)为4.95,平均介数(Betweenness Centrality)为 0.03,平均中心性(Closeness Centrality)为0.34。根据度值大小,从活性成分角度,咖啡酸、迷迭香酸、槲皮素、胡麻素、异鼠李素是溪黄草中最有可能的活性物质,均具有保肝作用。咖啡酸是一种酚酸,咖啡酸及其衍生物均具有抗氧化和保肝等生物活性,迷迭香酸可通过调节NF-κB信号通路预防DEN诱导的大鼠原发性肝癌,槲皮素[26]可通过加强机体的抗氧化应激水平相关,而且与抑制NF-κB信号通路发挥保肝作用。度值靠前5位的靶点有Nrf2、CYP2E1、PTGS2、MMP9、MMP2 。由该网络可见,多成分作用不同的靶点,靶点参与不同通路的调控,显示溪黄草通过在多成分作用于多靶点,参与多通路的调控发挥治疗酒精性肝损伤的作用机制。

图6 溪黄草成分-靶点-关键通路网络Fig.6 Network of Rabdosia serra component-target-key pathways
2.2.6 Western-blot验证关键靶点Nrf2、CYP2E1表达情况 过量饮酒时,可大幅诱导CYP2E1的上调且伴随ROS的产生,导致机体氧化-抗氧化系统失衡。当酒精诱导CYP2E1水平上升时,Nrf2被激活且水平上调来对抗自身产生的氧化应激[27],引起机体保护性适应性反应,此外药物上调Nrf2可进一步对抗酒精引起的氧化损伤发挥保护作用[28]。与空白对照组相比,模型组小鼠肝脏中Nrf2、CYP2E1蛋白表达水平表达极显著上调(t=7.767,P<0.01;t=7.199,P<0.01);经溪黄草给药干预后,溪黄草组与模型组相比,Nrf2 蛋白表达极显著上调(t=5.059,P<0.01),CYP2E1蛋白表达极显著下调(t=4.112,P<0.01),见图7。本研究结果显示溪黄草可下调CYP2E1的表达降低氧化氧化应激反应,并上调Nrf2对抗酒精引起的氧化损伤作用。

图7 溪黄草对关键靶点Nrf2、CYP2E1蛋白表达的影响± s,n=3)Fig.7 Effect of Rabdosia serra on the expression of Nrf2 and CYP2E1 protein± s,n=3)
3 结论
溪黄草为广东习用中药,尤其是连州产的溪黄草已成为国家地理标志性产品。溪黄草虽保肝作用明确,但其作用机制和物质基础不详,限制了其在临床中的应用。本研究通过建立小鼠酒精性肝损伤模型,考察了溪黄草对酒精性肝损伤的保护作用,创新性的通过网络药理学方法对其有效成分和作用靶点进行了推测并进行了验证。结果显示,溪黄草可明显改善酒精导致的肝损伤,提高肝脏内酒精相关代谢酶,通过增强非酶抗氧化和抗氧化酶的活性而提高对ROS的清除能力,降低脂质过氧化物的产生,其分子机制可能与溪黄草抑制CYP2E1水平升高,激活Nrf2的表达,从而降低氧化应激造成的损伤相关。
本研究明确了溪黄草对急性酒精性肝损伤的保肝作用及其可能的作用机制,为该产品的进一步开发研究和临床应用提供了科学依据。但仍存在诸多不足,如虽对溪黄草抗酒精性肝损伤的物质基础进行了推测,但未对其加以验证,在分子机制研究中,只对关键靶点进行了验证,而缺乏对其完整信号通路的调控研究,上述不足也是课题组下一步研究的重点。
