p53凋亡刺激蛋白2基因肝脏条件性敲除小鼠的构建和鉴定*
2022-03-17寇卜心柴梦音豆双双庞丽君陈德喜刘晓霓
寇卜心,柴梦音,豆双双,庞丽君,陈德喜,刘晓霓
条件性基因敲除(conditional knockout,CKO)是将某个基因的修饰限制于小鼠某些特定类型的细胞或发育的某一特定阶段,实现对小鼠基因组的时空特异性修饰[1,2]。CKO技术主要是通过染色体位点特异性重组酶系统来实现的,如Cre-LoxP系统[3,4]、FLP-Frt系统[5,6]和Dre-Rox系统[7],其中最为常用的是Cre-LoxP系统,是在待敲除的一段目的DNA序列的两端各放置一个LoxP序列,得到目的基因插入两个LoxP位点 (flanked by loxP,Flox) 的小鼠。将Flox小鼠与特异性表达Cre的工具鼠交配,即可获得具有组织或细胞特异性敲除目的的基因小鼠[8]。研究显示,p53凋亡刺激蛋白2(apoptosis-stimulating of p53 protein 2,ASPP2)在多种疾病的发生发展过程中起着重要的作用[9-15]。我们前期构建了ASPP2全身敲除小鼠,显示可以促进二乙基亚硝胺(diethylnitrosamine,DEN)诱导的肝癌形成[16,17]。为了更好地研究ASPP2在肝脏疾病发病过程中的生物学功能和作用机制,我们利用簇状规则间隔短回文重复序列/CRISPR相关蛋白9(clustered regularly interspaced short palindromic repeats/ CRISPR-associated protein 9,CRISPR/Cas9) 技术获得 ASPP2-flox小鼠,与肝脏特异性表达Alb-Cre的小鼠交配繁育,构建ASPP2肝脏条件性基因敲除小鼠,为深入探讨ASPP2在肝脏疾病(如肝癌、肝再生和脂肪肝形成等)发生发展过程中的作用提供了应用模型。
1 材料与方法
1.1 动物、试剂与仪器 12~16周龄SPF级Balbl/c小鼠,雌雄各半,共10只; 12~16周龄SPF级C57b6l/J Alb-Cre小鼠,雌雄各半,共10只,购自江苏集萃药康生物技术有限公司[生产许可证号:SYXK(苏)2018-0008],并在该公司SPF级动物房饲养和实验[使用许可证号:SYXK(苏)2018-0027]。所有小鼠饲养于12 h/12 h光照/黑暗条件下,自由采食和饮水,严格遵守首都医科大学动物伦理和福利相关规定(伦理批件号:AEEI-2019-068)进行动物实验。DH5a 感受态细胞(诺唯赞生物科技股份有限公司,中国);MEGA short script Kit 试剂盒(Invitrogen, 美国);免疫组化试剂盒(北京中杉金桥生物技术有限公司,中国);抗β-actin和抗ASPP2(Cell Signaling Technology,美国)。ProFlexTM 96-well PCR system(Applied Biosystems,美国);DFC450 C正置显微镜(LEICA,德国); ChemiDoc XRS化学发光成像系统(BioRad,美国);PowerPacTMBasic电泳仪(BioRad,美国)。
1.2 ASPP2基因肝脏条件性敲除小鼠的构建策略 采用CRISPR/Cas9基因编辑法,以Balb/c近交系小鼠为背景鼠,按照图1的示例,选择ASPP2-201转录本 (ENSMUST00000117245.1) 为模板,在1~2号和3~4号外显子区插入Loxp片段,以获得 ASPP2-flox小鼠。
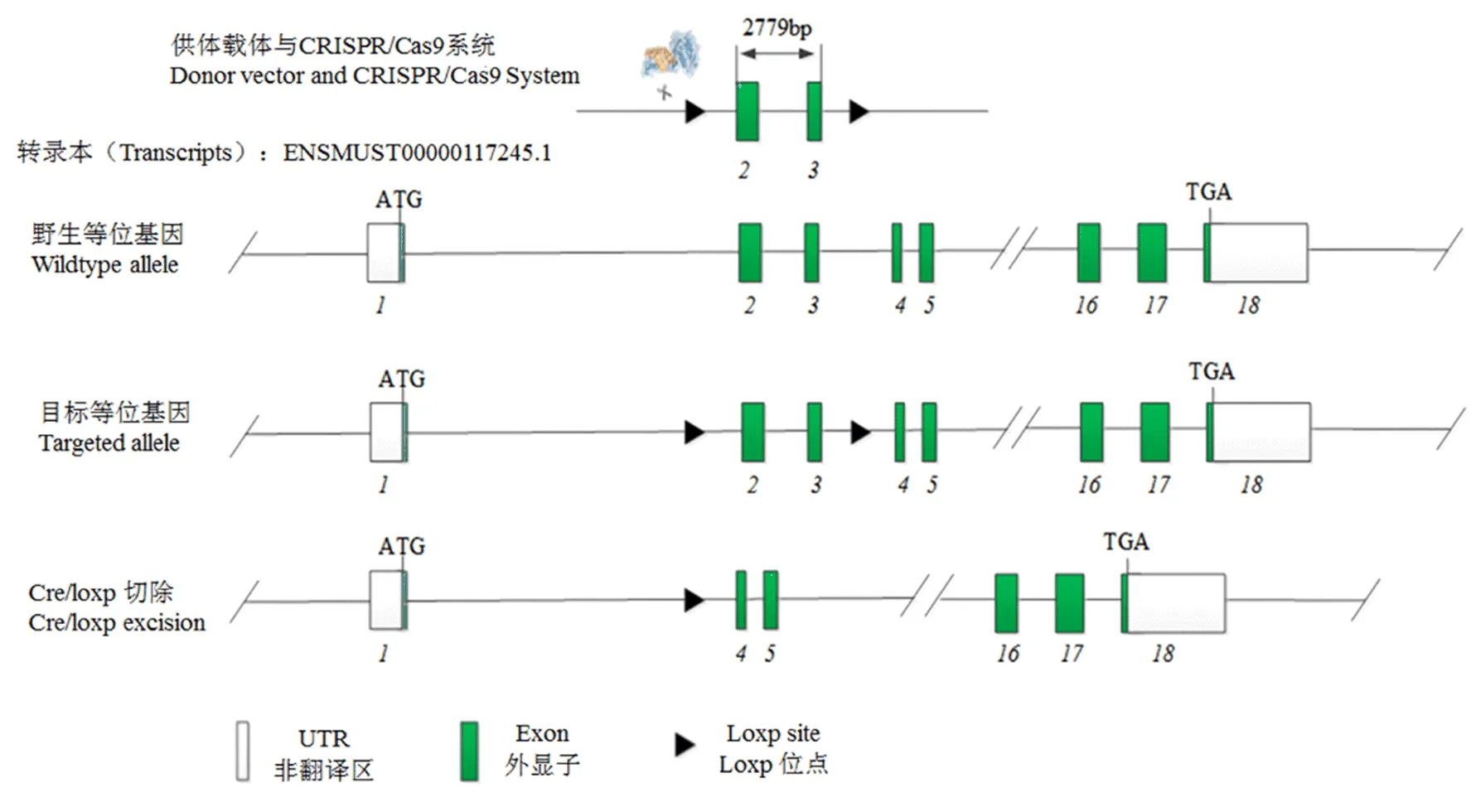
图1 ASPP2肝脏条件性敲除小鼠的构建策略
1.3 载体的设计、构建和纯化 使用麻省理工学院的CRISPR Design 工具(http://crispr.mit.edu/),依据 Score 的高低设计一对长度为20 bp 的针对靶标 DNA 的寡聚核苷酸链序列,用于制备向导RNA (small guide RNA, sgRNA),sgRNA序列见表1。根据 sgRNA 序列,设计一个携带靶位点同源区域和 Loxp 位点的重组质粒,并在该靶区域设计引物,用于后续小鼠的基因鉴定,鉴定策略见图2,引物信息见表2(引物均由生工生物工程上海股份有限公司合成),测序引物信息见表3,反应体系见表4。制作携带靶位点同源区域和LoxP 位点片段的重组质粒,将重组质粒转化到DH5a 感受态细胞,通过氨苄青霉素抗性和插入片段测序,对阳性克隆质粒进行筛选和鉴定,挑选正确的菌落克隆,扩大培养后提取质粒并纯化,获得的片段产物用于注射使用。

表1 sgRNA序列

表2 ASPP2-flox小鼠鉴定引物
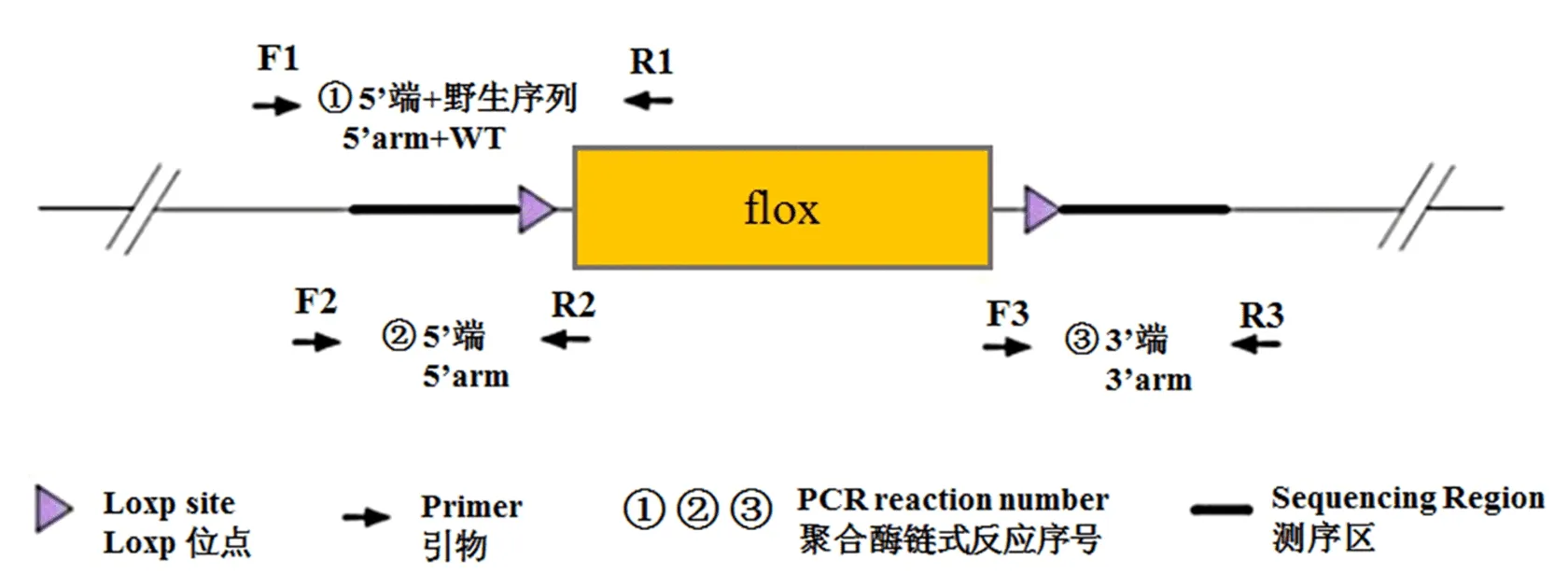
图2 ASPP2肝脏条件性敲除小鼠基因型鉴定策略
野生型:聚合酶链式反应只获得单一的243 bp或669 bp或754 bp条带;杂合子:聚合酶链式反应获得243 bp、330 bp或669 bp、423 bp或754 bp、399 bp条带;纯合子:聚合酶链式反应只获得单一的330 bp或423 bp或399 bp条带。

表3 测序引物序列
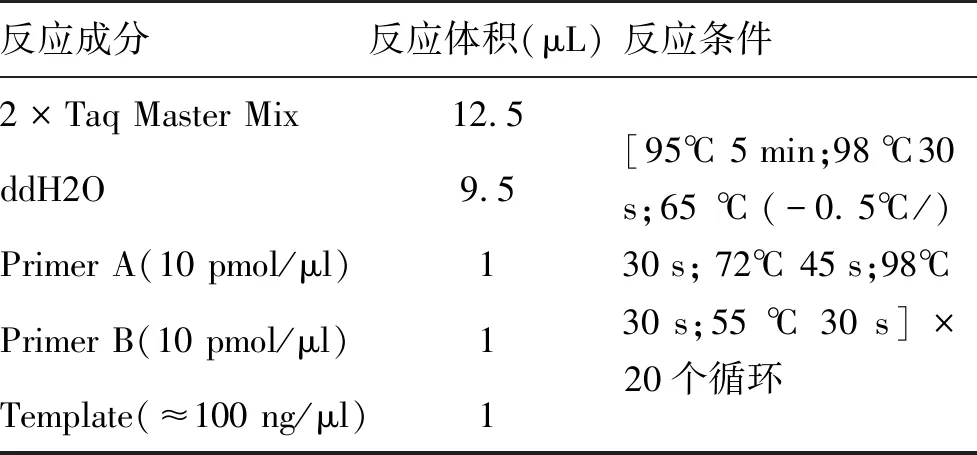
表4 聚合酶链式反应体系及条件
1.4 肝脏敲除ASPP2基因小鼠的获得 将 sgRNA 表达载体线性化,经酚氯仿抽提纯化,作为模板用于体外转录,并使用 MEGAshortscript Kit 体外合成 sgRNA。将转录好的 sgRNA 和 cas9 以及纯化后的重组片段混合并调整浓度,使用显微注射仪将混合物显微注射到BALB/c小鼠受精卵,再将受精卵移植到假孕的 BALB/c 母鼠子宫,等待 ASPP2-flox F0 代小鼠出生。在 F0 代小鼠出生后 5~7 d,采用剪脚趾法标记小鼠,并剪取鼠尾组织,经酚氯仿法提取DNA,依据上述在靶区域设计的引物进行基因型鉴定,选取PCR检测为杂合子表型的样品进行测序。 将PCR检测和测序正确的F0代小鼠与野生型BALB/c 小鼠进行交配,产生 F1代小鼠。采用上述鉴定方法对 F1 代小鼠进行基因型鉴定,并测序验证,获得的阳性 F1 代杂合子小鼠即可稳定地遗传。将F1代ASPP2-flox小鼠与C57b6l/J Alb-Cre小鼠交配,获得ASPP2fl/-CreT小鼠,用得到的该基因型小鼠与BALB/c 背景的ASPP2fl/-小鼠回交5代以上,得到BALB/c.B6J ASPP2fl/flCreT小鼠,即为肝脏敲除ASPP2基因的小鼠。基因型检测引物见表2和表5。

表5 Cre 鉴定引物
1.5 ASPP2基因肝脏条件性敲除小鼠肝脏蛋白表型表达检测 取ASPP2fl/flCreT小鼠,采用脱颈椎处死,快速取得肝组织,将一部分肝组织放入4%多聚甲醛溶液中固定,常规制备石蜡切片,采用免疫组化法(SP法)进行ASPP2蛋白表达检测;将另一部分肝组织放入液氮速冻后,置于-80℃冰箱保存,后期提取总蛋白,测蛋白浓度、电泳转膜、封闭、抗体孵育,凝胶成像系统检测ASPP2蛋白表达。
2 结果
2.1 ASPP2-flox基因型鉴定和测序结果 将F0代和F1代ASPP2-flox小鼠的鼠尾组织PCR产物进行琼脂凝胶电泳,杂合子基因型小鼠可以获得243 bp和330 bp(5'arm+wt)或669 bp和423 bp(5'arm)或754 bp和399 bp(3'arm)条带。如61、63、66号小鼠即为F1代阳性杂合子(ASPP2fl/-,图3)。进一步测序发现,loxp位点序列为ATAACTTCGTATAATGTATGCTATACGAAGTTAT,说明61、63、66号小鼠是阳性杂合子小鼠无误(图4),可供后续繁育。
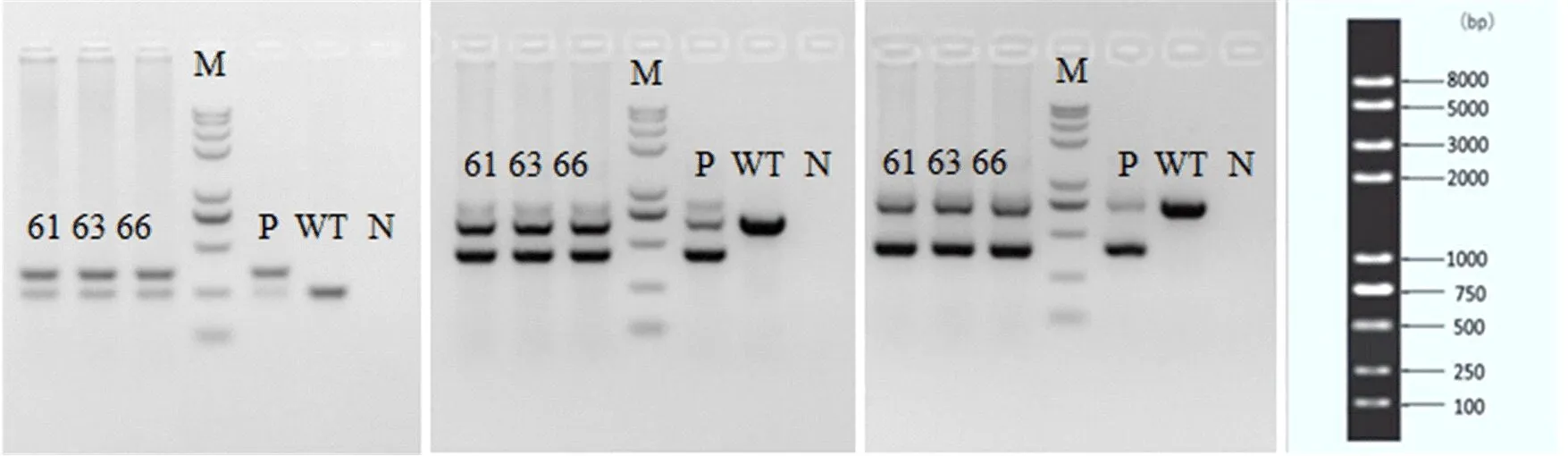
图3 ASPP2-flox小鼠 F1代基因型鉴定P:阳性对照;WT:野生型对照;N:阴性对照;M:分子量标准
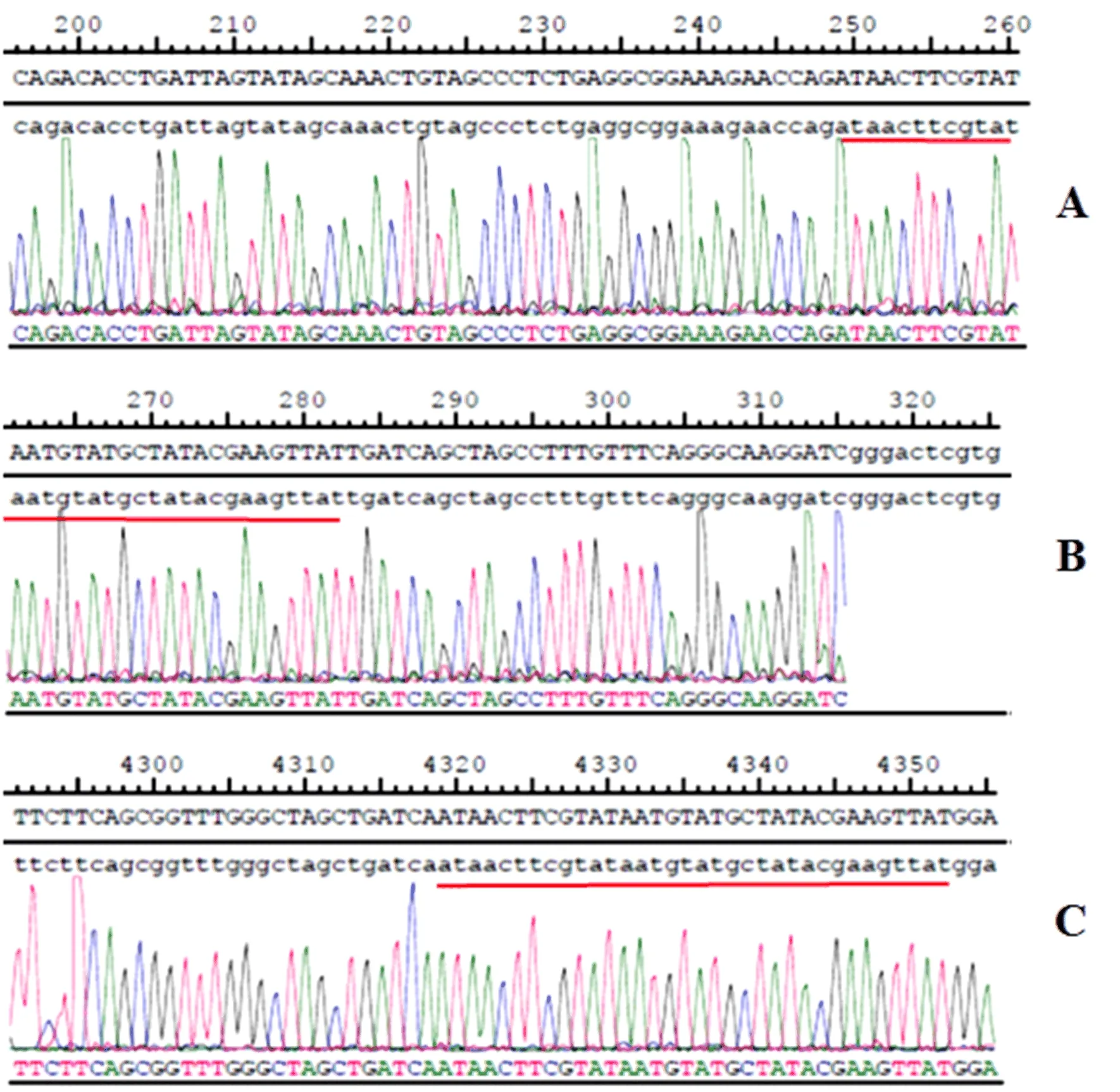
图4 ASPP2-flox小鼠 F1代鼠尾组织基因测序鉴定结果A和B:5’端测序结果;C:3’端测序结果为测序位点
2.2 ASPP2肝脏条件性敲除(ASPP2fl/flCreT)鉴定情况 将ASPP2fl/flCreT小鼠的鼠尾组织PCR产物经琼脂糖凝胶电泳,检测ASPP2基因:Flox/flox(fl/fl) 基因型小鼠显示为330 bp和399 bp单一条带,即311、312、316、320、322、325、326;Flox/wt(fl/wt)基因型小鼠显示为243 bp和330 bp或745 bp和399 bp两条带,即313、314、317、319、32、323、327、328、329;其余小鼠为野生型,仅显示为243 bp或745 bp条带。检测Alb-cre基因:Mut/wt基因型小鼠显示为390 bp单一条带,即为311、312、314、316、317、321、325、326、327、328、329;其余小鼠为野生型,显示为351 bp条带(图5)。因此,311、312、316、325、326号小鼠为ASPP2fl/flCreT小鼠(显示为330、399、390 bp条带),即肝脏特异敲除的小鼠模型。
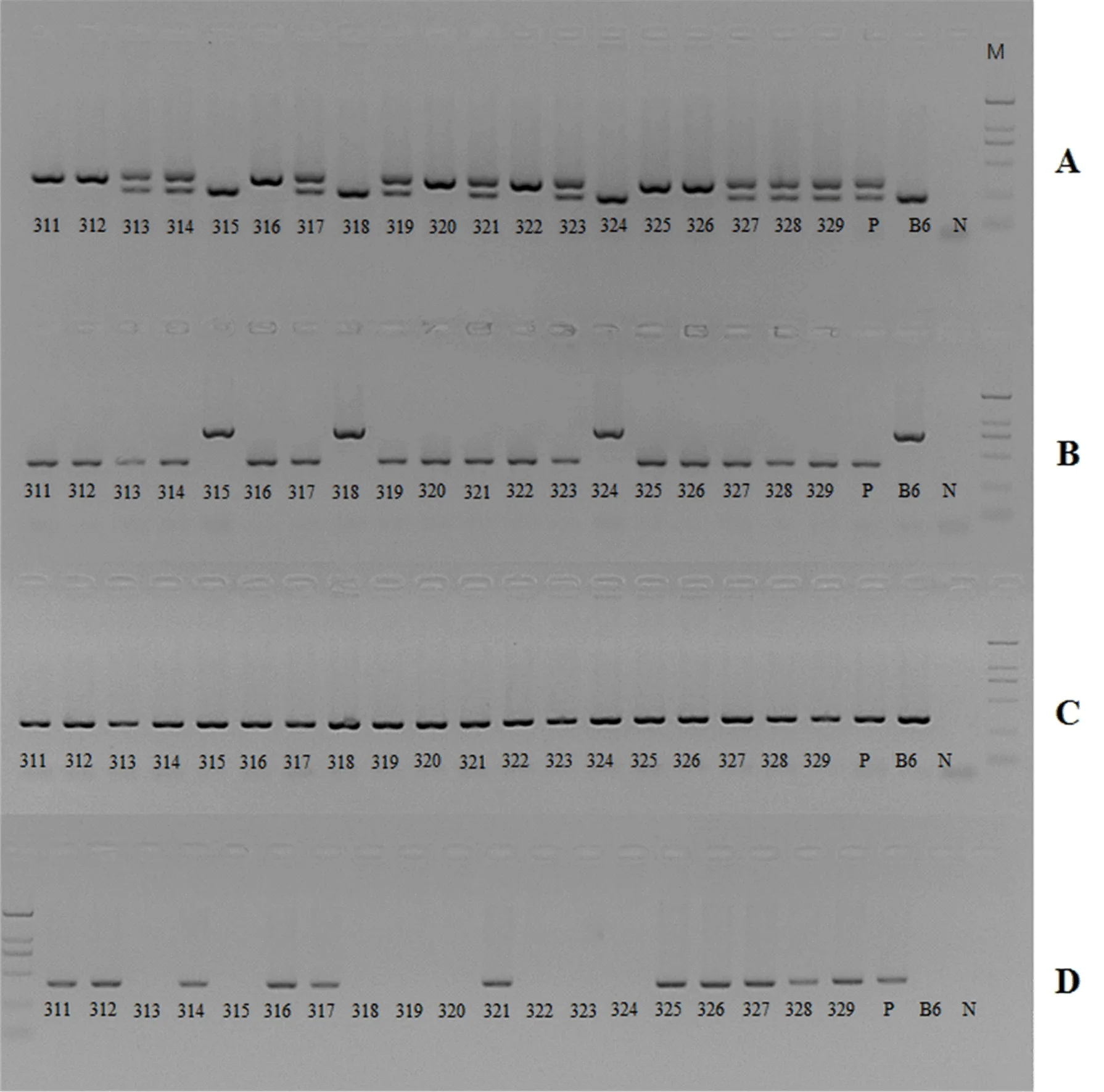
图5 ASPP2肝脏条件性敲除(ASPP2fl/fl CreT)小鼠基因型鉴定结果A:243 bp和330 bp条带;B:754 bp和399 bp条带;C:351 bp条带;D:390 bp条带;P:为阳性对照;B6:阴性对照(B6小鼠基因组DNA);N:无模板的对照;M: DL2000 分子量标记,2000 bp/1000 bp/750 bp/500 bp/250 bp/100 bp
2.3 ASPP2基因肝脏条件性敲除小鼠肝组织ASPP2蛋白表达情况 经Western blot检测显示,与野生小鼠比,ASPP2fl/flCreT小鼠肝组织ASPP2蛋白表达显著减弱(图6A);经免疫组化检测显示,ASPP2主要表达于肝细胞核。与野生小鼠比,ASPP2fl/flCreT小鼠肝组织ASPP2阳性细胞数显著减少(图6B)。

图6 ASPP2基因肝脏条件性敲除小鼠肝组织ASPP2蛋白表达A:Western blot法检测ASPP2蛋白表达;B:ASPP2蛋白主要表达于细胞核(SP法,200×)
3 讨论
基因敲除包括全身性基因敲除和条件性基因敲除两种方法,其中全身性基因敲除是指在小鼠所有组织细胞,将靶基因敲除掉,从而使靶基因的表达缺失[18,19]。本文所提及的基因条件性敲除是利用Cre-Loxp 重组系统,将 Cre 基因插入特定的启动子序列后面,即可人为地控制 Cre 基因在某些细胞谱系或者在机体发育的特定时间段抑或在外源性药物诱导下表达,表达的 CRE 蛋白识别特定的 DNA序列 (如 Loxp 位点),并进行 Loxp 位点之间的靶基因剪切,从而实现目的基因在特定细胞类型中功能性缺失[20]。
本研究利用CRISPR/Cas9 技术,通过同源重组的原理,对ASPP2靶基因进行flox 修饰,即在ASPP2基因2、3外显子两侧插入Loxp序列,构建ASPP2-flox小鼠。该flox 小鼠与肝脏特异性的Cre 工具鼠(Alb-Cre)交配后,可获得肝脏特异性敲除ASPP2基因的小鼠。本研究采用了PCR对F0代和F1代ASPP2-flox小鼠的基因型进行了检测,显示为243 bp和330 bp (5'arm+wt)或669 bp和423 bp(5'arm)或754 bp和399 bp(3'arm)条带,基因型为ASPP2fl/-,测序结果显示loxp位点序列为ATAACTTCGTATAATGTATGCTATACGAAGTTAT,提示ASPP2-flox 杂合小鼠模型构建成功。F1代杂合小鼠与Alb-Cre小鼠进行杂交后,回交ASPP2 fl/-小鼠,得到基因型为ASPP2fl/flCreT的小鼠,即得到ASPP2肝脏条件性敲除小鼠,PCR检测基因结果显示为30 bp、399 bp和390 bp条带。经Westernblot和免疫组化法检测显示ASPP2fl/flCreT小鼠肝脏ASPP2 蛋白表达显著减弱。
综上所述,基因型、测序和蛋白表达分析结果均显示基于Cre-LoxP系统成功构建了ASPP2基因肝脏条件性敲除小鼠,该模型可以为下一步研究ASPP2在肝病发生过程中的作用提供模型基础。
