更换饲料对家蚕幼虫肠道细菌组成的影响及关键物种与产茧性能的相关性
2022-03-17张雨丽刘艳伟陆俣伽崔为正闭立辉王平阳张桂征
张雨丽, 曾 珠, 刘艳伟, 陆俣伽, 韦 伟,鲁 成, 崔为正, 闭立辉, 王平阳, 张桂征,*
(1. 广西蚕业科学研究院, 南宁 530007; 2. 西南大学蚕桑纺织与生物质科学学院, 重庆 400715;3. 山东农业大学林学院, 山东泰安 250100)
人工饲料饲养家蚕Bombyxmori具有高效、有利于防病、可标准化等诸多优势(何金涛等, 2020),是蚕丝产业转型升级的重要途径。人工饲料饲养家蚕与桑叶饲养在代谢方面有诸多不同(Dongetal., 2017),人工饲料饲养家蚕产丝量少、丝蛋白合成效率低等问题一直阻碍人工饲料养蚕技术的应用。目前养蚕业生产上主要推行使用人工饲料饲养小蚕、大蚕更换为桑叶的一种省力化模式(崔为正等, 2016; 金勤生等, 2019)。
前人研究表明,饲料的转换会导致家蚕肠道微生物发生变化。相辉等(2007)探讨了家蚕食性与其肠道微生物群落可能的关系,用含桑叶粉的饲料与不含桑叶粉饲料饲养家蚕,优势菌肠球菌属Enterococcus的组成在家蚕品系和不同食料喂养条件下有着一定的变化,无桑饲料喂养条件下家蚕品系中肠内还出现了新的次优势菌葡萄球菌属Staphylococcus。向芸庆等(2010)利用不同的桑科植物柘叶与桑叶分别饲养家蚕, 发现家蚕肠道微生态细菌种群组成发生变化,柘叶饲养不如桑叶饲养家蚕的肠道菌群丰富,推测这种改变可能与柘叶饲养的家蚕生长发育不良、容易患病具有相关性。Liang等(2014)比较了饲喂生菜与饲喂桑叶的家蚕肠道微生物变化,发现饲喂生菜的家蚕肠道菌群多样性明显低于饲喂桑叶的,优势菌也不同,推测肠道菌群的变化是导致饲喂生菜的家蚕生理活性下降的原因之一。饲喂家蚕的食物中添加了病毒(孙振丽, 2016)、氟化物(Lietal., 2016)、亚精胺(Rajanetal., 2020)等物质后家蚕肠道微生物也受到很大影响。Dong等(2018)分析了全龄桑叶育和人工饲料育5 龄幼虫的肠道微生物群差异,表明与桑叶育家蚕相比,人工饲料育家蚕的肠道微生物菌群多样性和优势菌发生了很大变化,并可能与人工饲料育家蚕出现的发育、代谢和疾病抵抗性等多种问题相关。郝长富等(2019)研究发现经桑叶饲育的广食性家蚕肠道微生物多样性较高于经全龄人工饲料饲育的广食性家蚕。
从研究报道可以看出,全龄人工饲料育与桑叶育的家蚕肠道微生物多样性有很大差异,并可能与家蚕的抗病性等性状相关,但目前没有关于家蚕从食用人工饲料途中又转为食用桑叶后其肠道微生物的变化情况及与生产性能相关性的研究报道。桂蚕5号为通过广西农作物品种审定委员会审定的人工饲料适应性家蚕品种(张雨丽等, 2020),对人工饲料摄食性优,是可在生产上应用人工饲料饲养的实用性家蚕新品种。本研究旨在以桂蚕5号为材料,利用16S rDNA测序与分析技术,了解同一品种家蚕不同龄期食用人工饲料后转为食用桑叶,其肠道菌群的变化情况及与蛹重、茧层量的相关性,为人工饲料小蚕共育及全龄人工饲料工厂化饲养生产蚕茧中的蚕病防治、益生菌开发等提供指导,并为食物影响鳞翅目昆虫肠道微生物,进而影响相关生物学性状的相关研究提供参考。
1 材料与方法
1.1 试虫来源及饲育处理
1.1.1试虫来源:家蚕品种为桂蚕5号,四元杂交型生产用种(张雨丽等, 2020),二化含多化血统,4眠。在广西蚕业科学研究院养蚕室进行饲养,蚕期全龄平均温度28.03℃,全龄平均相对湿度89.01%,光周期12L∶12D。
1.1.2饲育处理:人工饲料育使用的饲料为重庆正佳饲料有限公司生产的粉体家蚕人工饲料,饲料与水按1∶1.8(m/v)(1-3龄幼虫)和1∶1.6(m/v)(4-5龄幼虫)混合,搅拌均匀后,装入保鲜袋内,每袋厚度约3 cm,采用蒸煮设备100℃隔水蒸煮40 min后取出,自然冷却后切片或切条饲喂。桑叶育使用的桑叶为广西蚕业科学研究院种植的桑树,新鲜采摘饲喂。设置5组试验: 全龄桑叶育(Mul1-5), 1-2龄人工饲料育+3-5龄桑叶育(Art1-2),1-3龄人工饲料育+4-5龄桑叶育(Art1-3), 1-4龄人工饲料育+5龄桑叶育(Art1-4)和 全龄人工饲料育(Art1-5)。每个试验组设3个重复,每个重复300头蚕。桑叶育采用常规一日三回育的饲育方法进行,1-3龄小蚕切叶饲喂,4-5龄蚕叶片育。人工饲料育时,1和2龄各给饵1次,3和4龄各给饵2次,5龄给饵3次。
1.2 家蚕肠道细菌多样性分析
于5龄第3天幼虫,每组重复随机取蚕30头,饥饿处理24 h,75%乙醇体表消毒,无菌条件下取肠道内容物,30头蚕的肠道内容物进行混合均质,提取基因组DNA,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop 2000测定DNA 浓度和纯度。
16S rDNA V3-V4区的高通量测序分析:使用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′) 对16S rDNA 基因V3-V4区进行PCR扩增。利用Illumina Miseq平台对各样本进行细菌多样性测序分析。使用Fastp软件对原始测序序列进行质控,使用Flash软件进行拼接。使用Usearch 软件,根据97%的相似度对序列进行可分类操作单位(operational taxonomic units, OTUs)聚类并剔除嵌合体。利用RDP Classifier对每条序列与Silva 数据库进行比对,设置比对阈值为70%,得到物种分类注释结果。随后对各样本进行Alpha多样性分析、物种组成分析、物种比较分析、物种差异分析及相关性分析。通过Alpha多样性指数Chao 1, Shannon和Simpson指数对各样本的细菌丰度和多样性进行评估。Chao 1指数用于反映样本中物种的丰富度,也就是指群落中包含物种的数目(OTU数目),数值越大,表明物种越丰富;Shannon指数用于反映样本群落的多样性,指数越大,表明样本群落多样性越高;Simpson指数则同时兼顾丰富度和均匀度,它反映的是在同一个样本中随机抽取2个个体,这两个个体来自不同种类的概率,Simpson指数越大则多样性越高。通过LEfSe(LDA effect size)分析不同饲育模式下家蚕肠道菌群在丰度上有显著性差异的物种(biomarker)。利用Spearman相关性热图对LEfSe’结果所得到的属水平上的显著性差异物种与蛹重和茧层量的相关性进行分析。
1.3 全茧量、茧层量及蛹重测定
蚕上蔟六足天时,销开茧壳,每个重复选取雌雄茧各25粒,称取全茧量和茧层量,计算各试验组平均全茧量、茧层量及蛹重。
1.4 数据分析
所有试验进行3次重复,结果由平均值±标准差表示,用SPSS20软件分析数据,多组比较采用One-Way ANOVA中Duncan氏多重检验来分析,P<0.05表示有统计学意义。
2 结果
2.1 人工饲料与桑叶不同搭配饲育模式对家蚕茧质的影响
由表1可知,人工饲料与桑叶不同搭配的饲育模式对家蚕茧质有显著的影响。从全茧量来看,Mul1-5组和Art1-5组的全茧量最高,二者无显著性差异(P>0.05);其次是Art1-2组(比Mul1-5组低3.86%);Art1-3和Art1-4组的全茧量最低,二者差异不显著(P>0.05)。 从茧层量来看,Mul1-5组茧层量最高,其次是Art1-2组(比Mul1-5组低7.2%);然后是Art1-3和Art1-4组,二者差异不显著(P>0.05);Art1-5组茧层量最低,比Mul1-5组低22%。从蛹重来看,随着人工饲料饲养时间的延长,蛹重有降低的趋势,但是全龄人工饲料育(Art1-5组)的蛹重却达到最高。

表1 不同饲育模式下的家蚕全茧量、茧层量和蛹重Table 1 The whole cocoon, cocoon layer and pupal weights of Bombyx mori under different rearing patterns
2.2 家蚕幼虫肠道细菌16S rDNA序列组装与拼接
5组不同的饲育模式下共收集家蚕幼虫肠道样品15个(每组重复3次),通过细菌16S rDNA测序共得到1 074 926条有效的序列,其中样本最大序列数为76 462条,最小序列数为65 238条,样本Mul1-5的平均有效序列数为73 074条,Art1-2的为70 460条,Art1-3的为68 492条,Art1-4的为72 667条,Art1-5的为73 616条,样本测序数目较大,能够充分保证数据的可靠性。样本序列长度为200~500 bp不等,有98.2% reads序列长度在400~500 bp。
对OTU聚类分析发现,Art1-2组家蚕肠道细菌OTU数目最多,为484; Art1-3组的OTU数目最少,为284;其他3组的OTU数目几乎相同。通过Venn图比较5组家蚕共有和独特的OTU数目(图1),5组家蚕肠道细菌共有96种OTUs,表明5组家蚕肠道细菌具有较多的相同物种。另外,有73种肠道细菌是Mul1-5组独有的,有286种是Art1-2组独有的,有81种是Art1-3组独有的,有132种是Art1-4组独有的,有125种是Art1-5组独有的,表明人工饲料饲育不同龄期再更换为桑叶育后家蚕肠道细菌某些种类发生了变化。
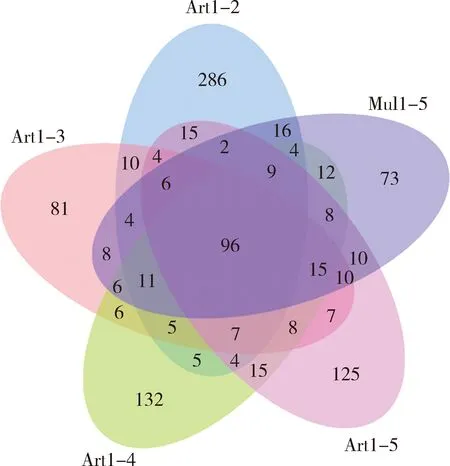
图1 不同饲育模式下家蚕幼虫肠道细菌OTU分布Venn图Fig. 1 Venn diagram of OTUs of intestinal bacteria inBombyx mori larvae under different rearing patterns
2.3 家蚕幼虫肠道细菌Alpha和Beta多样性
与Mul1-5组相比,其他4组的Chao 1指数均无显著性差异(P>0.05),但是Art1-2组Chao 1指数显著高于Art1-3组(P<0.05),表明Art1-2含有的细菌物种数量显著高于Art1-3组。5组的Shannon指数和Simpson指数均无显著性差异(P>0.05),表明更换饲料对家蚕肠道细菌物种多样性无显著影响(图2)。

图2 不同饲育模式下家蚕幼虫肠道细菌Alpha多样性指数Fig. 2 The alpha diversity indices of intestinal bacteria of Bombyx mori larvae under different rearing patternsA: Chao 1指数Chao 1 index; B: Shannon指数Shannon index; C: Simpson 指数Simpson index.
进一步通过肠道细菌Beta多样性(PCoA)分析不同饲育模式下家蚕幼虫肠道菌群的整体结构变化。通过PCoA分析可以观察组内样品或组间样品的差异,不同样本间的距离代表其物种组成的差异情况,样品距离越近,说明样品之间的细菌组成结构越相似,差异性越小。由图3所示,PCoA1和PCoA2的样品差异性贡献率分别为82.15%和6.36%,是差异的主要来源。 与Art1-2组相比,Art1-3, Art1-4和Art1-5组与之的凝聚距离较大,说明家蚕肠道细菌群落结构具有明显的不同。 而Art1-3, Art1-4和Art1-5 3组之间的距离较近,说明家蚕肠道细菌群落结构相似。
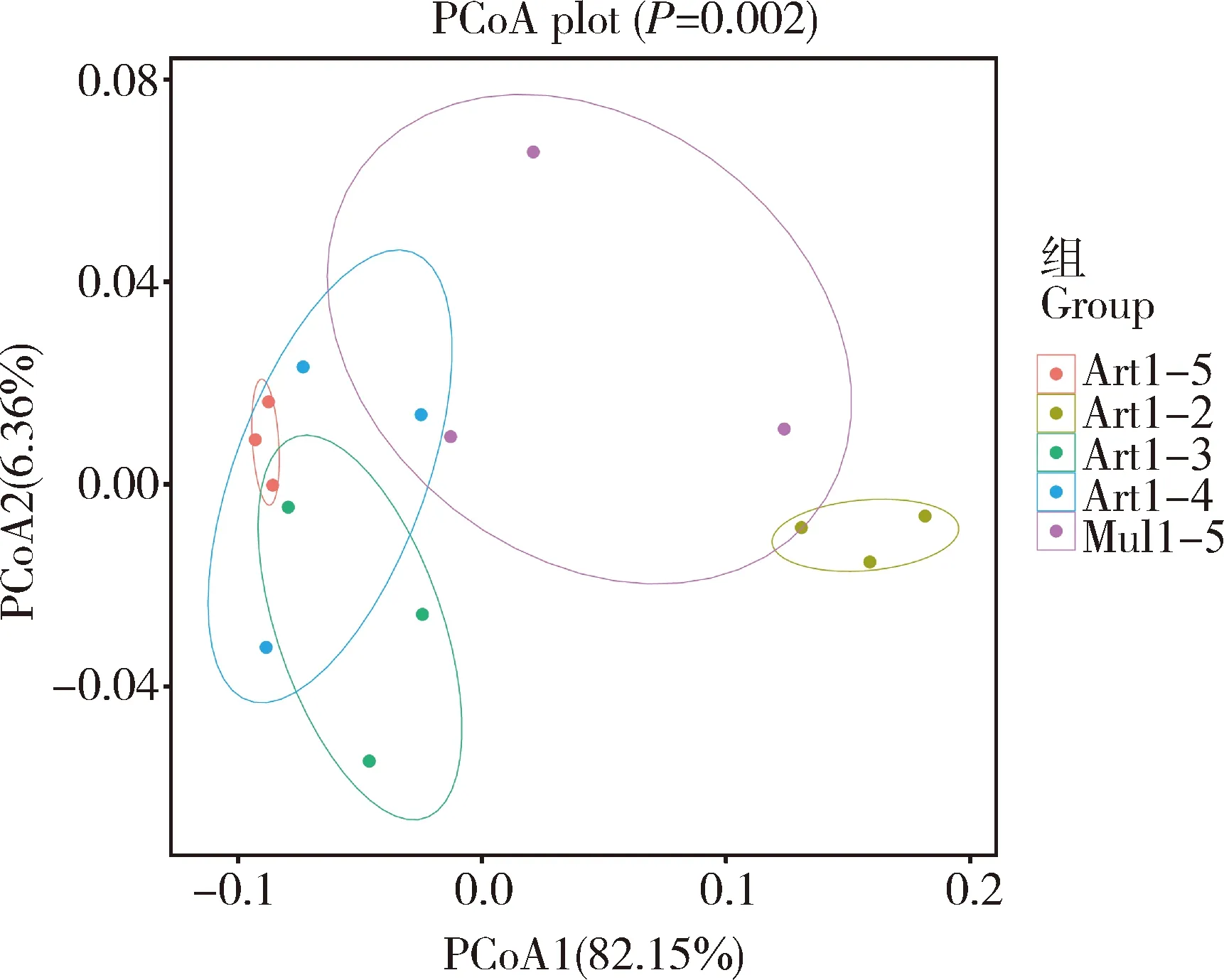
图3 不同饲育模式下家蚕肠幼虫道细菌的Beta多样性分析——基于Bray-Curtis距离的主成分分析Fig. 3 Beta diversity analysis of intestinal bacteria ofBombyx mori larvae under different rearing patternsbased on the Bray-Curtis distance: Principalcoordinate analysis (PCoA)
2.4 家蚕幼虫肠道菌群结构
为了研究不同饲育模式对家蚕肠道细菌分类组成的影响,我们分别在门和属水平上进行了分类分析。在门水平上,5组家蚕肠道中含量最丰富的菌群均是变形菌门(Proteobacteria),其次是厚壁菌门(Firmicutes)(图4),但在Mul1-5组中,两种菌群分别占总菌群的73.9%和23.5%,比值约为3.1∶1,在Art1-2组中分别占总菌群的54.3%和42.8%,比值约为1.3∶1。而在Art1-3, Art1-4和Art1-5组中,它们分别占总菌群的89.2%/8.7%, 91.8%/5.8%和96.1%/1.0%,比值分别为10.2∶1, 15.9∶1和96.1∶1。

图4 不同饲养模式下家蚕幼虫肠道细菌在门水平的相对丰度Fig. 4 Relative abundance of intestinal bacteria at the phylum level in Bombyx mori larvae under different rearing patterns
在属水平上,5组家蚕肠道主要含有假单胞菌属Pseudomonas、肠球菌属Enterococcus、鞘脂单胞菌科未分类菌属Sphingomonadaceae unclassified及罗尔斯通菌属Ralstonia(图5)。各组家蚕菌属丰度差异较大的是假单胞菌属和肠球菌属。对于假单胞菌属,Mul1-5组和Art1-2组丰度无明显差异,但显著低于Art1-3, Art1-4和Art1-5组。对于肠球菌属,Art1-2组丰度最高占40.9%,其次是Mul1-5组占22.7%,在Art1-3, Art1-4和Art1-5中丰度逐渐降低,分别占8.1%, 4.6%和0.02%。

图5 不同饲育模式下家蚕幼虫肠道细菌在属水平的相对丰度(A)及具有显著性差异的假单胞菌属(B)和肠球菌属(C)的相对丰度Fig. 5 Relative abundance of intestinal bacteria at the genera level in Bombyx mori larvae under different rearingpatterns (A) and the relative abundance of Pseudomonas (B) and Enterococcus (C) with significant difference
2.5 家蚕幼虫肠道显著性差异的细菌物种
如图6所示,Mul1-5组中选择性地富集了15种细菌,包括柄杆菌科(Caulobacteraceae)、柄杆菌目(Caulobacterales)、未被培养的柄杆菌种(unculturedCaulobactersp.)、柄杆菌属Caulobacter以及沙壤土杆菌属Ramlibacter等。 Art1-2组中富集了肠球菌属、肠球菌科(Enterococcaceae)、粪肠球菌Enterococcusfaecium、乳酸杆菌目(Lactobacillales)、乳酸杆菌属Lactobacillus、杆菌纲(Bacilli)和厚壁菌门等。 Art1-3组中只富集了鹑鸡肠球菌Enterococcusgallinarum。Art1-5组中则富集了变形菌门、γ变形菌纲(Gammaproteobacteria)、柯克斯体科(Coxiellaceae)、α-变形杆菌纲(Alphaproteobacteria)、柯克斯体属Coxiella、短波单胞菌属Brevundimonas、柄杆菌Caulobactersp. NW-2013-Rh15、绿弯菌门(Chloroflexi)、绿弯菌纲(Chloroflexia)、热微菌目(Thermomicrobiales)、生丝微菌Hyphomicrobiumdenitrificans等。
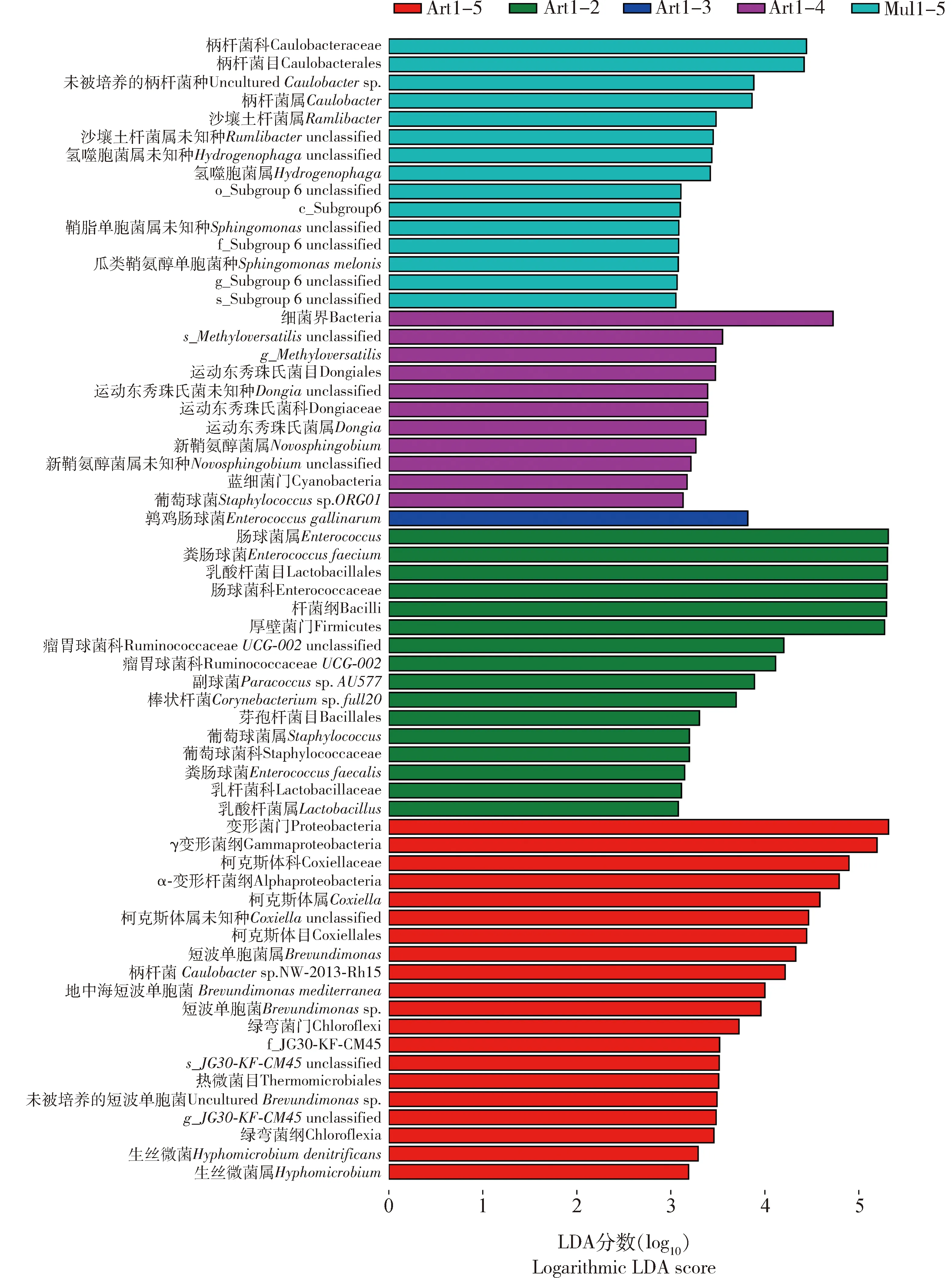
图6 采用Kruskal-Wallis秩和检验分析在0.05的显著性水平上具有显著性差异的不同饲育模式下家蚕幼虫肠道细菌物种Fig. 6 The significant differential intestinal bacteria in Bombyx mori larvae under different rearing patternsusing the nonparametric factorial Kruskal-Wallis rank sum test at a significance level of 0.05LDA得分高于2分表示相应组别的细菌相对丰度高于其他4组的。An LDA score higher than 2 suggests higher relative abundance of bacteria in the corresponding group than in the other four groups.
2.6 家蚕幼虫肠道关键细菌与蛹重和茧层量的相关性
如图7所示,LEfSe分析结果表明家蚕幼虫肠道中的某些细菌与蛹重以及茧层量均存在显著相关性。柯克斯体属与蛹重呈显著正相关,与茧层量呈显著负相关;葡萄球菌属与蛹重呈显著负相关;肠球菌属与茧层量呈显著正相关。

图7 不同饲育模式下家蚕幼虫肠道关键细菌物种与蛹重和茧层量的Spearman相关性热图Fig. 7 Spearman correlation heatmap of the correlationbetween the key intestinal bacteria in Bombyx morilarvae under different rearing patterns and thepupal weight and cocoon layer weight颜色范围从蓝色(负相关)到红色(正相关),**P<0.01为显著相关。The colors range from blue (negative correlation) to red (positive correlation), and significant correlations are shown by **P<0.01.
3 讨论
目前,蚕业生产上常用的家蚕品种多为4眠性品种,这些品种的家蚕幼虫要经历4次蜕皮、5个幼虫龄期才能结茧。与桑叶育相比,人工饲料饲育的家蚕产丝量少、丝蛋白合成效率低的问题一直未得到解决。研究者试图通过对比分析全龄人工饲料育与桑叶育家蚕的蛋白质组学(Zhouetal., 2008)、代谢组学(Dongetal., 2017)及肠道微生物差异(Dongetal., 2018)来分析其潜在的机理。但以上相关研究均采用的全龄人工饲料与桑叶育进行对比,本研究使用人工饲料与桑叶相结合饲喂家蚕不同龄期幼虫,即全龄桑叶育(Mul1-5)、1-2龄人工饲料育+ 3-5龄桑叶育(Art1-2)、1-3龄人工饲料育+ 4-5龄桑叶育(Art1-3)、1-4龄人工饲料育+5龄桑叶育(Art1-4)和全龄人工饲料育(Art1-5)5种饲养模式,更加全面地分析了家蚕在更换了饲料以后幼虫肠道细菌的变化情况及与基本生产性状——蛹重、茧层量的相关性,对人工饲料+桑叶相结合饲喂家蚕的饲养模式更有指导意义。
从全茧量来看,随着人工饲料饲育时间的延长,全茧量逐渐降低,但值得关注的是全龄人工饲料育的全茧量并没有最低,反而达到最高(表1),与全龄桑叶育的无显著差异(P>0.05),蛹重的变化趋势与全茧量的变化趋势保持一致。从茧层量来看,随着人工饲料饲育时间的延长,茧层量呈现逐渐降低的趋势,全龄人工饲料育的茧层量最低。Dong等(2017)研究发现全龄人工饲料育的家蚕茧层量显著低于全龄桑叶育,本研究结果(表1)与其保持一致。全龄人工饲料育的家蚕全茧量在5种饲育模式中最高而茧层量最低,推测该饲育模式最有利于蚕蛹的生长发育,但产丝量最低。综合全茧量和茧层量两项指标来看,1-2龄人工饲料育+ 3-5龄桑叶育(Art1-2)这种饲育模式最接近于全龄桑叶育,可为生产上人工饲料小蚕共育提供参考。
肠道微生物群对宿主营养、病原体抗性和代谢等功能至关重要(Nicholsonetal., 2012),并受到宿主食物的巨大影响(De Filippoetal., 2010)。本研究分析了人工饲料与桑叶不同搭配饲育模式下家蚕肠道菌群的变化,并分析了肠道菌群与家蚕茧质的相关性。从Alpha多样性分析结果来看,与全龄桑叶育(Mul1-5组)相比,添加人工饲料的其他4组的Chao1指数、Simpson指数和Shannon指数均无显著性差异(P>0.05)(图2),表明更换饲料对家蚕肠道细菌丰富度及多样性无显著影响。但值得注意的是,Art1-2组Chao 1指数显著高于Art1-3组(P<0.05),表明1-2龄人工饲料育+3-5龄桑叶育家蚕肠道细菌所含有的物种数量显著高于1-3龄人工饲料育+4-5龄桑叶育的,具体的机制有待进一步研究。从Beta多样性分析结果来看,Art1-3, Art1-4和Art1-5 3组之间的细菌物种多样性较相似,但是与Art1-2组相比肠道细菌群落结构具有明显的不同(图3)。具体的细菌分类组成方面,在门水平上,Art1-2组和Mul1-5的细菌组成最相近,优势菌主要是变形菌门(分别为54.3%和73.9%)和厚壁菌门(分别为42.8%和23.5%);而Art1-3, Art1-4和Art1-5三组的细菌组成最相近,变形菌门随着饲料养蚕时间的增加逐渐增加,在Art1-5组中占比为96.1%,厚壁菌门则呈现相反的趋势,在Art1-5组中降低至1.0% (图4)。在属水平上,本研究发现家蚕肠道优势菌属有假单胞菌属、肠球菌属、鞘脂单胞菌科未分类菌属及罗尔斯通菌属等。Chen等(2018)对大造品系家蚕肠道细菌进行宏基因组测序,共鉴定了包括肠球菌、芽孢杆菌属Bacillus、肠杆菌属Enterobacter、葡萄球菌属、不动杆菌属Acinetobacter等在内的663种细菌,并分析了家蚕不同发育阶段的肠道微生物情况,发现早龄期和晚龄期肠道菌群结构具有明显变化。Hou等(2018)通过高通量测序技术发现5龄幼虫肠道主要的菌属包括假单胞菌属、肠球菌属、葡萄球菌属、节细菌属Arthrobacter和乳杆菌属Lactobacillus。Yeruva等(2020)通过宏基因组测序发现家蚕优势菌属主要包括乳杆菌属、芽孢杆菌属和肠球菌属。可见,肠球菌属是家蚕最常见的优势菌属,在较多研究中都有报道,而其他的一些菌属在不同的研究中存在差异,其原因可能是因为家蚕品系、人工饲料组成及收集肠道微生物的龄期等因素。本研究中,人工饲料与桑叶不同搭配的5种饲育模式中,家蚕肠道菌属丰度差异最大的是肠球菌属(图5: C)。Art1-2组中肠球菌属丰度最高(40.9%),随着人工饲料养蚕时间的延长,丰度逐渐降低,在全龄人工饲料饲育模式中仅为0.02%。相辉等(2007)报道,肠球菌的多样性随着家蚕的品种、喂养条件及生理状况等呈现动态变化的趋势。肠球菌是家蚕肠道中的高频微生物,在家蚕消化桑叶中起重要作用。也有研究发现家蚕肠球菌的丰度与增强免疫力有关(Sunetal., 2016),肠球菌可通过激活Toll和IMD免疫通路发挥促免疫的作用(Kumaretal., 2019)。因此,推测肠球菌在人工饲料养蚕中丰度的降低可能与饲料养蚕体质弱有关。在本研究中另一个变化较显著的菌种是假单胞菌属,其在Mul1-5组和Art1-2组的丰度显著低于其他3组(图5: B),表明随着添加人工饲料时间的延长可能会增加假单胞菌在肠道中的比例。假单胞菌是一种常见的条件致病菌,通常在昆虫体内或体外少量存在,正常情况下不会引起疾病,但在昆虫受到一定的胁迫和/或当昆虫的免疫系统减弱时,它们可能会致病(Maciel-Vergaraetal., 2018),因此推测假单胞菌可能是引起全龄人工饲料养蚕体弱多病的另一因素。
通过LEfSe分析不同饲养模式下家蚕肠道菌群显著性差异,发现各组均有差异显著性物种,且部分关键物种与茧质呈现一定的相关性。例如肠球菌属与茧层量呈显著正相关;柯克斯体属与蛹重呈显著正相关,与茧层量呈显著负相关;葡萄球菌属与蛹重呈显著负相关(图7)。肠球菌属属于革兰氏阳性、不产孢子的兼性厌氧菌,属于乳酸菌的一类,迄今为止,肠球菌属已知包括的种达到36个,其通常存在于人类和动物的肠道、乳制品以及环境中。肠球菌属里的某些种如粪肠球菌Enterococcusfaecium和E.faecalis是研究得较多的菌种,可以促进人的系统性免疫,也被证实能够促进动物的生产性能(Nueno-Palop and Narbad, 2011; Liuetal., 2017)。肠球菌也是家蚕肠道中的高频微生物,在家蚕中被报道具有提高免疫力(Sunetal., 2016)和抑制微孢子虫孢子发芽的作用(鲁兴萌和汪方炜, 2002)。本研究中发现肠球菌属与茧层量呈显著正相关,表明其可能在促进产丝量方面具有重要作用,这在家蚕中属于新的发现。家蚕对食物中营养物质的吸收利用是影响家蚕生长发育及蚕茧产量和质量的最主要因素。向桑叶中补充不同的营养物质如碳水化合物、氨基酸和蛋白质等是提高茧丝经济指标的重要策略(Konalaetal., 2013)。目前已有各方面的证据表明肠道微生物也能够为宿主提供生长所需的营养物质,如微生物可以产生必需氨基酸及分解食物中宿主难以消化的化合物(Douglas, 2017; Ceja-Navarroetal., 2019)。因此推测肠球菌可能通过促进家蚕的营养代谢从而提高产丝量,但是还需要进一步的试验验证。柯克斯体属属于γ变形菌纲,在家蚕肠道微生物中鲜有报道,但是属于大多数蜱虫的特征性营养共生菌,具有多种B族维生素的生成途径,可为宿主提供营养素(Nardietal., 2020),本研究中柯克斯体属属于Art1-5组中富集的关键物种(图6),其与蛹重呈显著正相关、与茧层量呈显著负相关,我们推测柯克斯体属可能主要通过参与B族维生素的生成促进蛹的生长发育。葡萄球菌属是已知报道的家蚕肠道中较常见的一类微生物,属于革兰氏阳性菌,多数为非致病菌,其对家蚕的功能作用目前还鲜有报道,本文中通过微生物基因功能预测的葡萄球菌属与蛹重呈显著负相关的关系,其作用机理有待于进一步研究。
人工饲料养蚕具有集约化、自动化、节省土地、有利于防病等诸多优势,因此,未来对人工饲料养蚕技术的推广及应用是蚕桑产业转型升级的必然选择。本研究分析了人工饲料与桑叶不同搭配模式饲养家蚕的肠道微生物变化情况及家蚕的生产性能差异,发现1-2龄人工饲料育+3-5龄桑叶育(Art1-2)这种饲育模式最接近于全龄桑叶育(Mul1-5),可为生产上人工饲料小蚕共育提供参考;另外,通过本研究找出可能与产丝量有关的关键细菌,可为下一步通过调控关键微生物提高全龄人工饲料养蚕的产丝量提供重要理论依据。
