脊髓性肌萎缩症携带者筛查技术研究进展
2022-03-17李烨荣张菁菁吕娟
李烨荣,张菁菁,吕娟
(南京医科大学附属妇产医院(南京市妇幼保健院)妇产科,南京210004)
脊髓性肌萎缩症(spinal muscular atrophy,SMA)是一种常染色体隐性遗传病,其发病率为1/5 000~1/10 000,居致死性常染色体隐性遗传病的第2位,在人群中的携带率约为1/35~1/85[1]。SMA临床上主要表现为进行性、对称性近端肌无力和肌萎缩,根据发病年龄和病程的不同,将其分为Ⅰ~Ⅳ型,严重程度与分型相关,Ⅰ型最重,Ⅳ型最轻,而SMA的有效治疗药物诺西那生钠价格高昂。统计发现约95%的SMA由SMN1基因的缺失突变所致,约5%是由于SMN1基因点突变导致。SMA临床表现严重,人群中的携带率较高,且致病基因明确,2008年美国医学遗传学会(American College of Medical Genetics,ACMG)[2]建议无论地域种族,应该对所有育龄人群进行SMA携带者筛查。2017年,美国妇产科学会(American College of Obstetricians and Gynecologists,ACOG)[3]也建议,孕前和产前都应进行SMA携带者筛查。目前已报道的SMA携带者筛查技术众多,根据SMA致病基因的特点,对SMN1基因外显子7、8缺失进行检测,已经成为SMA携带者筛查的首选方法。但不同方法的敏感性、特异性及经济性不同,其中临床上使用最多的方法是多重连接依赖性探针扩增(MLPA)技术和荧光定量PCR技术,但MLPA技术试剂耗材贵、操作繁琐,而荧光定量PCR无标准化方法,其稳定性有待改进。近年来随着技术的进步与发展,可用于SMA检测的一些旧方法也不断得到更新,在其基础上发展了更为简单、准确的方法;两种及两种以上方法的联合应用也可为SMA的大规模筛查提供更准确的筛查结果;数字PCR技术的逐渐成熟,为大规模筛查SMA携带者提供了基础。未来选择可以应用于人群中大规模筛查的敏感性好、特异性高和耗时短的检测方法非常重要。
1 SMA临床特征
SMA是由脊髓前角运动神经元变性导致患儿肢体近端进行性、对称性肌无力和肌萎缩等临床症状的一组疾病。根据发病年龄及病情严重程度分为4型[4]:Ⅰ型(Werdning-Hoffmann病),又称严重型,患儿通常在出生后6个月内发病,表现为肢体及躯干严重肌无力及肌萎缩,肌张力低,肌腱反射消失,无法坐立,通常在2岁前死于呼吸衰竭;Ⅱ型,又称中间型,起病稍晚,于出生后6~18个月发病,患儿表现为能坐但无法站立和行走,生存期取决于呼吸肌麻痹程度,一般超过2岁;Ⅲ型(Kugelburg-Welander病),亦称青少年型,出生18个月后发病,患儿能够独立行走,但表现为近端肢体无力,病程进展缓慢,可生存至成年;Ⅳ型,成年型,发病一般在成年期,病情进展隐匿,可出现行走困难,生存时间与正常人无明显差别[5]。
2 SMA分子机理
SMA的致病基因是运动神经元存活(survival motor neuron,SMN)基因,定位于染色体5q11.2-5q13.3区域(图1)。SMN基因在每条染色体上有2个拷贝,分别是位于端粒侧的SMN1和位于着丝粒侧的SMN2,两者高度同源,仅有5个碱基的差别(内含子6及外显子7、8各1个,内含子7为2个),二者都可编码SMN蛋白,但由于外显子7编码区域的差异碱基(c.840C>T)影响了基因的剪接模式[6],从而导致2个基因转录的产物不同。因此SMN1基因表达功能完整的全长SMN蛋白,而SMN2基因只产生约10%~20%有功能的SMN蛋白[7]。SMA的发生是由于SMN1基因的缺失或突变,而SMN2基因的拷贝数则影响SMA的严重程度。有研究表明[8],Ⅰ~Ⅲ型SMA患者大约95%~98%是由于SMN1基因纯合缺失导致的,其中大部分是同时缺失外显子7、8,少部分只缺失外显子7。
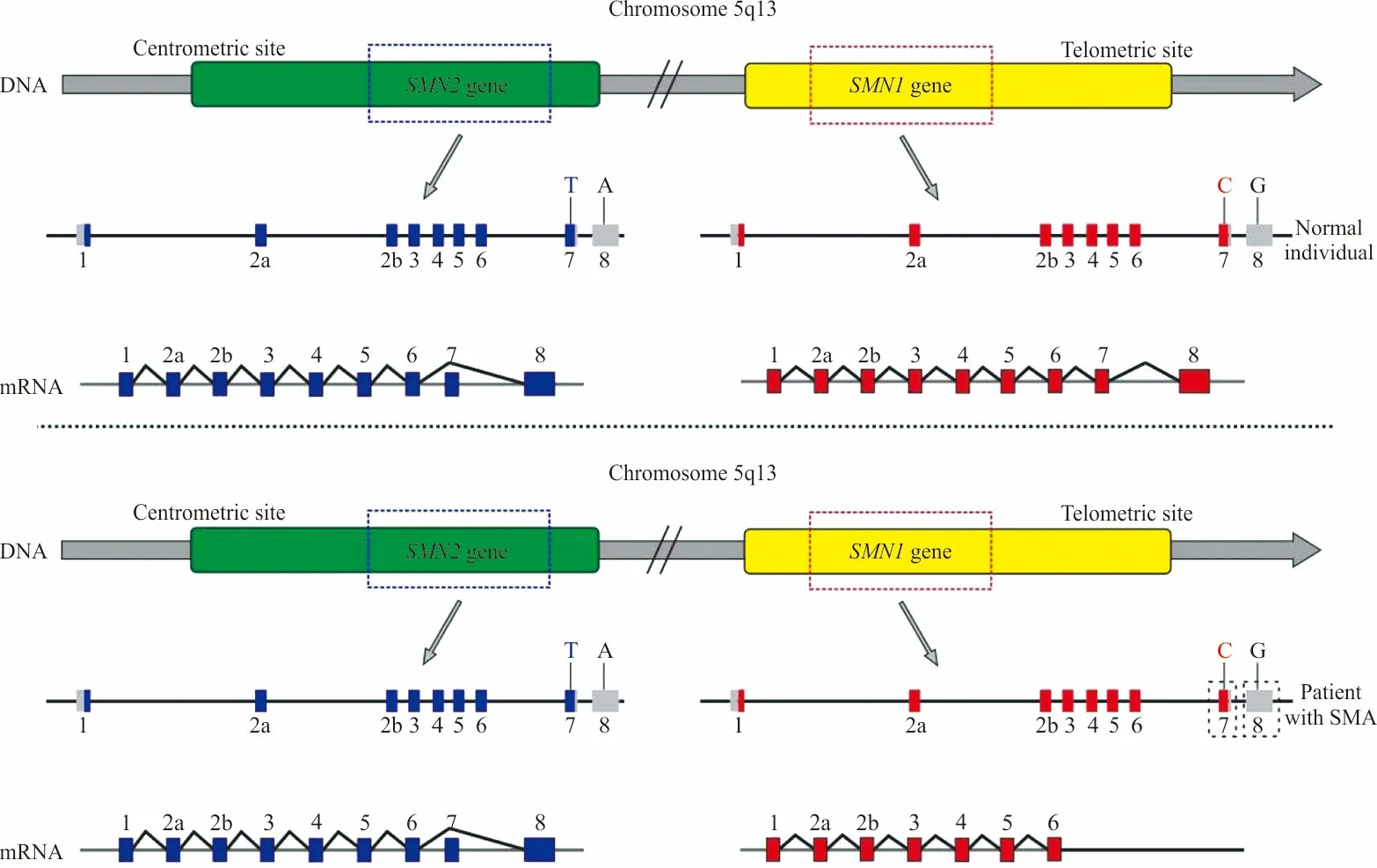
图1 SMN1和SMN2基因的常见突变形式和重要功能区
3 SMA携带者筛查技术
目前,比较成熟的SMA携带者筛查方法是通过对SMN1拷贝数进行分析,以区分正常人和SMA携带者。现对目前文献中报道的几种常见SMN基因拷贝数分析技术方法的原理、特点和价值进行归纳,以及总结其最新的研究进展。不同方法的特点及优缺点如表1。

表1 PCR-RFLP、DHPLC、MLPA、qPCR、dPCR和NGS在SMN基因拷贝数变异分析中的比较
3.1聚合酶链反应-限制性片段长度多态性分析(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP) PCR-RFLP是利用限制性内切酶识别特异序列,对其进行切割,形成一定大小的DNA片段,通过设计对应的引物进行PCR扩增,扩增产物在电泳、变性、杂交等过程后进行分析结果。PCR-RFLP是SMA的常用诊断试验,根据SMN1和SMN2基因第7、8外显子之间碱基差异所形成的限制性内切酶位点不同检测出SMN1是否存在缺失。在1995年van der Steege等[9]首次提出用限制性内切酶切割PCR产物,并得到其凝胶图谱,分析SMN1外显子7的缺失,创建了一种简单、快速的方法。之后McAndrew等[10]通过引入内标序列,可以准确的测出SMN1和SMN2的拷贝数,但由于无法检出SMN1基因的杂合缺失,因而不能应用于人群中进行SMA致病基因携带者的筛查[11]。许多学者不断的对PCR-RFLP进行改进,近年来,Niba等[12]建立了一种新系统,利用实时改良的竞争性寡核苷酸引物-PCR(modified competitive oligonucleotide priming-PCR,mCOP-PCR)和PCR-RFLP的结合来筛查SMN1缺失,该方法用PCR-RFLP的引物进行预扩增,实时mCOP-PCR快速准确地证明SMN1和SMN2是否缺失,结果通过第2次PCR-RFLP进行验证,这一新系统用于SMA的筛查很有潜力。
3.2变性高效液相色谱(denaturing high performance liquid chromatography,DHPLC) DHPLC技术是一种快速方便、灵敏度好、特异度高的基因检测技术。其原理是在部分变性的温度条件下,根据不同样品的核苷酸长度和碱基序列不同,样品在色谱柱中停留的时间不同而达到分离的目的。其本质是离子对反相高效液相色谱法(ion-pair reversed phase high performance liquid chromatography,IP-RP-HPLC)进行DNA的分离和分析,由于纯合双链和杂合双链在同一温度下解链程度的不同,导致其在色谱柱中滞留的时间不同,在最适部分变性和洗脱温度下,会呈现出异源和同源双链混合物的峰型,根据DHPLC形成的洗脱峰型,可以判断是否有变异的存在。但在实践应用中DHPLC存在稳定性欠佳等问题[13],通常需要与其他方法联合诊断。肖雪[14]等用DHPLC技术联合双重PCR技术对临床明确诊断的15例SMA及其双亲进行SMN1拷贝数检测以及分析,结果与临床诊断相比,DHPLC技术诊断SMA的敏感性为93.3%,特异性为100%。2011年,台湾地区采用DHPLC联合MLPA的方法,对该地区10 7611名孕妇进行了SMA筛查,共确认了2 262名SMA携带者,DHPLC联合MLPA的阴性预测值为99.87%[15],此外对于SMA高风险患儿,DHPLC与MLPA的联合可以有效地用于产前诊断[16]。上海[17]、广西[18]及陕西[19]等地采用PCR联合DHPLC技术对其地区的孕妇进行SMA筛查与诊断,并分析SMNl和SMN2拷贝数,检测出SMA人群携带率分别为1∶52、1∶81及1∶54。综上,用DHPLC与其他方法的联合诊断SMA患者,特异性、敏感性高,可用于携带者筛查。
3.3多重连接依赖性探针扩增(multiplex ligation-dependent probe amplification,MLPA) MLPA技术是一种高效、特异的基因检测技术,不仅可对基因的缺失定性检测,还具有对待测靶点拷贝数进行半定量分析的能力。其基本原理是DNA变性,特异性探针与DNA靶序列杂交、连接,PCR扩增连接后产物进行毛细管电泳分离,最后通过软件分析得出结论。MLPA的每一个探针都包含2个寡核苷酸片段,分别为一段引物序列和一段特异性序列,这2个寡核苷酸片段与DNA靶序列杂交,通过软件分析扩增峰的降低、升高来判断靶序列的拷贝数缺失和重复。自2002年荷兰学者[20]首次报道该技术后,MLPA技术已被广泛应用于检测染色体数目异常、基因缺失与重复以及基因甲基化等方面。目前针对SMA致病基因的拷贝数检测,MLPA已有商品化试剂盒,是当前临床较常用的SMN基因缺失分析方法。Huang等[21]用MLPA方法对SMN1和SMN2拷贝数进行检测,共测出不同拷贝数组合的21种基因型,其中第1组310名无肌萎缩史的研究对象中测得16种基因型,第2组18名SMA患者和45名SMA携带者检出有5种基因型。此方法在一次反应中检测到SMN1和SMN2各自外显子7和8的独特序列,以及SMN1和SMN2的共同的外显子1、4、6和8的序列,从而利用共同外显子加以验证,由此可以准确的确定SMN1和SMN2拷贝数。陈红苓等[22]对30例临床疑似SMA患者分别采用MLPA和PCR-RFLP方法进行对比检测,结果显示MLPA检测出25例SMA患者、2例SMA携带者及3例SMA“2+0”型携带者,比PCR-RFLP更加准确、高效。因此MLPA不仅能检出SMA患者,还可以用于携带者的筛查,现已成为SMA诊断的主流技术。国内大样本量筛查中,云南地区就采用MLPA法对3 049名育龄人群进行SMA携带者筛查,携带率为1∶49[23]。在MLPA技术中,包含SMN区域和其他染色体上的许多对照探针,可以用于SMN基因的总拷贝数参考或系统质量控制,因此用MLPA分析SMN基因拷贝数比其他方法更准确、更有效[21],虽然该技术具有敏感性高、自动化程度高和高通量等特点,非常适合大样本的筛查,但MLPA因试剂非国产化,其耗材贵、操作步骤较复杂和检测时间长,且对于人群中少见的“2+0”型携带者及点突变患者无法检出等缺点限制其在大规模携带者筛查中的应用。近年,厂商推出包含g.27134T>G和g.27706-27707delAT多态位点的试剂盒,利用这2个多态位点构成的单倍型仅存在于携带SMN1重复等位基因的个体(即SMN1拷贝数大于等于3)的原理,期望能提高人群中少见的“2+0”型携带者的检出率,但研究表明这2个多态位点在犹太人群、非洲人群中的比例远高于东亚人群,目前该方法还不适于中国人群的样本检测,鉴于我国为多民族国家,需要寻找适合中国人群的特异性的多态位点[24]。
3.4实时荧光定量PCR(quantitative real-time PCR,qPCR) qPCR技术现已成为分子诊断领域的重要技术,其操作简单、快速经济、灵敏度高、高通量等优势,在SMN基因拷贝数检测中愈加受到重视[25]。实时荧光定量PCR根据采用不同的荧光技术分为两类:TaqMan系统和SYBR Green系统。
3.4.1TaqMan系统 除普通PCR加入的一对普通引物外,还加入一条荧光标记的特异性探针,探针的5′端为荧光报告基团,3′端为淬灭基团,当探针保持完整时,淬灭基团抑制报告基团,检测不到荧光信号;在PCR反应中,Taq耐热DNA聚合酶的外切酶活性将探针切断,淬灭基团不能发挥抑制作用,报告基团的荧光信号随着PCR的扩增而积累,根据荧光信号的强度与标准曲线对比进行定量分析,从而算出产物的量。在纽约州采用多重TaqMan实时定量聚合酶链式反应(TaqMan real-time PCR)的方法对3 826名新生儿进行SMA筛查,结果为SMN1外显子7缺失携带者的频率约为1/65(1.5%),qPCR没有发现任何技术问题,用于检测SMN1的拷贝数结果准确可靠[26]。
3.4.2SYBR Green系统 在PCR反应中加入足量的SYBR Green Ⅰ核酸凝胶染液,其是一种DNA双链亲和性荧光素,能够特异地与DNA双链的小沟结合,发出荧光信号,根据荧光信号的量与标准曲线对比可进行定量分析。在2010年Weaver等[27]以拷贝数变异(CNV)为范式,评估qPCR的定量分辨率,建立了实时qPCR数据的误差模型。此模型是利用qPCR高通量的优势以实现更高的定量分辨率,随着重复次数的不同,qPCR可以区分1.25倍甚至1.1倍(11个拷贝中区分出10个拷贝)的基因表达差异,所以此模型同样适用于基因表达的研究。此外,Soloviov等[28]采用2-△△Ct数据处理模式,参照引入的内参基因ALB,计算SMN1的拷贝数。2-△△Ct数据处理模式可以将基因拷贝数仅为1倍的SMN1缺失标本与未缺失标本灵敏的检测出。邓坤仪等[29]以人血清蛋白12号外显子作为参比基因,定量检测SMN1基因的拷贝数,荧光定量PCR结果与MLPA结果完全一致。研究表明,采用以RPP40为内参基因的实时荧光定量PCR技术对孕中期羊水细胞进行SMN1基因缺失检测,具有所需SMA羊水量少、快速且准确性高的优点[30]。2021年江苏地区采用以RPP40为内参基因的qPCR技术进行了大样本量筛查,确定本地的SMA携带率为1∶58[31]。因此实时定量PCR技术可满足SMA产前诊断以及携带者大规模筛查的要求,但因设备型号差异而无统一的操作技术标准,所以荧光定量PCR在临床应用的稳定性还有待提高。
3.5数字PCR 数字PCR(digital polymerase chain reaction,dPCR)技术是qPCR技术的延伸,是终点qPCR。此前有研究对dPCR建立了一个误差模型,此模型是建立在dPCR高通量的基础上,把拷贝数变异测定的精度与反应室的数量联系起来,对各个反应室内DNA样品的全有或全无计数,此模型通过量化测定的精度来实现更高的定量分辨率。dPCR获得的测定结果不需要校准样品,分析数据简单易行,减少了很多引入误差的机会,因此大大提高了获得准确结果的可能性[27]。dPCR的基本反应原理是在不同的微反应区中扩增单个目标DNA。目标DNA稀释后散布在微反应区中,每个微反应区中包含一个或零个目标DNA分子,PCR扩增结果可以记录为阳性或阴性,因为dPCR是基于分子数量的绝对测量,所以不需要将获得的结果使用参照样本或内部控制来校准,根据泊松统计分布原理,PCR阳性反应的数量等于原始DNA模板分子的数量,则可以推算出目标基因的浓度。近年来,多重滴状dPCR(DdPCR)方法发展迅速,以测定特定的基因位点,有研究运用DdPCR检测了12例SMA阳性患者,其特异性和灵敏性可达100%,非常适用于SMA携带者的筛查[32]。此外,用来分析dPCR结果的系统也在不断的更新发展,其中Absolute Q(Absolute Q digital PCR系统)具有工作流程步骤少,分析SMA基因拷贝数耗时少的优点而被广泛应用。第一个同时检测SMN1和SMN2拷贝数的“高阶”多重dPCR方法[33],正是使用了Absolute Q系统,其测得的SMN1和SMN2拷贝数结果与Coriell细胞资料库提供的一致。由此看来数字PCR准确性高,操作简单,新型高阶多重dPCR方法的建立为今后SMA大规模的筛查提供了条件。
3.6二代测序技术 二代测序技术(next-generation sequencing,NGS),相对于一代测序技术,有着更高数量级的测序通量,所以也称之为高通量测序。其中包括:焦磷酸测序、连接法测序、合成法测序和离子半导体测序。目前主要是Illumina测序平台和Ion Torrent测序平台,其中又以Illumina测序平台为主流,其基本原理采用的都是边合成边测序的方法,它的测序过程主要分为4步:文库制备、簇生成、测序、数据分析。文库构建的目的是在目的DNA片段两端都连接上Y型接头,然后将文库DNA在flow cell芯片的表面上进行桥式PCR,从而生成由数千条相同模板的单分子片段构成的Cluster,之后加入荧光基团标记的、3′端羟基被封闭的dNTP与目的基因互补配对,通过可逆性终止的边合成边测序(SBS)技术对待测的模板DNA进行测序。NGS作为大规模平行测序可同时对数百万个DNA片段进行测序,现已成为单基因遗传病基因诊断的首选技术。临床上NGS可用于拷贝数变异(CNV)的检测和筛查基因的微小变异,因SMN1和SMN2高度同源且两者还会发生基因转换,所以短读NGS分析SMA的CNV时不容易被定位到其基因组,临床上一般可以利用SMN1和SMN2存在的碱基差异位点来推测SMN1基因是否存在缺失,但无法确定SMN1基因缺失长度和SMN2基因拷贝数。2017年Feng等[34]发展了一种新的基于短读NGS数据的SMA携带者检测方法(PGCNARS),采用该方法检测了6 738个临床样本,通过PCR和MLPA方法进行验证,该方法检测SMA携带者的敏感性为100%,特异性为99.6%,其检测结果表明NGS可同时检测SMN1基因拷贝数和筛查SMN基因微小变异,但检测的微小变异定位不明确。2019年Chen等[35]用短读NGS数据独立解析SMN1和SMN2的拷贝数变异的方法,检测了12 747个样本中的SMN1和SMN2,经过MLPA的验证,结果显示SMN1和SMN2的符合率分别为99.8%和99.7%,此方法相对于Feng等[34]的方法更全面地分析了靶向区域,以及更准确地检测微小变异检测,包括与SMA的“2+0”携带者相关的g.27134T>G单核苷酸多态性(SNP)。由此可见NGS在检测SMN拷贝数的技术将逐渐成熟和准确。2020年Zhao等[36]开展了基于NGS的方法对中国10 585对夫妇进行SMA携带者筛查的泛种族研究,该方法与qPCR检测SMA携带者和患者的符合率达100%,该方法分析了不同民族间携带者频率的差异,还揭示了SMN1:SMN2基因型的分布。以上研究结果表明NGS方法是一种很有前景的SMA携带者筛查方法,可为今后的临床应用提供数据支持和参考。
3.7其他方法 除以上介绍的5种SMA携带者筛查技术外,还有一些其他方法,如单链构象多态性(SSCP)[37]、等位基因特异性PCR[38]、高分辨率熔融分析(HRMA)[39]、液体微珠阵列[40]等方法。这些方法各有优缺点,其中SSCP是一个非常耗时的过程;等位基因特异性PCR需要在凝胶或其他基质上分离PCR产物,增加了污染的风险;HRMA发展迅速,已经做到了对9种SMN拷贝数组合的区分,但需进一步研究以准确区分更多的拷贝数组合;虽然液体微珠阵列有灵敏、高通量等优点,但其成本可能会阻碍其在许多实验室的应用。
4 总结
SMA是一种常见的儿童致死性神经系统疾病,具有临床症状严重,致死率高,人群中携带率高的特点。现有的实验技术可以筛查出SMA携带者,对于夫妻双方均为携带者的高危夫妇建议行遗传咨询和产前诊断,而高风险胎儿应进行SMN1基因检测,评估后代患病风险,避免SMA患儿的出生,降低SMA的发病率。目前存在多种SMA筛查技术,不同方法的可靠性、检出率以及经济性等不尽相同。目前临床上常用的技术是MLPA和荧光定量PCR,但因他们各自的缺点限制了其在大规模筛查的应用。已有大量的研究数据表明NGS可以直接计算SMN1拷贝数,但筛查或诊断SMN1微小变异仍存在很大困难,目前在我国,NGS尚未成为SMA的常规检测方法。数字PCR法、高分辨率熔融分析法等新兴技术方法在临床SMA携带者筛查中具有巨大的潜力。但由于dPCR方法不能检测出SMN1基因内点突变以及沉默的SMA携带者(2+0),未来需要研究开发可以检测单核苷酸变化的dPCR技术,以适用于大规模的筛查。随着国内逐渐完善标准化的SMA筛查流程,以及发展改进新型的筛查技术,中国人群的SMA发病率将会有效降低,从而有助于减轻家庭和社会的负担,提高我国人口素质。
