miR-188对小鼠乳腺癌细胞增殖、迁移及凋亡的影响
2022-03-17朱新颖战晓燕钟登科郑江平滑志民李天顺
朱新颖,郭 帅,战晓燕,钟登科,郑江平,滑志民,李天顺
(1.上海农林职业技术学院,上海 201699;2.华中农业大学,武汉 430070)
乳腺肿瘤在母犬中高发,且约50%的乳腺肿瘤为恶性肿瘤,犬乳腺癌的发生、发展是一个复杂的演变过程,与周围环境中的种种致癌因素或机体内部抗肿瘤能力降低等有关,其中促癌基因的激活、抑癌基因的失活及细胞凋亡的抑制在该过程中均发挥重要的作用[1-2]。尽管乳腺癌复杂分子机制的研究正在广泛进行中,但新疗法的开发和精准诊断及预后仍然是一个挑战[3]。犬乳腺癌是一种高度异质性的疾病,目前对其的治疗策略尚存在较大局限,且随着养犬数量的不断提高,开发安全、高效的治疗方法已成为兽医临床亟需解决的难题。分子治疗药物在宠物临床中使用还相对较少,通过发现新的调控分子来抑制癌细胞和诱导细胞凋亡,可能为犬乳腺癌的治疗提供潜在的治疗策略,进而推进开发新的、有效的犬乳腺癌治疗药物[4]。
微小RNA(miRNA)是内源性非编码RNA(ncRNA),长度约为22 nt,可作为转录后调节剂,并可以调节约30%的蛋白质编码基因[5]。miRNA在多种体液中的表达量相对稳定,是目前研究恶性肿瘤生物标记物的热点,miRNA与多种肿瘤的发生发展存在着密切关系,既可下调原癌基因的表达,又可上调抑癌基因的表达[6-7]。研究表明,miRNA通过与特异性靶基因的结合参与调控多种恶性肿瘤细胞的增殖、侵袭、凋亡、转移等生物过程[8]。细胞外基质(ECM)是恶性肿瘤侵袭的重要指标,晚期乳腺癌细胞的侵袭主要是因为基质金属蛋白酶家族(MMPs)活性升高或者表达量的升高,其中MMP-9可以破坏细胞外基质,从而增强乳腺癌细胞的侵袭能力,因此MMP-9也被认为是评判癌细胞侵袭能力的标志之一[9-10]。microRNA-188-5p(miR-188)的过表达与肝细胞癌、胃癌和前列腺癌的发生发展有关[11-12]。miRNA作为促癌因子或肿瘤抑制因子取决于它所靶向的mRNA的功能。林建姣等[13]研究表明,miR-188通过靶向作用于锌指蛋白91(ZFP91)可治疗胃癌。本研究前期在BALB/c小鼠移植瘤模型中进行了大量的预试验,发现miR-188在小鼠乳腺癌移植瘤模型中表达量显著下降,在此基础上,本试验拟研究miR-188在小鼠乳腺癌细胞(4T1)增殖、迁移和凋亡过程中的调控作用,揭示miR-188对乳腺癌的生物学行为功能的影响,旨在为乳腺癌的靶向治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 4T1细胞购自中国科学院苏州生命科学研究院。
1.1.2 动物 SPF级6~8周龄BALB/c小鼠购自湖北省华中农业大学实验动物中心,平均体重为18~25 g。小鼠均饲养在华中农业大学实验动物中心,光照条件为:12 h黑暗,12 h光照,相对恒定湿度为40%~60%,恒定温度为26~28 ℃,自由饮食。所用实验动物处理方案经华中农业大学动物福利和使用机构伦理委员会批准,符合美国国立卫生研究院公布的实验动物福利和使用指南。
1.1.3 主要试剂及仪器 RPMI 1640细胞培养基、胎牛血清(FBS)均购自HyClone公司;SDS-PAGE试剂盒购自武汉博士德生物工程有限公司;TRIzol®试剂购自北京优尼康生物科技有限公司;LipofectamineTM2000购自北京索莱宝科技有限公司;实时荧光定量PCR试剂盒购自苏州吉玛基因股份有限公司;试验中所用抗体均购自CST公司。荧光定量PCR仪(FDQ48A)购自Applied Biosystems公司;冷冻离心机(MX-160)购自TOMY公司;普通台式离心机(HC-3018)购自安徽中科中佳科学仪器有限公司;倒置荧光显微镜(CKX41)购自Olympus公司;电子天平(AUY120)购自SHIMADZU公司;细胞培养箱(HERA CELL 150i)购自Thermo公司;凝胶成像系统(Universal Hood Ⅱ)购自Bio-Rad公司;流式细胞仪(CytoFLEX)购自Beckman Coulter公司。
1.2 方法
1.2.1 细胞培养 将4T1细胞解冻复苏后,用含10% FBS和1%青-链霉素的RPMI 1640细胞培养基在37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。
1.2.2 肿瘤模型构建及样品采集 用生理盐水将4T1细胞调至2×107/mL,分散接种至12只雌性BALB/c小鼠第4乳腺区皮下脂肪垫,1只小鼠的1个乳腺区接种100 μL,5~7 d乳腺部位长出肉眼可见的肿瘤。每日观察小鼠精神状态、饮食、排泄、毛色及活动状态,每周测量2次肿瘤大小及小鼠体重。当肿瘤直径超过20 mm,体重减轻超过10%或者小鼠处于严重恶病质状态时,对小鼠进行安乐死,并分离肿瘤组织及瘤旁组织,-80 ℃保存备用。
1.2.3 引物设计及合成 根据GenBank中miR-188的序列(序列号:387183),用Primer Premier 6软件设计miR-188、miR-188模拟物(miR-188 mimics)、模拟物对照(mimics-NC)、miR-188抑制物(miR-188 inhibitor)和抑制物对照(inhibitor-NC)等的引物,具体信息见表1。引物均由苏州吉玛基因股份有限公司合成。

表1 引物信息
1.2.4 细胞转染 以2×105/孔将4T1细胞接种于6孔板,当细胞汇合度达60%时按照LipofectamineTM2000说明书混合miR-188 mimics、mimics-NC、inhibitor-NC、miR-188 inhibitor共4组转染液,分别吸取100 μL混合液加入已准备好的细胞中,轻轻晃动细胞培养板使其混合均匀,转染后4~6 h更换含10% FBS和1%青-链霉素的RPMI 1640细胞培养基。以未转染细胞作为空白对照。37 ℃、5% CO2培养箱中培养6 h,更换培养液后继续培养20 h。
1.2.5 实时荧光定量PCR 用TRIzol®试剂从肿瘤和瘤旁组织及转染miR-188 mimics、mimics-NC、miR-188 inhibitor、inhibitor-NC和对照组的细胞中提取总RNA,并反转录成cDNA。以cDNA为模板,miR-188表达水平的检测按照实时荧光定量PCR试剂盒说明书进行,以U6为内参。通过2-ΔΔCt分析,比较各组miR-188的表达情况。各组均设置3次重复。
1.2.6 miR-188对细胞增殖的影响 以5×103/孔将4T1细胞接种在96孔板中,每组设5个复孔,培养24 h后按照1.2.4方法进行mimics-NC、miR-188 mimics、inhibitor-NC、miR-188 inhibitor转染。分别于转染24、48、72 h弃去培养液,每孔加入含有10% CCK-8试剂的培养基,继续孵育2 h后,用酶标仪检测D450 nm值。以D450 nm值为纵坐标、时间为横坐标绘制细胞生长曲线。
1.2.7 miR-188对细胞迁移的影响 以2×105/孔将4T1细胞接种在6孔板中,培养24 h后按照1.2.4方法进行mimics-NC、miR-188 mimics、inhibitor-NC、miR-188 inhibitor转染。使用记号笔进行标记,用尺子每隔0.5 cm均匀划出一条水平线,穿过孔,每孔至少过3条线。当细胞汇合度达到95%时,用200 μL的灭菌枪垂直划线,PBS洗3次,无血清培养基培养。于划线后0和24 h分别拍照,用Image J v1.8.0软件计算各组划痕面积,并检测MMP-9蛋白的相对表达量。
1.2.8 miR-188对细胞凋亡的影响 将2×105/孔将4T1细胞接种于6孔板中,待细胞汇合度达到70%时按1.2.4方法进行细胞转染,6 h后更换培养基,继续培养20 h。用不含EDTA的0.25%胰酶消化,4 ℃、3 000×g离心5 min收集细胞,用预冷的PBS洗涤2次。按照细胞凋亡检测试剂盒说明书进行细胞凋亡检测处理,处理结束的样品在1 h内用流式细胞仪检测,使用Flowjo软件对流式结果进行分析。
1.2.9 Western blotting检测相关蛋白的表达 以2×105个/孔将4T1细胞接种于6孔板中,待细胞汇合度达到70%时按1.2.4方法进行细胞转染,6 h后更换新鲜培养基,继续培养20 h。弃去培养液,PBS清洗3次,每孔加入300 μL RIPA裂解液(含PMSF),收集细胞于离心管中,冰上裂解30 min,4 ℃离心收集细胞上清。通过BCA检测试剂盒测定MMP-9、聚二磷酸腺苷核糖聚合酶(PARP1)、半胱氨酸蛋白酶-3(Caspase-3)和Bcl-2-Associated X蛋白(Bax)的浓度。配制SDS-PAGE凝胶,每孔上样等量的变性蛋白,电泳分离蛋白条带,将蛋白条带转移至PVDF膜上,低温转膜1.5~2 h。将膜置于5%脱脂牛奶中, 室温孵育2 h, 用0.1% TBST溶液漂洗3次,每次5~10 min,加一抗MMP-9(1∶1 000)、PARP1(1∶2 000)、Caspase-3(1∶2 000)、Bax(1∶2 000)、Bcl-2(1∶2 000) 4 ℃孵育过夜。用0.1% TBST溶液漂洗3次,每次5~10 min。二抗(1∶2 000)室温孵育1 h,0.1% TBST漂洗3次,每次10 min,用ECL试剂进行显色,使用Image J v1.8.0软件分析蛋白灰度值。
1.3 统计分析
用SPSS 17.0统计软件进行t检验差异分析,结果用平均值±标准误表示,P<0.05表示差异显著。
2 结 果
2.1 miR-188在小鼠乳腺癌移植瘤模型中的表达水平
在4T1小鼠移植瘤模型中分离出肿瘤和瘤旁组织,实时荧光定量PCR检测miR-188的表达水平,结果显示,相对于瘤旁组织,miR-188在肿瘤组织中表达量显著降低(P<0.05,图1)。
2.2 miR-188转染对乳腺癌细胞增殖的影响
实时荧光定量PCR结果显示,与空白对照相比,mimics-NC与inhibitor-NC组均无显著差异(P>0.05),说明mimics-NC与inhibitor-NC对miR-188的表达无影响,可作为对照进行后续试验的分析。与mimics-NC组相比,miR-188 mimics组miR-188的相对表达量显著上调(P<0.05);与inhibitor-NC组相比,miR-188 inhibitor组miR-188的相对表达量显著下调(图2A)(P<0.05)。细胞增殖试验表明,与mimics-NC组相比,miR-188 mimics组4T1细胞的增殖速率显著降低;与inhibitor-NC组相比,miR-188 inhibitor组4T1细胞的增殖速率显著增加(P<0.05,图2B)。
2.3 miR-188对乳腺癌细胞迁移的影响
由图3可知,与mimics-NC组相比,miR-188 mimics组4T1细胞的迁移速率显著降低(P<0.05);与inhibitor-NC组相比,miR-188 inhibitor组 4T1细胞的迁移速率显著提高(P<0.05);Western blotting结果显示,与mimics-NC组相比,miR-188 mimics组MMP-9蛋白的表达量显著降低(P<0.05),进一步表明miR-188具有抑制4T1细胞迁移的能力。
2.4 miR-188对乳腺癌细胞凋亡的影响
由图4可知,与mimics-NC组相比,miR-188 mimics组4T1细胞的凋亡率显著降低(P<0.05);与inhibitor-NC组相比,miR-188 inhibitor组4T1细胞凋亡率显著增加(P<0.05)。
2.5 miR-188对乳腺癌细胞凋亡相关蛋白的影响
由图5可知,与mimics-NC组相比,miR-188 mimics组4T1细胞PARP1、Caspase-3和Bax促凋亡蛋白的表达水平显著增加(P<0.05), 抑凋亡蛋白Bcl-2的表达水平显著降低(P<0.05);与inhibitor-NC组相比,miR-188 inhibitor组Caspase-3和Bax促凋亡蛋白的表达水平显著降低(P<0.05)。
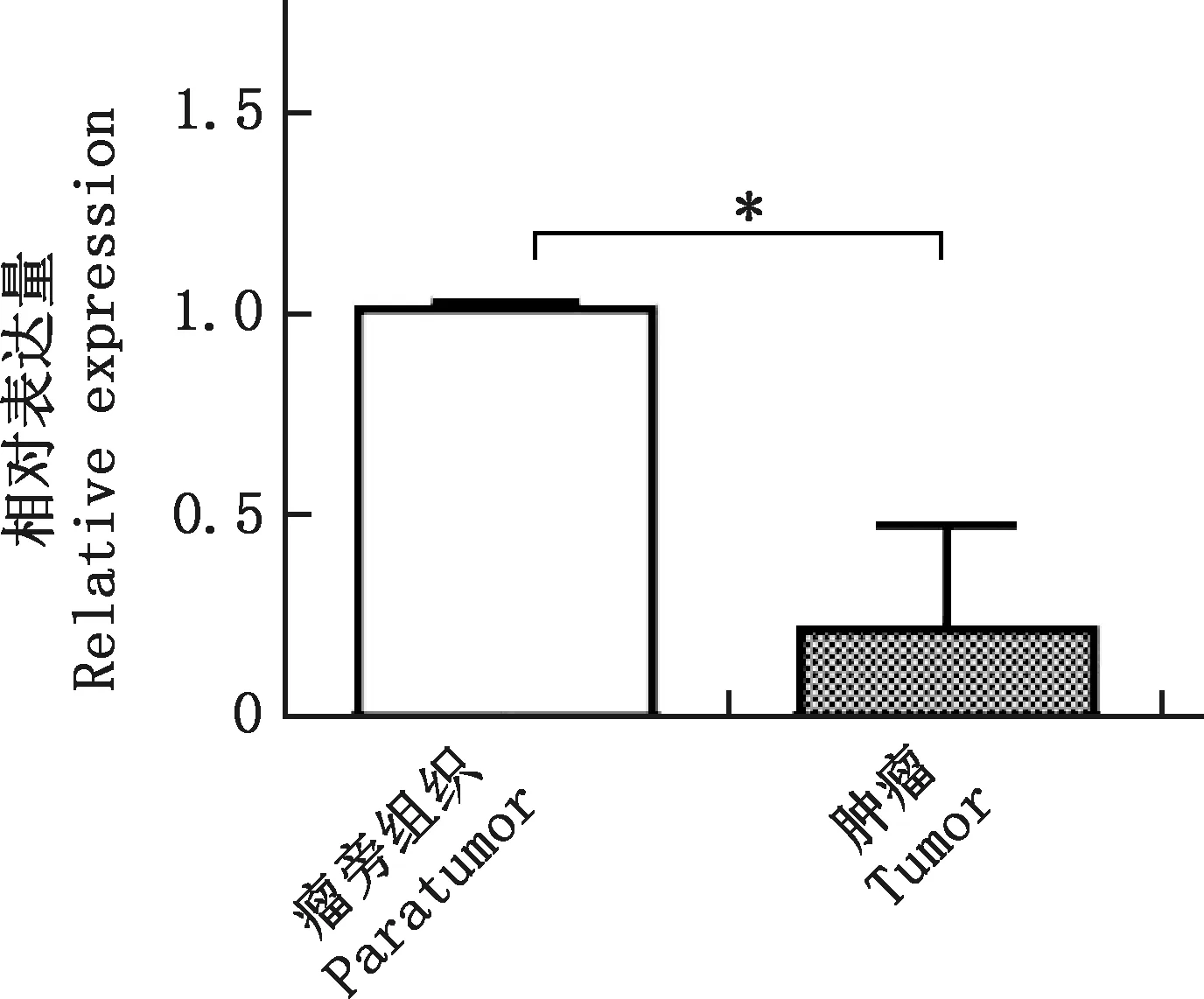
*,差异显著(P<0.05);无标记,差异不显著(P>0.05)。下同*,Significant difference (P <0.05);No marker,No significant difference (P>0.05).The same as below图1 miR-188在乳腺癌组织中的表达情况Fig.1 The expression of miR-188 in breast cancer tissues
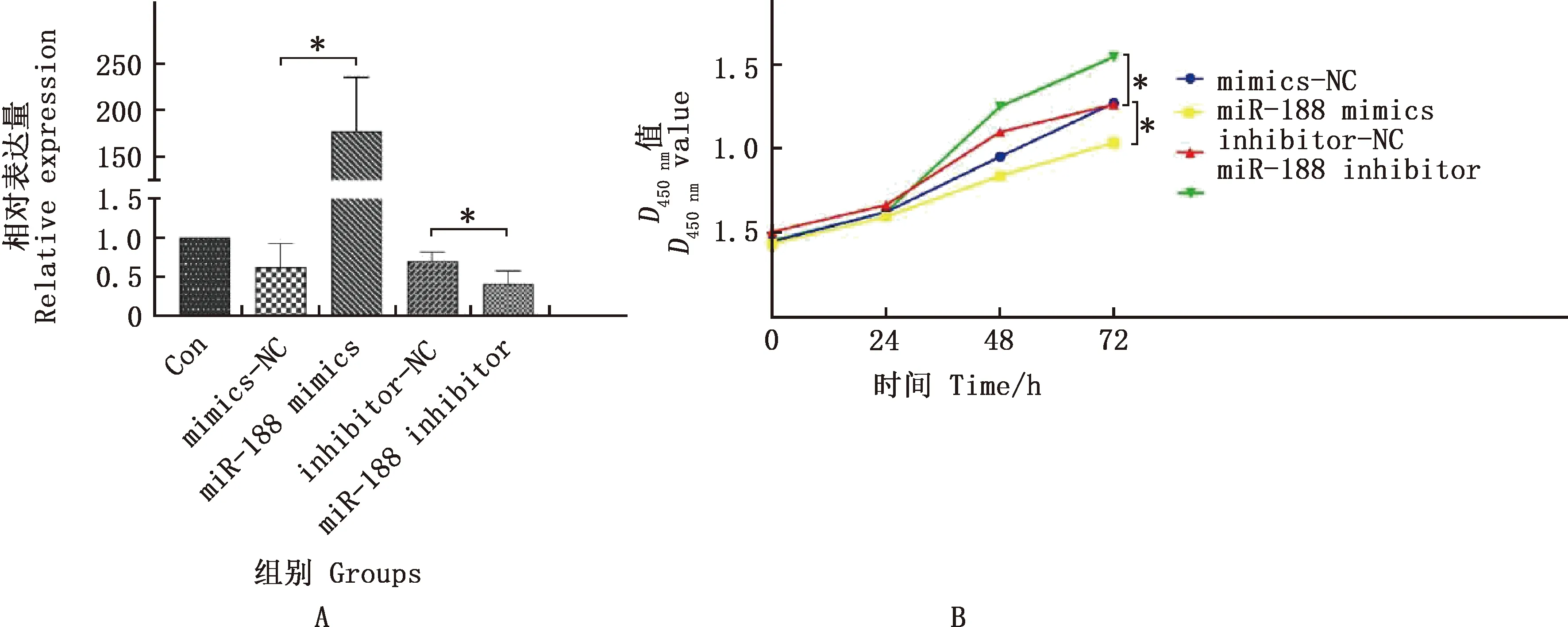
图2 各组4T1细胞miR-188的相对表达水平(A)及增殖情况(B)Fig.2 The relative expression level of miR-188 (A) and proliferation (B) of 4T1 cells in each group
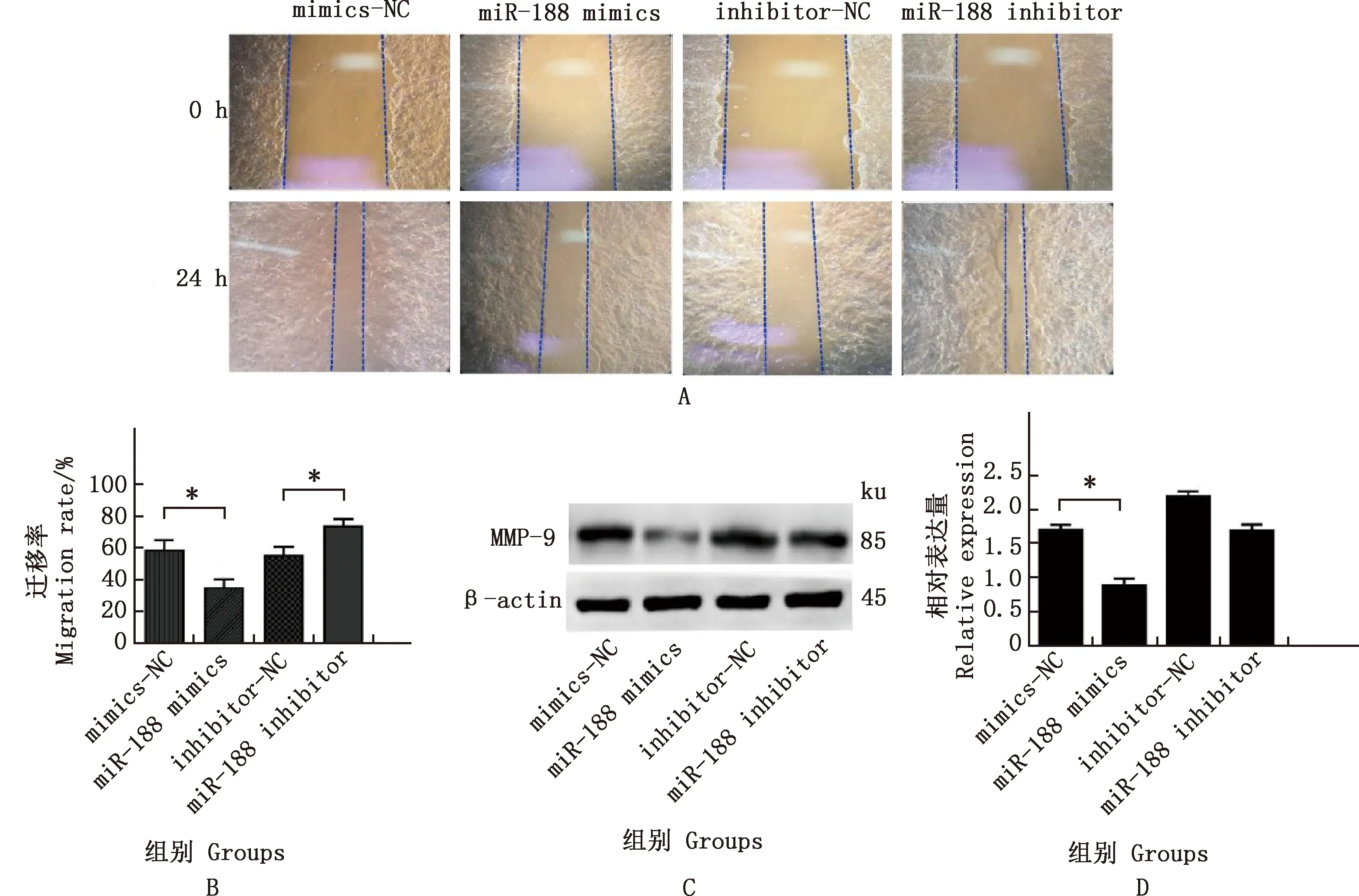
A、B,各组4T1细胞迁移情况及迁移率统计;C,Western blotting检测MMP-9蛋白表达;D,MMP-9蛋白相对表达量A and B,Cell migration and migration rate statistics of 4T1 cells in each group;C,Western blotting was used to detect the expression of MMP-9 protein;D,The relative expression of MMP-9 protein图3 各组4T1细胞迁移及迁移相关蛋白的表达Fig.3 Cell migration and expression of migration related proteins of 4T1 cells in each group
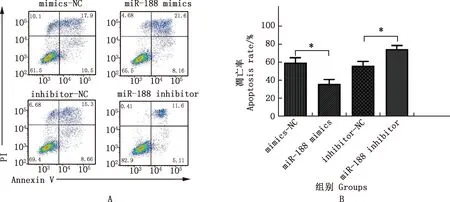
A,流式细胞术检测各组4T1细胞凋亡;B,凋亡率A,Flow cytometry was used to detect apoptosis of 4T1 cells in each group;B,Apoptosis rate图4 各组4T1细胞凋亡情况Fig.4 Apoptosis of 4T1 cells in each group
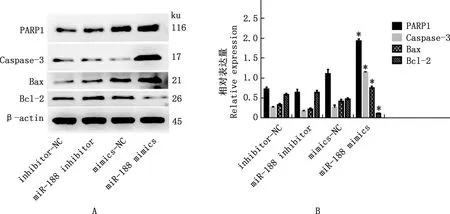
①A,Western blotting检测各组4T1细胞PARP1、Caspase-3、Bax和Bcl-2的表达水平;B,PARP1、Caspase-3、Bax和Bcl-2的相对表达量。②与对照组(inhibitor-NC/mimics-NC)相比,*,差异显著(P<0.05);无*,差异不显著(P>0.05)①A,Western blotting was used to analyze the expression levels of PARP1,Caspase-3,Bax and Bcl-2 of 4T1 cell in each group;B,The relative expression levels of PARP1,Caspase-3,Bax and Bcl-2.②Compared with control group (inhibitor-NC/mimics-NC),*,Significant difference (P<0.05);No *,No significant difference (P>0.05)图5 各组4T1细胞中凋亡相关蛋白的表达Fig.5 The expression of apoptosis related proteins of 4T1 cells in each group
3 讨 论
近年来,伴侣动物已成为人类家庭成员的重要一员,宠物犬的数量逐年增加,肿瘤性疾病暴露的风险也在加大。传统的治疗方案(如放化疗和手术摘除等)对患者本身伤害很大,且有一定的局限性[14],新型的分子治疗方法受到越来越多的青睐。相关研究证实,一半以上的miRNA基因的调控区域都与癌症相关,在多种类型肿瘤的发生和发展中起关键作用[15]。本试验结果显示,miR-188在犬乳腺肿瘤中的表达量显著降低,说明其可能与乳腺肿瘤的发生发展密切相关。研究表明,miR-188可抑制乳腺癌MCF-7细胞的增殖和迁移,在乳腺肿瘤的治疗中,miR-188可通过靶向白介素6信号转导物(IL6ST)发挥其抗乳腺肿瘤作用[16],也可通过PI3K/Akt/MMP-2/9信号通路抑制瘢痕瘤的增殖和侵袭[17]。此外,Zhao等[18]研究报道,miR-188在抑制肺癌的侵袭和转移中起重要作用,且miR-188可以通过靶向锌指蛋白91(ZFP91)抑制胃癌细胞的增殖和侵袭[13]。miR-188过表达或抑制与乳腺癌的治疗密切相关,本研究与Wang等[19]研究结果相似,miR-188可显著抑制乳腺肿瘤细胞的迁移和侵袭。
凋亡是细胞为了适应外界刺激发生的程序性的死亡,当基因受到不同因素的影响而异常表达时,会引起细胞生长失控而引发肿瘤。许多原癌基因和抑癌基因都是通过控制细胞凋亡而诱导或抑制肿瘤的发生。这些基因调控的紊乱造成细胞生长的失控,正常凋亡程序受阻而形成细胞的恶变和无限增殖。因此,有效促进肿瘤细胞的凋亡对肿瘤的治疗有重要意义。在乳腺肿瘤方面,miRNA对犬肿瘤细胞凋亡具有一定的调节作用。研究发现,miR-27a调节可能有助于与肥大细胞肿瘤细胞系共培养的犬成纤维细胞的激活,通过促进犬肥大细胞瘤细胞的凋亡而促进犬成纤维细胞的增殖[20]。此外,众多miRNA在犬乳腺肿瘤中发挥重要的作用。如miR-15a、miR-16在犬管状乳头状癌中表达显著下调,而miR-181b、miR-21、miR-29b、let-7f在犬管状乳头状癌中表达显著上调,其通过促进或抑制犬乳腺肿瘤细胞凋亡而调节乳腺肿瘤的发生发展[21]。目前,miR-188在犬乳腺肿瘤中的调节机制尚不明确。研究表明,miR-188可通过抑制人10号染色体缺失的磷酸酶(PTEN)的表达促进慢性粒细胞白血病细胞的凋亡,进而缓解慢性髓细胞白血病的发病进程[22]。本研究结果发现,miR-188的过表达显著提高了PARP1、Caspase-3和Bax促凋亡蛋白的表达,抑制抑凋亡蛋白Bcl-2的表达,说明miR-188可显著促进乳腺癌细胞的凋亡。
miRNA具有多种生物学活性,并且参与生命机体多种功能的调节过程,其主要通过靶向mRNA发挥其生物学活性,可作为下一步重点探究的内容,且miR-188还有众多已知预测靶点,在犬乳腺癌的治疗中还需进一步探讨。
4 结 论
miR-188可显著抑制4T1细胞增殖、侵袭和迁移,促进PARP1、Caspase-3和Bax促凋亡蛋白的表达,抑制抑凋亡蛋白Bcl-2的表达,从而抑制乳腺癌的发展进程,可为未来乳腺癌相关治疗药物的研发提供理论依据。
