miR-145a-3p通过靶向ATG14调控布鲁氏菌诱导的RAW264.7自噬
2022-03-17王月丽邵志然易继海陈创夫
王月丽,邵志然,易继海,王 勇,王 震,陈创夫
(1.石河子大学动物科技学院,石河子 832000;2.人兽共患传染性疾病防治协同创新中心,石河子 832000;3.新疆职业大学,乌鲁木齐 830013)
布鲁氏菌病是一种由布鲁氏菌(Brucella)引起的以流产和发热为特征的人兽共患病,对人类健康和养殖业造成极大的威胁[1]。细胞自噬是细胞的一种程序性死亡,以维持自身环境的稳定及细胞器的更新,主要是胞内自噬相关蛋白通过参与自噬调节通路发挥作用。自噬可以自发的清除感染细胞的病原体,如结核分枝杆菌,其在感染巨噬细胞后能寄居其中,可以通过阻止自身酸化进入休眠状态而躲避细胞的清除作用[2-3]。有研究证明,布鲁氏菌能够通过与早期内吞、晚期内吞及自噬溶酶的作用形成酸化的布鲁氏菌自噬小体,转移至内质网获得复制性,并在四型分泌系统(T4SS)分泌系统的作用下形成具有自噬样结构的自噬泡,具有溶酶体的功能,影响细菌传递和胞内感染周期[4]。有研究表明,布鲁氏菌能够引起细胞自噬,并影响布鲁氏菌的胞内寄生[5]。布鲁氏菌激活自噬后,T4SS可帮助布鲁氏菌逃避自噬溶酶体的降解,避免机体对其的清除从而促进胞内存活[4]。自噬相关蛋白14(ATG14)能够促进自噬泡的形成,还可以形成Beclin1-ATG14-PI3KⅢ螯合物诱导自噬的发生[6]。布鲁氏菌引起的自噬现象是否与自噬相关蛋白ATG14有关尚未见报道,需要进一步研究。
miRNA是一类具有调控功能的非编码RNA,可以与信使RNA(mRNA)的3′非翻译区(3′UTR)结合,具有调控细胞生长、发育、分化、增殖和死亡的功能[7]。在肿瘤中可以作为一个抑癌基因发挥作用[8]。miRNA对自噬的调控作用机制复杂,涉及多条信号转导通路[9]。miR-155可以靶向调节脑中丰富的ras同系物(Rheb)基因,miR-125a可以靶向紫外线抵抗相关基因(UVRAG)来调控结核分枝杆菌感染所诱导的细胞自噬影响其在胞内的存活时间[10]。miR-30b通过下调靶基因肌球蛋白样Bcl-2结合蛋白(BECN1)和ATG12抑制幽门螺杆菌诱导的细胞自噬,导致其在胞内的大量复制[11]。miR-29b在牛病毒性腹泻病毒(BVDV)中作用于ATG14抑制感染细胞的自噬,减少病毒在胞内的复制存活率。miR-375在肝癌细胞中通过靶向ATG7而抑制细胞自噬[12]。随着miRNA与自噬研究的深入,也使得miRNA成为自噬研究的新方向。Wang等[13]研究发现,miR155通过调节PI3K/Akt/mTOR信号通路,影响阿霉素诱导的骨肉瘤MG63细胞自噬。但miRNA在布鲁氏菌自噬通路中的作用报道较为鲜见,miR-145a-3p是否对ATG14具有调节作用目前还不清楚。因此,本试验通过研究miR-145a-3p对布鲁氏菌诱导的细胞自噬的调控作用以及对布鲁氏菌胞内生存的影响,从miRNA调控细胞自噬的角度分析布鲁氏菌的生存机制,以期为研究布鲁氏菌造成机体持续性感染的机制提供新思路。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞和质粒 羊种布鲁氏菌疫苗株M5、小鼠巨噬细胞(RAW264.7)、293T细胞、双荧光素酶报告质粒PmirGLO、自噬荧光小鼠巨噬细胞(GFP-RFP-RAW264.7)均由新疆建设兵团动物疫病防控重点实验室保存。
1.1.2 主要试剂 DMEM细胞培养液和胎牛血清(FBS)均购自Gibco公司;脂质体Lipofectamine 2000购自Invitrogen公司;SYBR Green Master Mix试剂盒购自Roche公司;PLB裂解液购自Promega公司;RNA提取试剂盒和cDNA反转录试剂盒均购自天根生化科技(北京)有限公司;RIPA裂解液购自北京索莱宝科技有限公司;兔抗ATG14一抗购自Proteintech公司;山羊抗兔IgG(H+L)二抗购自Bioworld公司;限制性内切酶SacⅠ和KpnⅠ均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 miR-145a-3p模拟物和抑制剂合成 参照miRBase数据库中miR-145a-3p序列(登录号:MIMAT0003828),由上海吉玛生物公司合成miR-145a-3p mimics、miR-145a-3p inhibitor和NC mimics。
1.2.2 miR-145a-3p转染对布鲁氏菌诱导的RAW264.7自噬的影响 将GFP-RFP-RAW264.7复苏并传代培养。待细胞长至60%~70%汇合时,加入2 mL不含FBS的DMEM培养液,继续培养2 h。 将miR-145a-3p mimics、miR-145a-3p inhibitor、NC mimics稀释至20 nmol/L后静置5 min,取2.5 μL加入到6 μL Lipofectamine 2000中吹打混匀,静置25 min;取50 μL混合物加至细胞中,摇晃混匀后,继续培养7 h。用感染复数为100∶1的布鲁氏菌侵染小鼠巨噬细胞RAW264.7 24 h后,PBS清洗2遍,取1 mL 4%多聚甲醛溶液固定细胞30 min,PBS清洗2遍后在激光共聚焦显微镜下观察各组细胞自噬情况。
1.2.3 自噬相关miR-145a-3p靶蛋白预测 利用miRBase((https:∥www.mirbase.org/)和 TargetScan(http:∥www.targetscan.org/ vert_71/)生物信息学预测软件对细胞自噬通路中miR-145a-3p进行靶蛋白预测。
1.2.4 PmirGLO-ATG14-3′UTR和PmirGLO-ATG14-3′UTR-mutation重组质粒构建 以RAW264.7的基因组为模板,扩增目的基因ATG14-3′UTR和ATG14-3′UTR-mutation。PCR反应体系25 μL:cDNA 2 μL,上、下游引物各0.4 μL,2×TaqMaster Mix 12.5 μL,ddH2O 9.7 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性40 s;56 ℃退火30 s;72 ℃延伸20 s;72 ℃延伸10 min,共40个循环。扩增结束后进行0.5%琼脂糖凝胶电泳,然后使用内切酶SacⅠ和KpnⅠ对回收产物及双荧光素酶报告质粒PmirGLO进行酶切,并回收酶切产物;将ATG14-3′UTR/3′UTR-mutation与PmirGLO在16 ℃水浴中连接,然后将10 μL连接产物转化100 μL大肠杆菌DH5α感受态细胞,加入1 mL LB培养液,37 ℃摇床180 r/min摇菌60 min。收集摇好的菌液,涂布于氨苄抗性的LB固体培养板上,倒置于37 ℃培养箱内过夜培养,挑单菌落进行菌液PCR鉴定。 提取鉴定成功的质粒,用限制性内切酶SacⅠ和KpnⅠ进行双酶切鉴定。
1.2.5 miR-145a-3p与ATG14的靶向关系验证 用双荧光素酶报告基因系统分析鉴定miR-145a-3p与ATG14的靶向调控关系。 将50 ng双荧光素酶报告基因质粒PmirGLO-ATG14-3′UTR与0.25 μL miR-145a-3p mimics、miR-145a-3p inhibitor和NC mimics分别混合后,转染293T细胞48 h,加20 μL的PLB裂解液,裂解细胞15 min,然后加入100 μL荧光素酶底物LARⅡ,使用Biotek酶标仪避光检测萤火虫荧光素酶活性;检测完毕后加入100 μL海肾荧光素酶Stop&GLO,检测海肾荧光素酶的活性,并按照公式计算相对荧光活性。
相对荧光活性=
1.2.6 实时荧光定量PCR检测ATG14的mRNA水平 培养RAW264.7至60%汇合时,分别将miR-145a-3p mimics、miR-145a-3p inhibitor和NC mimics与Lipofectamine 2000转染细胞,转染后7 h后添加布鲁氏菌侵染细胞,设置添加PBS作为对照组,24 h后收集细胞备用。加入1 mL Trizol裂解细胞5 min后,利用RNA提取试剂盒提取细胞总RNA并反转录合成cDNA。利用Primer Premier 5.0软件设计miR-145a-3p靶基因位点ATG14-3′UTR和突变体ATG14-3′UTR-mutation(GenBank登录号:NM_001192099)、ATG14(GenBank登录号:NC_000080.6)与GAPDH(GenBank登录号:NC_000072.6)的引物,具体信息见表1,引物均由生工生物工程(上海)股份有限公司合成。以GAPDH为内参基因进行实时荧光定量PCR。PCR反应体系10 μL:上、下游引物(0.2 μmol/L)各0.2 μL,SYBR Green Master Mix 5 μL,cDNA模板1 μL,Nuclease-free Water 3.6 μL。PCR反应条件:94 ℃预变性30 s;94 ℃变性5 s,退火(温度见表1) 30 s,共45个循环。

表1 引物信息
1.2.7 Western blotting检测ATG14的蛋白水平 细胞处理同1.2.6。加入RIPA非变形蛋白裂解液及0.1 mol/L PMSF蛋白酶抑制剂,冰上放置10 min;收集裂解的样品。4 ℃、12 000 r/min离心5 min,吸取上清,利用BCA蛋白浓度测定试剂盒测定蛋白的浓度;加入SDS-PAGE蛋白上样缓冲液,100 ℃煮样10 min;待样品冷却后加至15% SDS-PAGE凝胶孔中,100 V电泳4 h;电泳结束后切下胶条进行转膜,转膜完成后,将膜清洗干净加入5 mL脱脂奶粉封闭12 h,TBST缓冲液洗膜3 次。加兔抗ATG14(1∶2 000)、兔抗β-actin(1∶10 000),孵育2 h;TBST清洗3次,加入山羊抗兔IgG(H+L)(1∶5 000)孵育2 h,TBST洗膜3次。使用超敏ECL发光试剂盒显色后,用ImageJ 1.48软件进行灰度值分析。
1.2.8 miR-145a-3p对布鲁氏菌胞内生存的影响 miR-145a-3p mimics、miR-145a-3p inhibitor 和 NC mimics转染RAW264.7方法同1.2.6,转染24 h后收集细胞,用0.3%的Triton X-100裂解细胞5 min,然后分别稀释10、100、1 000和10 000倍,吸取100 μL稀释液置于布鲁氏菌固体培养基上,用涂布器涂布均匀。置于37 ℃恒温培养箱内倒置培养2~3 d,进行菌落计数。
1.3 统计分析
实时荧光定量PCR检测结果按照2-△△Ct方法计算。用SPSS 20.0统计软件进行单因素方差分析(One-Way ANOVA),结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 miR-145a-3p对布鲁氏菌诱导的RAW264.7自噬的影响
用miR-145a-3p mimics、miR-145a-3p inhibitor、NC mimics转染GFP-RFP-RAW264.7后进行布鲁氏菌侵染,结果表明,与NC mimics组相比,miR-145a-3p mimics组细胞自噬程度极显著增加(P<0.01),miR-145a-3p inhibitor组细胞自噬程度极显著降低(图1)。
2.2 miR-145a-3p靶蛋白在线预测结果
miRBase (https:∥www.mirbase.org/)和TargetScan (http:∥www.targetscan.org/ vert_71/)生物信息学软件预测结果显示,miR-145a-3p的miRNA识别位点存在于自噬相关蛋白ATG14的3′UTR区域,说明miR-145a-3p的靶蛋白为ATG14(图2)。

①A,细胞自噬荧光图;B,细胞自噬比例统计图。②与NC mimics组相比,*,差异显著(P<0.05);**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。下同①A,Autophagy fluorescence diagram;B,Statistical chart of autophagy proportion.②Compared with NC mimics group,*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01);No *,No significant difference (P>0.05).The same as below图1 各组细胞自噬情况Fig.1 Autophagy in each group

图2 miR-145a-3p的靶蛋白预测Fig.2 Target protein prediction of miR-145a-3p
2.3 PmirGLO-ATG14-3′UTR和PmirGLO-ATG14-3′UTR-mutation重组质粒的构建
0.5%琼脂糖凝胶电泳结果显示,有7 350、84和84 bp 3条目的条带(图3),分别为PmiRGLO载体、ATG14-3′UTR 和ATG14-3′UTR-mutation,与预期的结果相符。
2.4 miR-145a-3p对ATG14的靶向调控作用
由图4可知,与NC minics组相比,ATG14-3′UTR组miR-145a-3p mimics混合转染后双荧光素酶的相对荧光活性极显著降低(P<0.01);与miR-145a-3p mimics组相比,miR-145a-3p inhibitor组极显著升高(P<0.01)。 而ATG14- 3′UTR-mutation组各转染间差异不显著(P>0.05)。 表明 miR-145a-3p直接调控ATG14的表达,二者具有直接靶向关系。
2.5 miR-145a-3p对ATG14转录水平的影响
由图5可知,与NC mimics组相比,未感染布鲁氏菌时,miR-145a-3p mimics组ATG14 mRNA水平极显著降低(P<0.01),miR-145a-3p inhibitor组ATG14 mRNA水平极显著上调(P<0.01);布鲁氏菌感染后,miR-145a-3p mimics组ATG14 mRNA水平极显著提高(P<0.01)。 与NC mimics+Bru组相比,miR-145a-3p mimics+Bru组ATG14 mRNA水平显著提高(P<0.05)。
2.6 miR-145a-3p对ATG14蛋白表达的影响
由图6可知,与NC mimics组相比,miR-145a-3p mimics组ATG14蛋白的表达水平显著降低(P<0.05),miR-145a-3p inhibitor组ATG14蛋白的表达增加,但差异不显著(P<0.05)。布鲁氏菌感染后,miR-145a-3p mimics则促进ATG14蛋白的表达。说明布鲁氏菌感染有助于miR-145a-3p正向调控ATG14的表达。
2.7 miR-145a-3p对布鲁氏菌胞内生存的影响
与NC mimics组相比,转染miR-145a-3p mimics组布鲁氏菌胞内存活数显著降低(P<0.05),miR-145a-3p inhibitor组布鲁氏菌的胞内存活数增加,但差异不显著(P>0.05)(图7)。
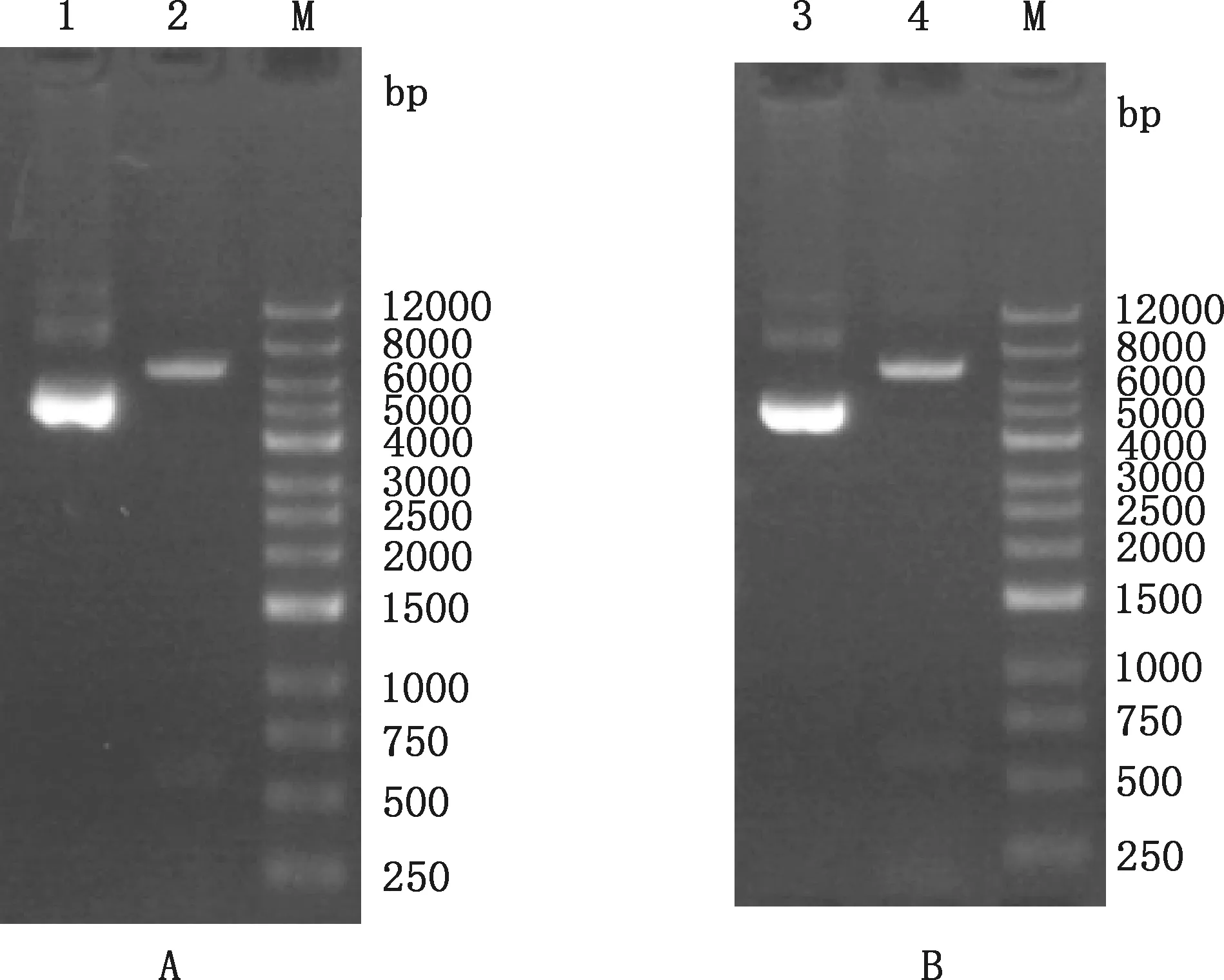
①A,PmiRGLO-ATG14-3′UTR重组质粒;B;PmiRGLO-ATG14-3′UTR-mutation重组质粒。②1,PmiRGLO-ATG14-3′UTR;2,PmiRGLO-ATG14-3′UTR重组质粒SacⅠ和KpnⅠ双酶切;M,DL12000 DNA Marker;3,PmiRGLO-ATG14-3′UTR-mutation;4,PmiRGLO-ATG14-3′UTR-mutation重组质粒SacⅠ和KpnⅠ双酶切①A,PmiRGLO-ATG14-3′UTR recombinant plasmid;B,PmiRGLO-ATG14-3′UTR-mutation recombinant plasmid.②1,PmiRGLO-ATG14-3′UTR;2,Double digestion of PmiRGLO-ATG14-3′UTR recombinant plasmid by SacⅠ and KpnⅠ;M,DL12000 DNA Marker;3,PmiRGLO-ATG14-3′UTR-mutation;4,Double digestion of PmiRGLO-ATG14-3′UTR-mutation recombinant plasmid by SacⅠ and KpnⅠ图3 重组双荧光素酶报告基因质粒双酶切鉴定Fig.3 Identification of recombinant double luciferase reporter gene plasmids by double digestion
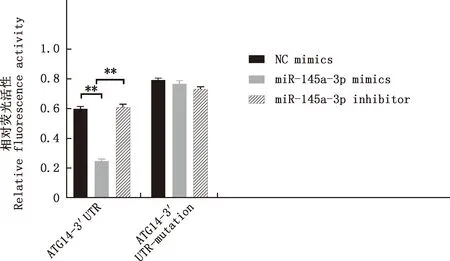
图4 miR-145a-3p靶向ATG14双荧光素酶相对荧光活性Fig.4 Relative fluorescence activity of double luciferase of miR-145a-3p targeting ATG14
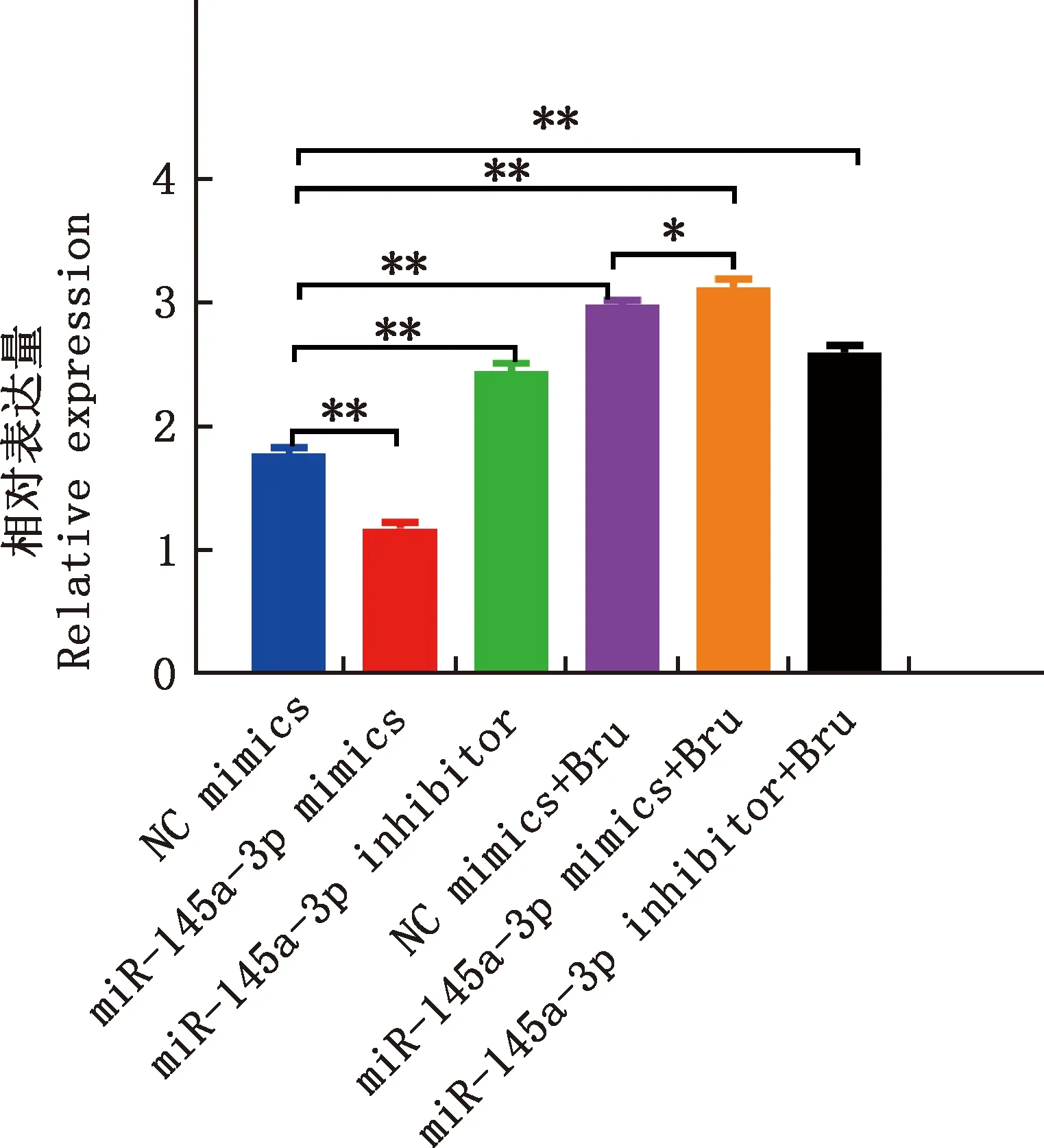
Bru,布鲁氏菌Bru,Brucella图5 各组ATG14相对表达量Fig.5 Relative expression of ATG14 in each group

1~3,NC mimics、miR-145a-3p mimics和miR-145a-3p inhibitor组;4~6,NC mimics+Bru、miR-145a-3p mimics+Bru和miR-145a-3p inhibitor+Bru组1-3, NC mimics, miR-145a-3p mimics and miR-145a-3p inhibitor groups, respectively; 4-6, NC mimics+Bru, miR-145a-3p mimics+Bru and miR-145a-3p inhibitor+Bru groups, respectively图6 各组ATG14蛋白的表达水平Fig.6 Level of ATG14 protein in each group

图7 各组布鲁氏菌胞内存活数Fig.7 Intracellular survival number of Brucella in each group
3 讨 论
布鲁氏菌能够诱导细胞自噬,从而使菌体躲避机体的免疫杀伤,达到持续性感染的目的。布鲁氏菌脂多糖(LPS)可以诱导miRNA的表达,Fas-1、B细胞淋巴瘤/白血病-2(Bcl-2)、白细胞介素-1(IL-1)、白细胞介素3受体(IL-3R)和腺苷酸活化蛋白激酶(AMPK)都参与细胞自噬途径[14-16],而这些基因都受miRNA的调控。研究发现,miR-146b-5p靶向于GTP酶激活蛋白14(Tbc1d14),Tbc1d14与自噬激酶(ULK1)相互作用,同时上调介导RAW264.7自噬激活的miR-146b-5p[17]。另外,在布鲁菌感染后,miR-1981在RAW264.7中的表达也会上调[18]。
miR-145是近年来发现一种新的miRNA分子,可以参与调控细胞侵袭、转移、增殖、分化、凋亡及自噬等过程。吴洪坤[19]研究发现,miR-145-3p靶向乙酰化酶4(HDAC4)上调转录激活因子4(ATF4)的表达,进而影响凋亡和自噬相关基因的表达调控细胞凋亡与自噬。在凋亡和自噬通路中,可能分别是通过非p53依赖的p21上调、ULK1及溶酶体关联膜蛋白2(LAMP2)的上调来介导发挥调控作用。Morin等[20]等通过高通量测序发现,miR-145a-3p与脂质代谢、葡萄糖代谢和抗氧化反应相关。本研究发现miR-145a-3p与自噬相关蛋白ATG14具有直接靶向调控关系,并在布鲁氏菌感染巨噬细胞时显著促进ATG14的表达,但在布鲁氏菌未感染时却抑制ATG14的表达,这可能与布鲁氏菌本身能够诱导细胞自噬的特性有关,并只有在布鲁氏菌的参与下miR-145a-3p才能够超高水平表达,从而提高ATG14的表达水平,促进细胞自噬。目前已有研究证明,miRNA对病原菌的复制具有抑制或促进的作用。如在对结核分支杆菌的研究中,发现miR-155抑制其在胞内的生长[21],而miR-125a促进结核分枝杆菌在胞内的复制存活[22]。miRNA-20a抑制卡介苗BCG对巨噬细胞的自噬水平,上调卡介苗BCG在巨噬细胞中的存活量[23]。在本试验中,miR-145a-3p对布鲁氏菌胞内存活影响的研究发现,miR-145a-3p不利于布鲁氏菌的胞内复制,原因可能是在miR-145a-3p的参与下宿主细胞对布鲁氏菌的杀伤力大于对布鲁氏菌产生的保护力。
本研究结果显示,在布鲁氏菌感染条件下,miR-145a-3p通过靶向调控自噬相关蛋白ATG14的表达,促进细胞自噬,但不利于布鲁氏菌在胞内的存活。然而有报道称,RAW264.7感染M5菌株时,miR-146b-5p通过调节Tbc1d14引起靶基因下游蛋白发生变化,抑制布鲁氏菌诱导的细胞自噬,从而促进胞内存活而引起机体的持续性感染[24]。 但本试验结果与布鲁氏菌诱导的细胞自噬利于布鲁氏菌生存复制理论相违背,这可能是由于miR-145a-3p在对靶基因ATG14进行调节时,会对靶基因所在的自噬信号通路产生影响,引发信号通路产生连锁反应,进而对布鲁氏菌在胞内的生存数量产生影响。由此可见,细胞自噬是一把双刃剑,其在布鲁氏菌诱导的自噬过程中发挥着双向的作用。
4 结 论
本研究结果表明,miR-145a-3p通过靶向调控自噬相关蛋白ATG14的表达,促进细胞自噬,抑制布鲁氏菌在胞内的存活。该结果为进一步了解布鲁氏菌的致病机制提供参考,miR-145a-3p有望成为今后开发预防布鲁氏菌病方案的潜在靶点。
