云南半细毛羊精子冷冻前后转录组表达差异分析
2022-03-17梁家充吕春荣洪琼花吴国权权国波
梁家充,吕春荣,洪琼花,吴国权,权国波
(云南省畜牧兽医科学院,昆明 650224)
精液冷冻保存技术大大提高了人工授精技术的效率,充分发挥了优秀种公畜的繁殖潜能,大大加快了畜禽品种改良进程。此外,精液冷冻保存对于优秀畜禽种质资源保护具有非常重要的意义[1-3]。哺乳动物精子对冷冻损伤非常敏感,冷冻过程中,由冰晶形成引起的物理性损伤、化学毒性以及氧化损伤等直接破坏精子的结构功能和抗氧化能力,导致精子受精能力下降,并可能影响胚胎质量[4]。
云南半细毛羊是中国自主培育的第一个粗档半细毛羊新品种,填补了中国无粗档半细毛羊新品种的空白。开展精液冷冻保存研究对于其种质资源保护和加快育种改良速度具有重要意义。然而,对于绵羊精子冷冻损伤机制和低温生物学特性研究方面仍滞后于其他家畜,如牛、猪等。目前,影响哺乳动物冻精存活能力的遗传机制仍需进一步探讨。精子细胞中RNA表达谱变化可能与精子冷冻损伤存在一定关联,这也成为目前精子冷冻保存研究领域的热点之一。有研究发现,外界环境应激可以引起成熟精子转录组发生变化[5]。而且,mRNA表达水平与精子生育力具有一定相关性。当前,公牛精子和人精子的转录组分析已经应用于精子质量的评判[6]。Ashish等[7]研究表明,微球蛋白(B2M)、溶质载体家族2成员5(GLUT5)、苹果酸脱氢酶1(MDH1)和三磷酸腺苷酶质膜Ca2+运输4(ATP2B4)等基因的表达水平在水牛冻融精子中变化显著。Kasimanickam等[8]研究发现,精子尾部的外层致密纤维(ODF2)和亮氨酸脱羧酶1(LDC1)的表达水平在高生育力荷斯坦牛精子比低生育力个体高2倍,而且,金属肽酶抑制剂(TIMP)、磷脂酶Cζ1(PLCz1)、腺苷酸激酶1(AK1)、小核核糖核蛋白多肽N 2(SNRPN2)和整合蛋白β5(IB5)表达水平在荷斯坦牛冻融精子中的表达量较高。Arangasamy等[9]证明荷斯坦牛精子的含伴侣蛋白的T-复合蛋白1和亚单位8(CCT8)表达水平与受胎率呈显著负相关,而磷脂酰乙醇胺结合蛋白1(PEBP1)和富含胱氨酸的分泌蛋白2(CRISP2)表达水平与受胎率呈正相关。此外,CDC28蛋白激酶调节亚单位2(CKS2)、真核翻译延伸因子1γ(EEF1G)、真核翻译起始因子1 (EIF1)、G2期/S期应答相关蛋白1抗体(GTSE1)和鱼精蛋白1(PRM1)的全长mRNA转录物可能被用来作为评价新鲜精子和冷冻精子功能的潜在标记物[10]。
本研究以云南半细毛羊作为研究对象,使用高通量转录组测序技术,对其精子冷冻前后mRNA差异表达规律进行研究,从而为绵羊精子冷冻损伤机制研究和冷冻保存技术体系优化提供必要的理论基础和分子标记物。
1 材料与方法
1.1 稀释液
本试验所使用的精液基础稀释液主要成分包括:224.0 mmol/L Tris、66.6 mmol/L柠檬酸、55.5 mmol/L葡萄糖,均购自Sigma公司。冷冻稀释液配方为在基础稀释液中添加10%新鲜蛋黄、5%甘油、100 000 IU青霉素和100 000 IU链霉素。冷冻稀释液用Tris调整pH至7.0。将冷冻稀释液于15 000×g下离心1 h,取上清用0.45 μm的一次性滤器过滤,最后于4 ℃保存备用。
1.2 主要试剂和仪器
RNA浓度检测试剂盒(Qubit®3.0 Flurometer)购自赛默飞世尔科技公司;RNA样品片段分布检测试剂盒(Agilent 2100 High Sensitivity DNA Assay Kit)购自美国安捷伦科技有限公司。电刺激采精仪(EJ6CCGS)购自北京倍特双科技有限公司;0.45 μm一次性过滤器购自密理博公司;0.25 mL塑料细管购自IMV卡苏科技股份有限公司。
1.3 精液采集和处理
采用电刺激采精仪采集3只成年、健康云南半细毛羊公羊精液。采集后10 min内运至实验室进行质量评价。采集的精液质量应该满足以下标准:精液量0.75~2 mL,最低精子密度2×109/mL,精子活力在75%以上。将3份新鲜精液样本各分成2份,一份直接用于RNA提取处理,分别编号为F1、F2和F3;另一份进行冷冻保存,分别编号为T1、T2和T3。精液冷冻保存的处理方法:在精液中缓慢加入同温度的冷冻稀释液,将精子密度稀释至2×108/mL,将稀释后的精液分装于0.25 mL塑料细管,然后以0.01 ℃/min的速度缓慢降温至5 ℃,并于该温度下平衡3 h,然后将冷冻细管于液氮蒸汽中预冻10 min,最后直接将冷冻细管投入液氮中保存7 d。解冻时,将冷冻细管投入37 ℃水浴中30 s,解冻后分别提取RNA。
1.4 单细胞转录组测序及文库构建
为了纯化精子细胞,根据Gandini等[11]描述的方法,通过Percoll密度梯度离心法去除精浆、未成熟生殖细胞、上皮细胞以及相关的冷冻保护剂成分。最后将获得的细胞沉淀保存于-80 ℃。
使用第二代RNA转录本5′-端的转换机制(Smart-Seq2)方法直接进行扩增[12],得到双链cDNA产物。使用RNA浓度检测试剂盒和RNA样品片段分布检测试剂盒,对扩增产物进行质量评估。然后以cDNA作为起始原料进行单细胞转录组文库构建。构建好的文库用Hiseq2500测序仪进行测序。
1.5 测序数据处理及生物信息学分析
测序所得原始下机序列(Raw reads),通过去除低质量序列、去除接头污染等过程完成数据处理,得到可用于后续分析的高质量序列(Clean reads)。 后续所有分析都是基于Clean reads。 本研究采用DE Seq进行基因差异表达分析,并选取差异率(|log2Ratio|≥1)和P<0.05的基因作为差异表达基因。使用GO数据库对差异表达基因进行GO功能注释;使用KEGG数据库对差异表达基因进行信号通路分析。
2 结 果
2.1 转录组测序及基因区域分布
使用Illumina Hiseq2500高通量测序技术对6个云南半细毛羊精子样本的cDNA文库测序,共获得623 399 754条原始测序序列(表1)。对原始序列进行处理过滤得到514 313 802条高质量的Clean reads,为原始数据量的82.50%。 将获得的测序序列与参考基因组进行比对,共有401 795 877条(78.00%)的Reads可以与参考基因组匹配,112 517 925条(22.00%)的Reads与参考基因组不能匹配。 在匹配的Reads中,有349 923 779条(87.09%)的Reads是唯一匹配序列;有8 361 907条(2.08%)的Reads是匹配多个位置序列;有43 510 191条(10.83%)的Reads是错配序列(图1)。唯一匹配序列中,有7 610 278条(2.17%)外显子(图2)。
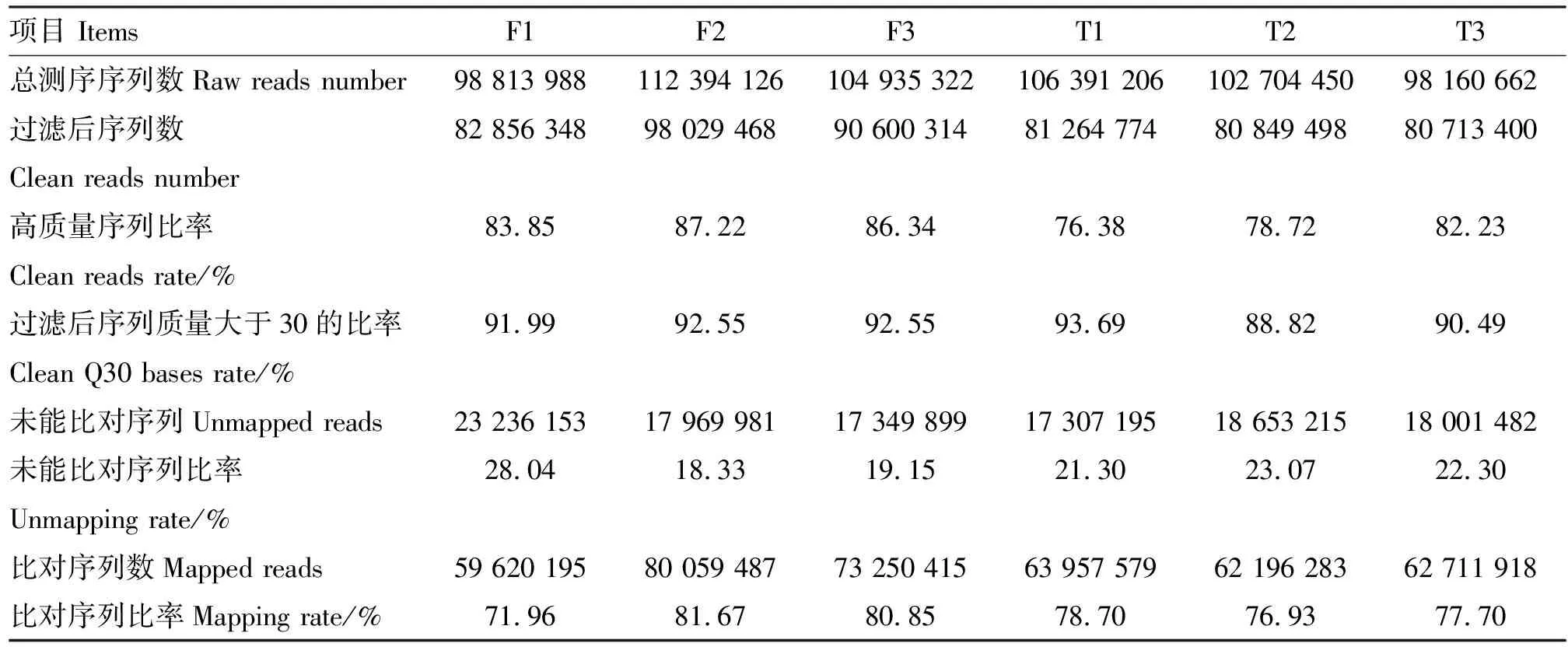
表1 测序数据分析
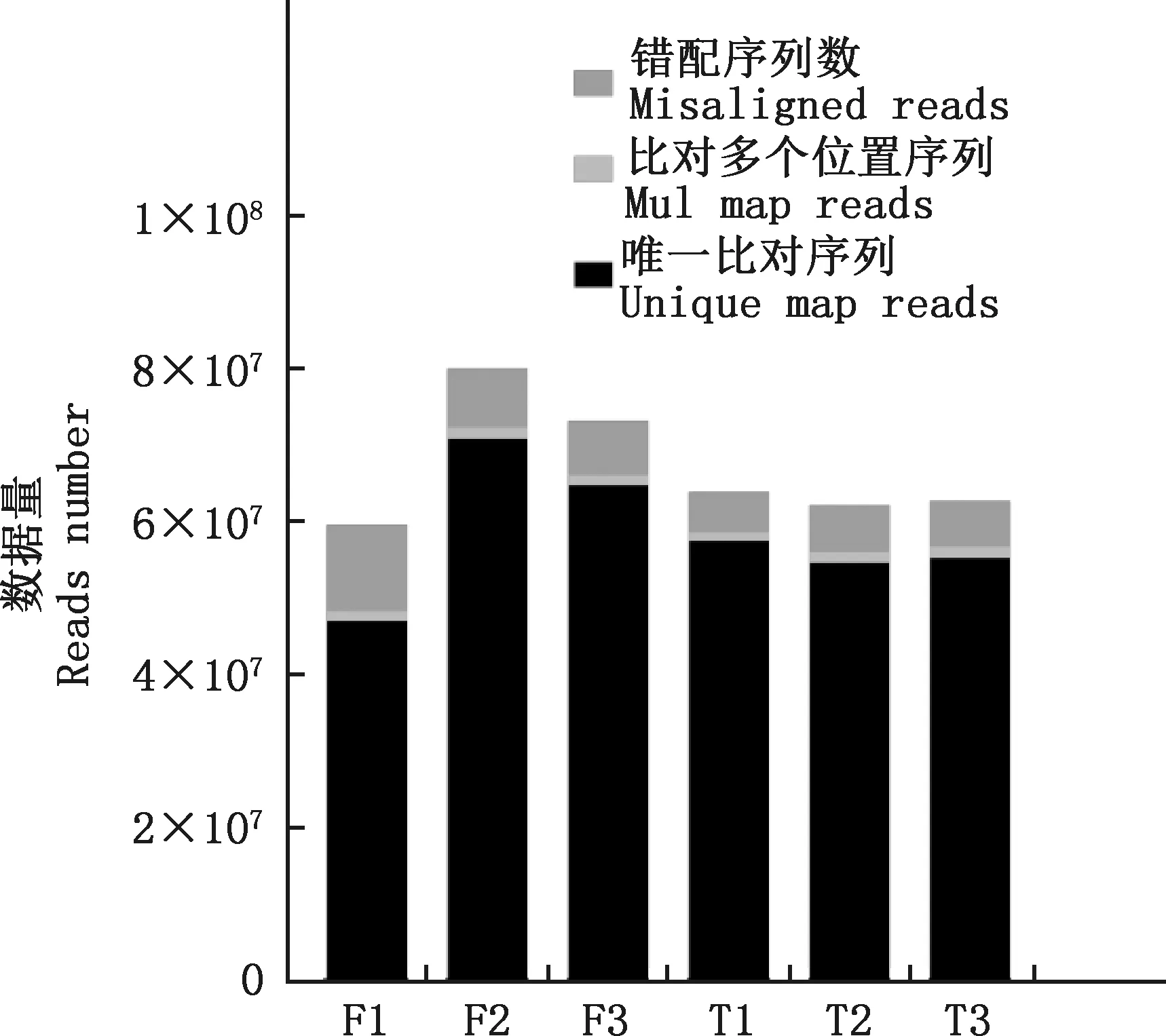
图1 比对序列分布Fig.1 Alignment sequence distribution
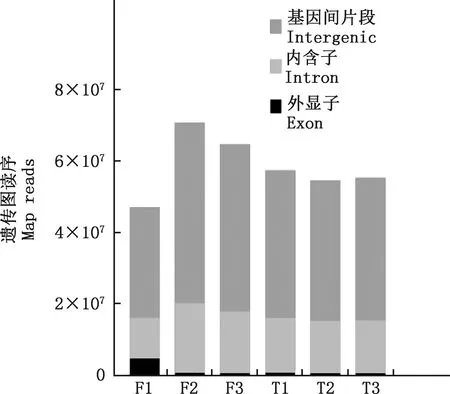
图2 唯一比对序列在参考基因组区域分布统计Fig.2 Distribution statistics of unique alignment sequences in reference genome region
2.2 差异表达基因分析
新鲜组和冷冻组精子之间差异表达基因个数为1 213个,其中冷冻精子上调基因5个,分别为:25线粒体运载家族A48(SLC25A48)、心脏病相关转录本2(HEAT-2)、 136序列相似的家族成员A(FAM136A)、初级纤毛形成(PIFO)和3-羟基丁酸脱氢酶1(BDH1);
下调基因1 208个,其中基因表达量差异最大的10个基因分别为:C-C基序趋化因子3(LOC101114535)、微球蛋白(B2M)、原癌基因AP-1转录因子亚单位(FOS)、生长停滞和DNA损伤诱导β(GADD45B)、亚精胺/亚精胺N1乙酰转移酶1(SAT1)、Ⅰ类组织相容性抗原(MHCⅠ)、热休克蛋白90α家族A类成员1(HSP90AA1)、羟基羧酸受体2(HCAR2)、纤溶酶原激活剂(PLAU)和ATP酶H+转运辅助蛋白1(ATP6AP1)。
2.3 差异表达基因的GO功能注释
对2个处理组差异表达基因进行GO功能注释分析,包括生物过程(biological processes,BP)、细胞组分(cellular components,CC)及分子功能(molecular functions,MF)3 大类。结果表明,冷冻前后差异表达基因中共有1 156个基因得到GO功能注释,共涉及56个分类(图3)。在3种GO分类中,分别富集22、17和17种生物功能。在生物过程分类中,763个基因参与细胞过程(cellular process),709个基因参与生物调节(biological regulation),647个基因参与单生物过程(single-organism process),528个基因参与代谢过程(metabolic process),375个基因参与应激反应(response to stimulus),另外,分别有53和2个基因参与与精子相关的生殖过程(reproductive process)和生殖(reproduction)。在细胞组分分类中,1 018个基因来源于细胞部分(cell part),661个基因分布于细胞器(organelle),479个基因来源于细胞器部分(organelle part),453个基因分布于质膜(membrane),432个基因参与质膜部分(membrane part)。在分子功能分类中,696个基因参与结合(binding),366个基因参与催化(catalytic),106个基因参与分子传感器(molecular transducer),96个基因参与分子功能调控(molecular function regulator),80个基因参与酶调控(enzyme regulator)。另外,11个基因参与包括精子冷冻损伤相关的氧化还原反应。
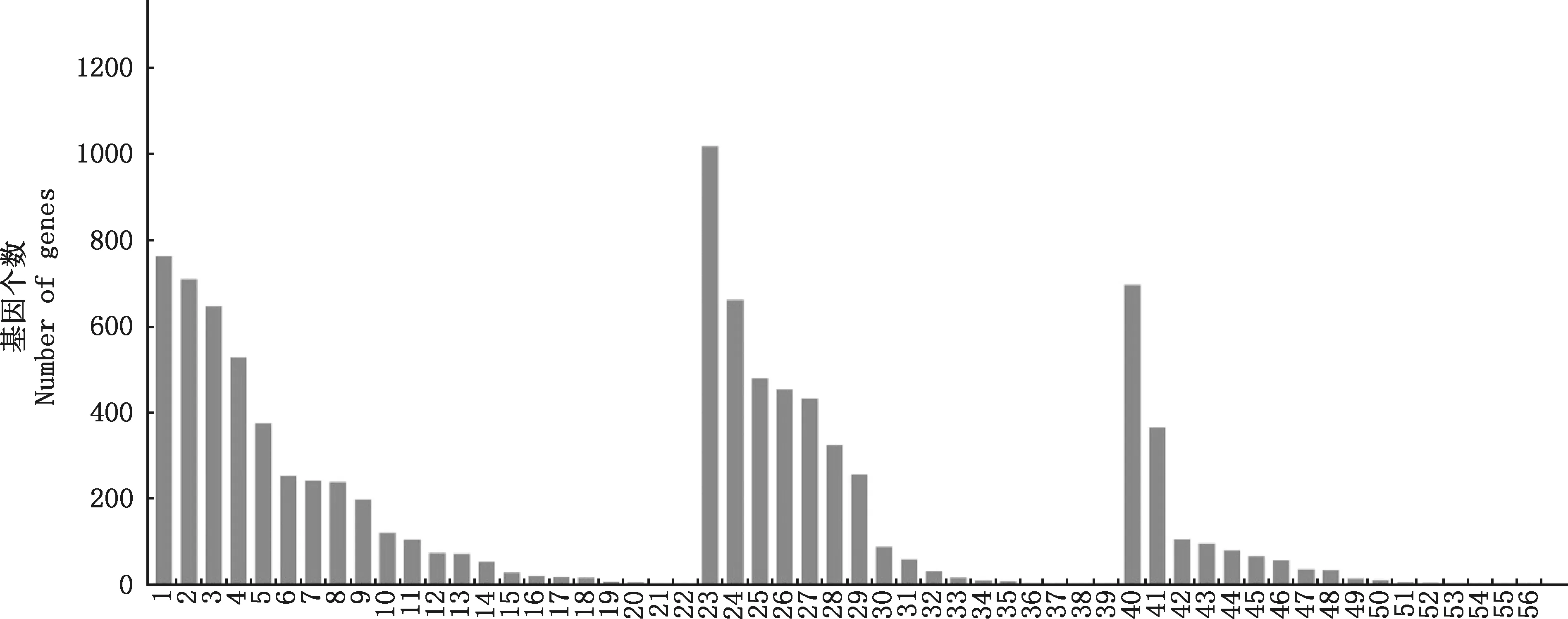
①1~22,生物学过程;23~39,细胞组分;40~56,分子功能。②1,细胞过程;2,生物调节;3,单组织过程;4,代谢过程;5,应激反应;6,定位;7,细胞成分组织或生物发生;8,发育过程;9,免疫系统过程;10,多细胞组织过程;11,多组织过程;12,生物黏附;13,运输;14,生殖过程;15,节律性过程;16,行为;17,信号;18,生长;19,细胞杀伤;20,激素分泌;21,生殖;22,生物相;23,细胞部分;24,细胞器;25,细胞器部分;26,膜;27,膜部分;28,大分子复合物;29,胞外区部分;30,细胞连接;31,胞外区;32,膜包腔;33,突触部分;34,突触;35,细胞外基质;36,细胞;37,类核;38,病毒粒子部分;39,细胞外基质部分;40,结合;41,催化;42,分子传感器;43,分子功能调控;44,酶调控;45,转运体;46,核酸结合转录因子;47,蛋白结合转录因子;48,结构分子;49,鸟苷酸交换因子;50,氧化还原反应;51,电子载体;52,化学引诱剂;53,通道调控;54,翻译调控;55,受体调控;56,蛋白质标签①1-22,Biological process;23-39,Cellular component;40-56,Molecular function.②1,Cellular process;2,Biological regulation;3,Single-organism process;4,Metabolic process;5,Response to stimulus;6,Localization;7,Cellular component organization or biogenesis;8,Developmental process;9,Immune system process;10,Multicellular organismal process;11,Multi-organism process;12,Biological adhesion;13,Locomotion;14,Reproductive process;15,Rhythmic process;16,Behavior;17,Signaling;18,Growth;19,Cell killing;20,Hormone secretion;21,Reproduction;22,Biological phase;23,Cell part;24,Organelle;25,Organelle part;26,Membrane;27,Membrane part;28,Macromolecular complex;29,Extracellular region part;30,Cell junction;31,Extracellular region;32,Membrane-enclosed lumen;33,Synapse part;34,Synapse;35,Extracellular matrix;36,Cell;37,Nucleoid;38,Virion part;39,Extracellular matrix part;40,Binding;41,Catalytic;42,Molecular transducer;43,Molecular function regulator;44,Enzyme regulator;45,Transporter;46,Nucleic acid binding transcription factor;47,Protein binding transcription factor;48,Structural molecule;49,Guanyl-nucleotide exchange factor;50,Antioxidant;51,Electron carrier;52,Chemoattractant;53,Channel regulator;54,Translation regulator;55,Receptor regulator;56,Protein tag图3 差异表达基因GO功能注释结果Fig.3 Go function annotation results of differentially expressed genes
2.4 差异表达基因的KEGG通路富集分析
对差异表达基因进行KEGG通路富集分析,结果表明,差异表达基因富集于273个通路,其中,40个通路显著富集(图4)。与疾病相关有18个通路,与生物系统相关有12个通路,与细胞过程相关有5个通路,与环境信息处理相关有5个通路。
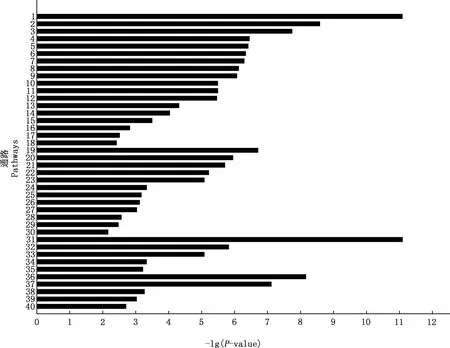
①1~18,疾病;19~30,生物系统;31~35,细胞过程;36~40,环境信息处理。②1,类风湿性关节炎;2,甲型流感;3,肺结核;4,沙门氏菌感染;5,麻疹;6,丙型肝炎;7,利什曼病;8,EB病毒感染;9,乙型肝炎;10,单纯胞疹病毒感染;11,恰加斯病(美国锥虫病);12,军团菌病;13,弓形虫病;14,百日咳;15,炎症性肠病;16,病毒致癌;17,HTLV-I感染;18,细菌侵入上皮细胞;19,细胞因子-细胞因子受体相互作用;20,Toll受体信号通路;21,NF-κB信号通路;22,NOD样受体信号通路;23,RIG-I样受体信号通路;24,B细胞受体信号通路;25,T细胞受体信号通路;26,HIF-1信号通路;27,Jak-STAT信号通路;28,脂肪细胞因子信号通路;29,MAPK信号通路;30,胞浆DNA感应途径;31,破骨细胞分化;32,吞噬体;33,细胞凋亡;34,溶酶体;35,自然杀伤细胞介导的细胞毒性;36,肿瘤坏死因子信号通路;37,趋化因子信号通路;38,集合管酸分泌;39,神经营养素信号通路;40,内质网中的蛋白质加工①1-18,Diseases;19-30,Organismal systems;31-35,Cellular processes;36-40,Environmental information processing.②1,Rheumatoid arthritis;2,Influenza A;3,Tuberculosis;4,Salmonella infection;5,Measles;6,Hepatitis C;7,Leishmaniasis;8,Epstein-barr virus infection;9,Hepatitis B;10,Herpes simplex infection;11,Chagas disease (American trypanosomiasis);12,Legionellosis;13,Toxoplasmosis;14,Pertussis;15,Inflammatory bowel disease (IBD);16,Viral carcinogenesis;17,HTLV-I infection;8,Bacterial invasion of epithelial cells;19,Cytokine-cytokine receptor interaction;20,Toll-like receptor signaling pathway;21,NF-kappa B signaling pathway;22,NOD-like receptor signaling pathway;23,RIG-I-like receptor signaling pathway;24,B cell receptor signaling pathway;25,T cell receptor signaling pathway;26,HIF-1 signaling pathway;27,Jak-STAT signaling pathway;28,Adipocytokine signaling pathway;29,MAPK signaling pathway;30,Cytosolic DNA-sensing pathway;31,Osteoclast differentiation;32,Phagosome;33,Apoptosis;34,Lysosome;35,Natural killer cell mediated cytotoxicity;36,TNF signaling pathway;37,Chemokine signaling pathway;38,Collecting duct acid secretion;39,Neurotrophin signaling pathway;40,Protein processing in endoplasmic reticulum图4 差异表达基因KEGG通路富集分析Fig.4 Analysis of KEGG pathway enrichment of differentially expressed genes
3 讨 论
相对于其他家畜而言,绵羊精子质膜不饱和脂肪酸含量相对较高,这直接导致其对冷冻损伤高度敏感。冷冻-解冻过程可对精子结构功能造成广泛的损伤,包括质膜流动性降低、质膜完整性丧失、膜蛋白功能受损、精子抗氧化活性降低、氧化应激和活性氧水平升高、DNA损伤、线粒体损伤、磷脂酰丝氨酸分布改变等[13-16]。近年来的研究发现,精子自身携带的RNA在精子发生、运动、获能、受精和早期胚胎发育等生物学过程中发挥着重要作用[17]。目前,关于绵羊精子转录组分析的报道较少。为了研究冷冻-解冻过程对绵羊精子mRNA表达模式的影响,本研究采用高通量测序技术对绵羊新鲜精子和冷冻精子进行系统的mRNA表达谱分析,共获得了1 213个显著差异表达基因。由于成熟精子细胞的转录功能处于静止状态,精子冷冻前后mRNA水平的差异可能是由于冷冻保存过程导致精子中mRNA的降解。有研究表明,冷冻可影响精子RNA转录组的完整性[18-19]。在本研究中,冷冻前后基因表达量差异最大的10个基因中,有5个基因参与免疫调节:LOC101114535、B2M、FOS、MHCⅠ和HCAR2;有1个基因参与温度信号刺激:HSP90AA1;有2个基因参与机体修复:GADD45B和PLAU,表明mRNA在精子中的差异表达与冷冻损伤存在一定关联。
差异表达基因GO富集分析结果显示,与精子功能密切相关的功能注释主要包括生物过程中的细胞过程、代谢过程、对刺激的反应、生殖过程和生殖等;细胞组分中的细胞部分、细胞器、细胞器部分、膜和膜部分;分子功能中的氧化还原反应。Shangguan等[20]研究了荷斯坦牛精子冷冻前后基因的差异表达,结果表明,冷冻后精子差异表达基因主要参与DNA修复、精子细胞发育、温度应激反应、细胞对DNA损伤应激反应、双链断裂修复、精子发生和生殖细胞发育等生物过程。该结论与本研究结果基本相同。
差异表达基因KEGG富集分析结果表明,冷冻前后差异表达基因参与40个通路,并且多富集于与炎症以及疾病相关的通路。这些差异表达基因主要富集于由细菌、病毒和寄生虫等生物病原体引发的炎症相关通路,例如沙门氏菌感染、甲型流感和弓形虫病等。此外,差异表达基因还显著富集于趋化因子信号通路、Toll受体信号通路、吞噬体、NF-κB信号通路、NOD样受体信号通路、B细胞受体信号通路、T细胞受体信号通路、Jak-STAT信号通路和MAPK信号通路。而这些通路都与免疫和炎症相关通路密切相关,提示了免疫相关通路和炎症通路可能在精子冷冻-解冻过程中发挥重要作用。本研究中,差异表达基因还富集于细胞因子-细胞因子受体相互作用和细胞凋亡通路。细胞因子是一种可溶性细胞外蛋白或糖蛋白,是细胞间重要的调节因子和动员剂。它们参与先天性和适应性炎症宿主防御、细胞生长、分化以及细胞死亡等,并影响生殖生理学的各个方面[21]。有研究显示,冷冻-解冻过程可引起水牛[22]、马[23]和野猪[24]精子的凋亡样变化,如线粒体膜电位降低、半胱氨酸蛋白酶激活、质膜通透性增加和磷脂酰丝氨酸外化[25]。推测,凋亡样改变是精子质量参数(如精子活力、活力和顶体完整性)显著下降的主要原因[26-28]。此外,Ran等[29]对猪和大熊猫冷冻精子的miRNA和mRNA表达谱进行了比较分析,结果表明,细胞凋亡、能量代谢、嗅觉传导途径、炎症反应以及相关的细胞因子-细胞因子相互作用可能与精子冷冻损伤和冷冻耐受性有关,这与本研究结果基本一致。
4 结 论
本研究使用Smart-Seq2 RNA扩增的方法对云南半细毛羊新鲜精子和冻融精子进行了单细胞转录组分析,共获得1 213个差异表达显著的基因,其中解冻后1 208个基因表达水平显著下降。差异表达基因主要参与精子细胞过程、代谢过程、应激反应、生殖等生物学过程。而且,一些基因也参与了精子的氧化还原反应。此外,差异表达基因显著富集于与精子密切相关的炎症、细胞因子-细胞因子受体相互作用和细胞凋亡等相关通路。本研究从转录组水平揭示了云南半细毛羊冻融精子基因的差异表达,对阐明绵羊精子冷冻损伤机制有重要的参考价值,同时也可以为绵羊冻精制作体系优化和冻精质量评级提供必要的分子标记物。
