绵羊KAP11.1基因克隆、原核表达及皮肤毛囊表达研究
2022-03-17宫淑娟史瑞军吴庭辉李树伟
宫淑娟,史瑞军,吴庭辉,李树伟
(塔里木大学生命科学与技术学院,塔里木盆地生物资源保护利用兵团重点实验室,阿拉尔 843300)
绵羊毛近年来被广泛应用于服装、地毯等行业[1]。和田羊产于新疆南疆地区,其羊毛是制造各类和田地毯的最佳原料[2],但和田手工地毯面临的突出问题是优质半粗毛毛源不足[3]。卡拉库尔羊是以生产羔皮为主的,其羊毛属异质粗毛,是生产各类纺织品的原料[4]。和田羊和卡拉库尔羊对南疆塔里木地区严酷的自然环境具有强大的适应能力,是该地区不可替代的当家绵羊品种[5]。因此,研究参与调控羊毛性状的基因对提升和田羊和卡拉库尔羊羊毛产量和品质进而推动当地经济发展具有重要价值。
羊毛纤维主要由硬α-角蛋白组成,主要成分为角蛋白中间丝蛋白(keratin intermediate filament protein,KIF)和角蛋白关联蛋白(keratin-associated protein,KAP)[6]。KAP的特点是含有异常高的半胱氨酸或甘氨酸和酪氨酸残基,根据其氨基酸组成可分为3类[7]。目前发现的所有KAPs都含有半胱氨酸,而半胱氨酸与角蛋白中间丝可形成二硫键交联[8]。 李志刚等[9]成功克隆和田羊KAP6.1、KAP7、KAP8基因并在原核细胞中表达;余路菲等[10]成功构建了山区型和田羊毛囊KAP1.1基因真核表达载体,并获得基因与蛋白序列;武振辉等[11]克隆了山区型和田羊毛囊KIF2.9基因,发现山区型和田羊与美利奴羊的羊毛类型存在差异;金梅等[12]研究发现,KAP7.1、KAP8.2基因在兴盛期辽宁绒山羊次级毛囊中的表达量高于初级毛囊,而在退行期则相反;Sulayman等[13]研究表明,KIF基因是影响羊毛性状的重要候选基因,为绵羊育种和羊毛品质改良提供了分子基础;Shanaz等[14]报道,KIF基因变异会影响KAP的结构,从而影响纤维特性。KAP11.1是唯一表现出强表达且在晚期基质和整个皮层中表达的基因,是KAP11家族中唯一已知的基因成员[15],它的蛋白可能无结构或部分无结构[16]。朱建勋等[17]认为,KAP11.1是影响羊毛经济性状的主要候选基因,可能会影响羊毛纤维结构。KAP11.1属于高硫蛋白,序列高度保守,高硫KAP通过与角蛋白丰富的半胱氨酸残基的二硫键交联或与角蛋白的疏水区相互作用,对毛干的形成至关重要[18]。综上,KAP基因可影响毛发品质,是提高羊毛经济性状的重要基因,因此,研究KAP11.1基因对提升羊毛产量和品质具有重要意义,然而目前对KAP11.1基因在新疆南疆地方绵羊品种中的毛囊发育机制研究甚少。鉴于此,本研究拟对平原型和田羊、山区型和田羊和卡拉库尔羊KAP11.1基因进行克隆及生物信息学分析,构建原核表达载体,检测KAP11.1基因在3种绵羊中的表达差异,为进一步研究KAP11.1基因在决定羊毛性状方面的作用提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集 3只平原型和田羊购自新疆和田地区洛浦县;3只山区型和田羊购自新疆和田地区策勒县;3只卡拉库尔羊购自新疆农一师12团。每只绵羊于肩胛骨后缘左侧中线上方10 cm处剃毛,局部麻醉后取直径为1 cm的皮肤样品,于液氮中保存备用,后续用药护理直至痊愈,整个过程严格遵循动物福利伦理要求。
1.1.2 主要试剂及仪器 限制性内切酶BamH Ⅰ和Hind Ⅲ、pMD19-T克隆载体、pET-28a(+)原核表达载体及大肠杆菌DH5α、BL21(DE3)感受态细胞均购自TaKaRa公司;反转录试剂盒购自全式金生物技术有限公司;5×蛋白上样缓冲液购自北京索莱宝科技有限公司;胶回收试剂盒购自天根生化科技(北京)有限公司。
梯度PCR仪(Veriti)购自ABI公司;超微量分光光度计(NanoDrop One)购自赛默飞世尔科技公司;凝胶成像系统(GELDOC 2000)购自Bio-Rad公司;蓝光切胶仪(G500312)购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 引物设计与合成 依照GenBank中绵羊KAP11.1基因序列(登录号:HQ595347.1),利用DNAStar软件设计引物,以18S rRNA(登录号:KF703715.1)为内参基因,普通PCR引物上、下游引入BamH Ⅰ和Hind Ⅲ酶切位点,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物信息
1.2.2 反转录及PCR扩增 用Trizol法对3种绵羊皮肤组织样品提取总RNA,采用反转录试剂盒将总RNA反转录为cDNA,以得到的cDNA为模板扩增KAP11.1基因CDS区。PCR反应体系20 μL:2×TaqMasterMix(Dye Plus) 10 μL,cDNA 1 μL,上、下游引物各0.5 μL,ddH2O 8 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸5 min。用1.0%琼脂糖凝胶电泳对PCR扩增产物进行检测。
1.2.3 克隆 胶回收KAP11.1基因片段,与pMD19-T载体进行连接,构建pMD19-T-KAP11.1克隆质粒,转化大肠杆菌DH5α感受态细胞,涂板(氨苄抗性),蓝白斑鉴定后挑取白色菌落扩大培养,进行菌液PCR鉴定,提取质粒进行双酶切鉴定。双酶切体系10 μL:pMD19-T-KAP11.1质粒7 μL,10×Quickcut Green Buffer 1 μL,QuickcutBamH Ⅰ 1 μL,QuickcutHind Ⅲ 1 μL,用1.0%琼脂糖凝胶电泳对PCR及酶切产物进行鉴定。
1.2.4 原核表达质粒pET-28a(+)-KAP11.1构建与鉴定 分别双酶切pET-28a(+)和克隆质粒pMD19-T-KAP11.1,将回收后的pET-28a(+)片段和KAP11.1基因片段16 ℃连接过夜,构建原核表达质粒pET-28a(+)-KAP11.1,转化大肠杆菌DH5α感受态细胞,涂板(卡那抗性),挑取白色菌落扩大培养,进行菌液PCR鉴定,提取质粒进行双酶切鉴定。 双酶切体系10 μL:pET-28a(+)-KAP11.1质粒7 μL,10×Quickcut Green Buffer 1 μL,QuickcutBamH Ⅰ 1 μL,QuickcutHind Ⅲ 1 μL。PCR及酶切产物用1.0%琼脂糖凝胶电泳进行鉴定,将鉴定正确的pET-28a(+)-KAP11.1重组质粒阳性菌送往生工生物工程(上海)股份有限公司进行测序。
1.2.5 生物信息学分析 运用BLAST程序和MegAlign软件对3种绵羊KAP11.1基因序列和GenBank中绵羊(Ovisaries,登录号:HQ595347.1)、白尾鹿德克萨斯亚种(Odocoileusvirginianustexanus,登录号:XM_020914491.1)、加拿大马鹿(Cervuscanadensis,登录号:XM_043449100.1)、瘤牛(Bosindicus,登录号:XM_019967059.1)、美洲草原野牛(Bisonbisonbison,登录号:XM_010855840.1)、山羊(Caprahircus,登录号:JQ795995.1、NM_001286757.1)、水牛(Bubalusbubalis,登录号:XM_006053846.2)和弯角大羚羊(Oryxdammah,登录号:XM_040227916.1)进行相似性比对,并构建系统进化树。利用ProtParam在线软件(https:∥web.expasy.org/protparam/)对KAP11.1蛋白理化性质进行分析;利用SOPMA(http:∥https:∥npsa-prabi.ibcp.fr∥)和SWISS-MODEL(https:∥swissmodel.expasy.org/interactive)在线软件对KAP11.1蛋白二级结构和三级结构进行预测。
1.2.6 SDS-PAGE及Western blotting 将pET-28a(+)-KAP11.1原核表达重组质粒转化大肠杆菌BL21(DE3)感受态细胞,涂板(卡那抗性),37 ℃过夜培养,挑取阳性菌扩大培养,IPTG诱导4 h,收集菌液,12 000 r/min离心2 min,弃上清;加入200 μL PBS混匀,12 000 r/min离心2 min,弃上清;加入160 μL PBS和40 μL 5×蛋白上样混匀,100 ℃煮10 min,室温放置,做SDS-PAGE电泳鉴定,电泳上样量15 μL。SDS-PAGE完成后进行Western blotting检测,200 mA、90 min湿转至NC
膜,将膜置于5%封闭液中封闭1 h后放入一抗中缓慢振荡1 h,TBST洗脱,接着放入二抗中缓慢振荡45 min,TBST洗脱后成像。
1.2.7KAP11.1基因在3种绵羊皮肤毛囊中的表达 以18S rRNA为内参基因,以表1中引物对3种绵羊皮肤毛囊KAP11.1基因进行实时荧光定量PCR检测。 PCR反应体系20 μL:2×TaqMasterMix 10 μL,cDNA 2 μL,上、下游引物各0.5 μL,ddH2O 7 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,共40个循环。 熔解阶段温度设置在65~95 ℃。用2-△△Ct法处理数据,用GraphPad Prism 8单因素方差分析方法整理数据并绘图,以P<0.05为差异显著性判断标准。
2 结 果
2.1 KAP11.1基因PCR扩增
以3种绵羊皮肤毛囊cDNA为模板,成功扩增出片段大小约为480 bp的目的条带(图1),无明显杂带,与预期结果一致。

1,阴性对照;M,DL2000 DNA Marker;2,山区型和田羊;3,平原型和田羊;4,卡拉库尔羊1,Negative control;M,DL2000 DNA Marker;2,Mountain-type Hetian sheep;3,Plain-type Hetian Sheep;4,Karakul sheep图1 KAP11.1基因PCR扩增结果Fig.1 PCR amplification results of KAP11.1 gene
2.2 克隆质粒pMD19-T-KAP11.1的鉴定
分别双酶切pMD19-T载体和克隆质粒pMD19-T-KAP11.1,结果显示,pMD19-T条带大小约为2 692 bp,KAP11.1基因条带约为480 bp(图2),说明克隆质粒pMD19-T-KAP11.1构建成功。

1,pMD19-T载体;M,Trans5K® DNA Marker;2,山区型和田羊;3,平原型和田羊;4,卡拉库尔羊1,pMD19-T vector;M,Trans5K® DNA Marker;2,Mountain-type Hetian sheep;3,Plain-type Hetian Sheep;4,Karakul sheep图2 克隆质粒pMD19-T-KAP11.1的双酶切鉴定Fig.2 Identification of the cloned plasmid pMD19-T-KAP11.1 by double digestion
2.3 表达质粒pET-28a(+)-KAP11.1的鉴定
分别双酶切pET-28a(+)载体和表达质粒pET-28a(+)-KAP11.1,结果显示,pET-28a(+)条带大小约为5 369 bp,KAP11.1条带约为480 bp(图3),说明表达质粒pET-28a(+)-KAP11.1构建成功。
2.4 KAP11.1基因相似性分析
将3种绵羊测序结果与GenBank中绵羊KAP11.1基因序列(登录号:HQ595347.1)进行比对分析发现,平原型和田羊和山区型和田羊基因序列的相似性均为99.79%,均为423 bp处发生突变,由C变为T,卡拉库尔羊基因序列的相似性为99.38%,其69 bp处G变为T、93 bp处C变为T、423 bp处C变为T(图4)。
山区型和田羊、平原型和田羊与白尾鹿德克萨斯亚种、加拿大马鹿、瘤牛、美洲草原野牛、山羊(登录号:JQ795995.1)、山羊(登录号:NM_001286757.1)、水牛和弯角大羚羊的相似性均分别为96.7%、95.8%、95.2%、95.4%、98.8%、99.0%、95.8%和97.9%;卡拉库尔羊与以上物种的相似性分别为96.2%、95.4%、94.8%、95.0%、98.3%、98.5%、95.4%和97.5%(图5)。
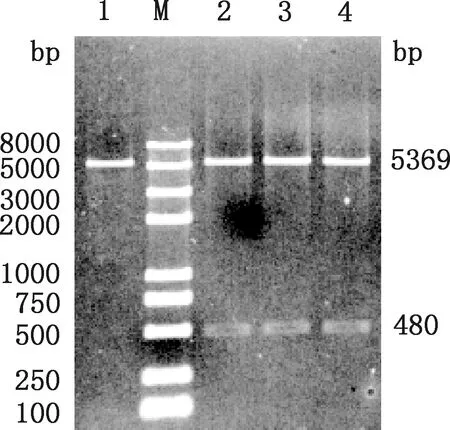
1,pET-28a(+)载体;M,Trans2K® Plus Ⅱ DNA Marker;2,山区型和田羊;3,平原型和田羊;4,卡拉库尔羊1,pET-28a(+) vector;M,Trans2K® Plus Ⅱ DNA Marker;2,Mountain-type Hetian sheep;3,Plain-type Hetian sheep;4,Karakul sheep图3 表达质粒pET-28a(+)-KAP11.1的双酶切鉴定Fig.3 Identification of expression plasmid pET-28a(+)-KAP11.1 by double digestion

图4 3种绵羊KAP11.1基因序列比对结果Fig.4 Alignment results of KAP11.1 gene sequences in 3 sheep breeds
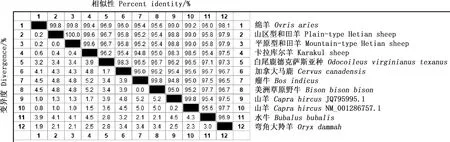
图5 KAP11.1基因核苷酸序列相似性分析Fig.5 Nucleotide similarity analysis of KAP11.1 gene
2.5 KAP11.1基因的系统进化树
利用Mega-X软件对3种绵羊序列与GenBank中绵羊及其他物种间构建系统进化树,结果见图6。由图6可知,平原型和田羊、山区型和田羊、卡拉库尔羊与GenBank中绵羊、山羊亲缘关系最近,弯角大羚羊次之,它们均由同一支分化而来,与加拿大马鹿和白尾鹿德克萨斯亚种亲缘关系稍远,与水牛、美洲草原野牛和瘤牛亲缘关系最远。

图6 KAP11.1基因系统进化树Fig.6 Phylogenetic tree of KAP11.1 gene
2.6 生物信息学分析
2.6.1 理化性质 用ProtParam在线软件对KAP11.1蛋白理化性质进行分析,结果显示,山区型和田羊、平原型和田羊和卡拉库尔羊与绵羊均编码159个氨基酸,脂肪系数和理论等电点相同,不稳定系数略有差异,但均在61左右(>40),为不稳定蛋白(表2)。
2.6.2 二级结构和三级结构 对3种绵羊KAP11.1蛋白二级结构预测发现,均由延伸链(8.18%)和无规则卷曲(91.82%)组成,但均没有预测到α-螺旋和β-折叠(图7)。通过BLAST比对找到与KAP11.1蛋白相似性为98.11%的山羊(登录号:NM_001286757.1)序列,以它作为KAP11.1蛋白的参考模板进行同源建模,蛋白三级结构预测结果见图8。
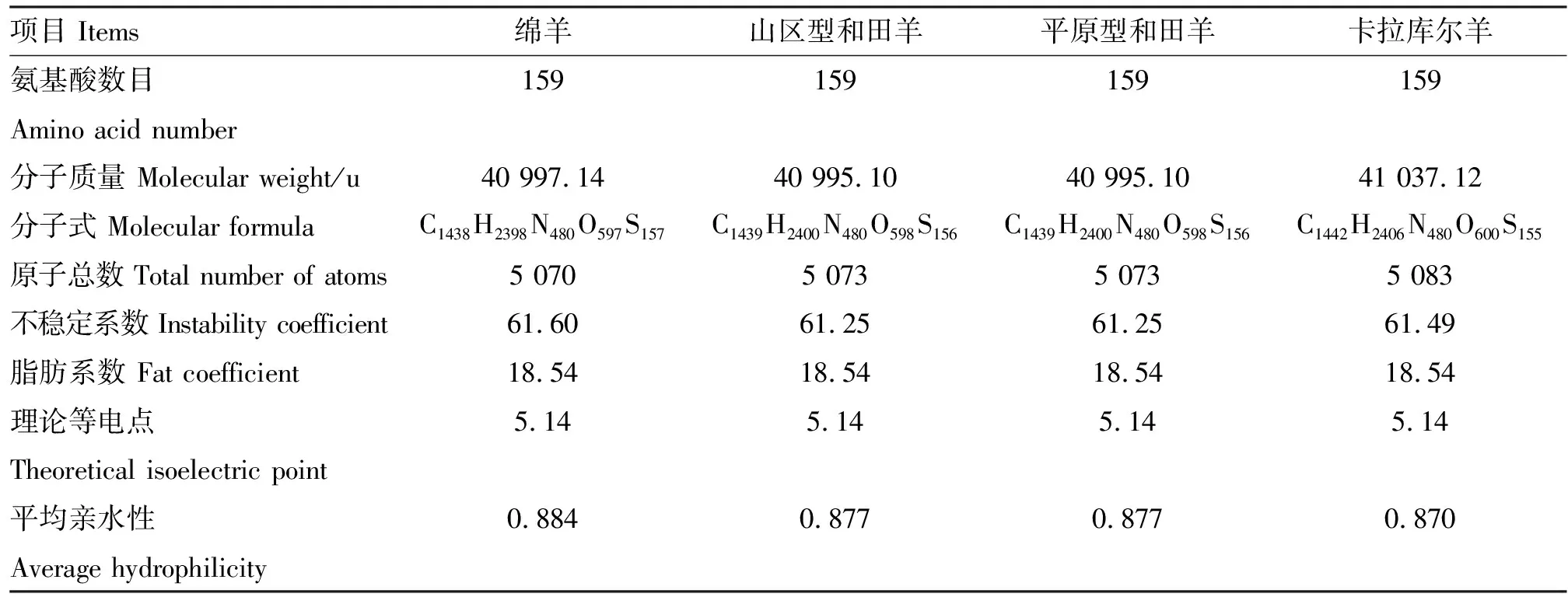
表2 KAP11.1蛋白理化性质分析
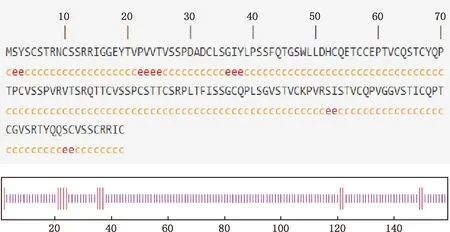
c、长线条,无规则卷曲;e、短线条,延伸链c and the long line,Random coil;e and the short line,Extended strand图7 KAP11.1蛋白二级结构预测Fig.7 Secondary structure prediction of KAP11.1 protein

图8 KAP11.1蛋白三级结构预测Fig.8 Tertiary structure prediction of KAP11.1 protein
2.7 KAP11.1基因原核表达及检测
将pET-28a(+)-KAP11.1阳性重组表达质粒转化大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导后提纯蛋白,进行SDS-PAGE和Western blotting检测,在约19 ku处出现目的条带(图9、10),与预期结果一致,说明KAP11.1基因可在大肠杆菌BL21(DE3)中进行原核表达。
2.8 KAP11.1基因在不同绵羊皮肤毛囊中的表达
对3种绵羊KAP11.1基因进行实时荧光定量PCR扩增,得到熔解曲线均有单一的信号峰,说明引物特异性较好。由图11可知,KAP11.1基因在山区型和田羊和卡拉库尔羊毛囊中的表达量显著高于平原型和田羊(P<0.05),山区型和田羊和卡拉库尔羊差异不显著(P>0.05)。
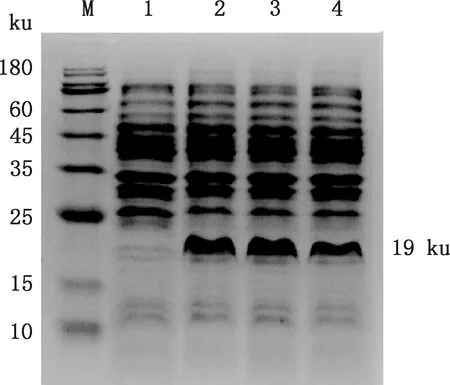
M,蛋白质分子质量标准;1,pET-28a(+);2,山区型和田羊;3,平原型和田羊;4,卡拉库尔羊M,Protein Marker;1,pET-28a(+);2,Mountain-type Hetian sheep;3,Plain-type Hetian sheep;4,Karakul sheep图9 KAP11.1蛋白SDS-PAGE检测Fig.9 SDS-PAGE detection of KAP11.1 protein

1,山区型和田羊;2,平原型和田羊;3,卡拉库尔羊1,Mountain-type Hetian sheep;2,Plain-type Hetian sheep;3,Karakul sheep图10 KAP11.1蛋白Western blotting检测Fig.10 Western blotting detection of KAP11.1 protein
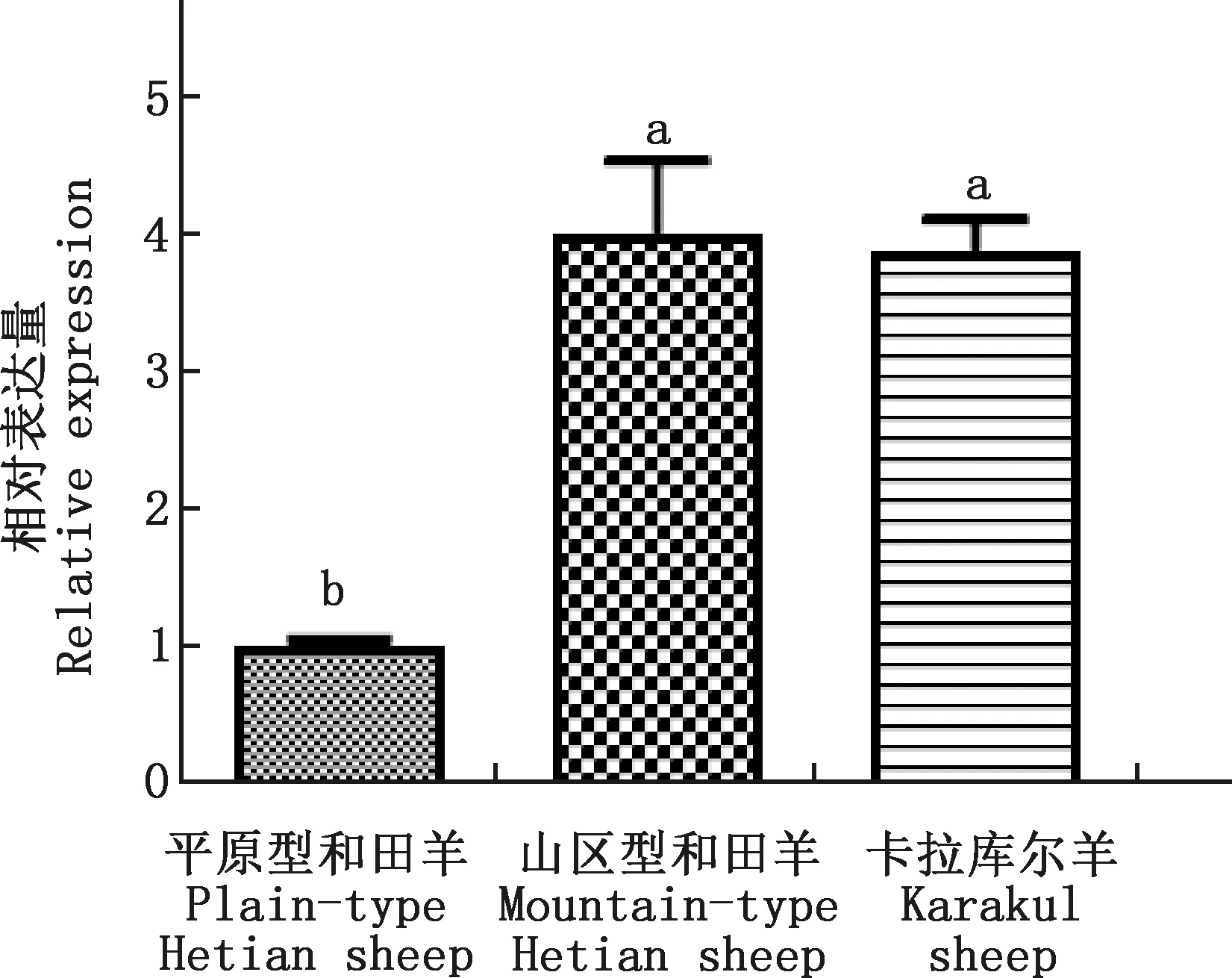
肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)Values with different letter superscripts mean significant difference(P<0.05);While with the same letter superscripts mean no significant difference(P>0.05)图11 KAP11.1基因在3种绵羊皮肤毛囊中的表达量Fig.11 Expression of KAP11.1 gene in skin follicles of 3 sheep breeds
3 讨 论
KAP11.1基因在绵羊皮肤组织中的表达类似于β-actin,在调节羊毛纤维直径中起重要作用[19],羊毛的主要成分为角蛋白,它的化学结构决定羊毛的特性,并由KAPs基因家族编码[20]。苏波[21]研究表明,KAPs含量及与角蛋白互作形成的交联结构影响羊毛的理化性质,进而决定羊毛品质。KAP基因能影响羊毛品质,可作为调控羊毛品质的候选基因[22]。本研究成功克隆了平原型和田羊、山区型和田羊和卡拉库尔羊KAP11.1基因的完整CDS区,全长480 bp,将3种绵羊基因测序结果与参照序列进行比对,平原型和田羊和山区型和田羊核苷酸序列相似性高达99.79%,卡拉库尔羊核苷酸序列相似性为99.38%,三者序列均高度保守。研究发现,KAPs基因核苷酸序列变异与山羊的产绒性状密切相关[23],绒山羊KAP26-1基因核苷酸序列的变异可能对产绒性能有影响[24]。说明KAP基因的核苷酸变异可能是影响羊毛品质的因素之一。3种绵羊均编码159个氨基酸,含有大量的半胱氨酸、丝氨酸和缬氨酸,其含有的半胱氨酸可通过二硫键和KIF交联进而影响羊毛性状[25],由于密码子的简并性,编码的氨基酸几乎没有改变,这是一种同义突变,可能是由品种不同引起的[26],具体原因有待进一步确认。
对所得序列进行生物信息学分析发现,平原型和田羊、山区型和田羊、卡拉库尔羊和参照序列及两种山羊相似性最高,与瘤牛和美洲草原野牛遗传距离最远,和田羊和卡拉库尔羊虽然在毛色和个体大小上有差异,但从同一支分化而来,相似性最高,亲缘关系最近,这说明亲缘关系越近,相似性越高,符合物种进化规律。卡拉库尔羊KAP11.1基因分子质量为41 037.12 u,原子总数为5 083,不稳定系数为61.49,均高于平原型和田羊和山区型和田羊。3种绵羊KAP11.1基因不稳定系数略有差异,为不稳定的疏水蛋白。KAP11.1蛋白二级结构无α-螺旋和β-折叠,由延伸链和无规则卷曲组成,不含有α-螺旋的原因可能与蛋白的亲/疏水性及脯氨酸含量有关[10,27]。对3种绵羊KAP11.1蛋白预测没发现三级结构,这可能是由于其二级结构缺少α-螺旋造成的,所以用蛋白相似度高的序列进行了同源建模来推测其蛋白三级结构。KAP11.1基因在3种绵羊中理化性质的差异可能引起羊毛性状的差异。
利用实时荧光定量PCR技术对KAP11.1基因在平原型和田羊、山区型和田羊和卡拉库尔羊毛囊中的表达量变化进行探究,结果发现,KAP11.1基因在山区型和田羊和卡拉库尔羊毛囊中的表达量均显著高于平原型和田羊,而在山区型和田羊和卡拉库尔羊中差异不显著。据报道,KAP11.1基因在初级毛囊、次级毛囊以及毛囊的不同部位中表达量差异明显[19,28];KAP13.3和KRT17基因表达量在山区型和田羊中最高,卡拉库尔羊次之,平原型和田羊最低[29],这与本试验结果一致。山区型和田羊毛囊密度大于平原型和田羊[30],羊毛细度、油脂含量和净毛率也优于平原型和田羊[31],山区型和田羊和平原型和田羊KAP11.1基因表达量差异的原因仍有待进一步探究。
4 结 论
试验成功克隆了平原型和田羊、山区型和田羊和卡拉库尔羊KAP11.1基因CDS区序列,长度为480 bp,编码159个氨基酸,序列相似性及系统进化树分析发现,3种绵羊与山羊亲缘关系最近,与瘤牛亲缘关系最远。试验成功构建KAP11.1基因原核重组表达载体,原核表达后获得了分子质量为19 ku的KAP11.1蛋白,该蛋白为不稳定的疏水性蛋白,由无规则卷曲和延伸链组成。实时荧光定量PCR结果显示,KAP11.1基因在山区型和田羊中表达量最高,其次是卡拉库尔羊,平原型和田羊最低。以上结果为进一步研究KAP11.1基因在决定羊毛性状方面的作用提供材料。
