萆薢分清颗粒对阿霉素肾病大鼠足细胞podocalyxin、α-actinin-4 的影响
2022-03-16马雪莉魏锦慧马鸿斌
马雪莉,魏锦慧,马鸿斌
(甘肃中医药大学附属医院,兰州 730000)
肾病综合征(nephrotic syndrome,NS)是临床常见的肾疾病之一,病理变化表现为肾小球基底膜通透性增高,电荷屏障受损,以大量蛋白尿、低蛋白血症、高脂血症和不同程度的水肿为主要临床表现。由于NS 与基因突变、免疫功能紊乱、细胞因子表达异常及足细胞受损等多种因素有关,其发病机制复杂且具体的细胞分子生物学免疫机制尚不明确,故目前临床上针对NS 的一线用药方案多以抑制免疫炎症反应为主,即给予糖皮质激素、细胞毒性药物及生物制剂等基础用药。然而,近年来的临床实践证实,免疫抑制剂在带来疗效的同时,尤其糖皮质激素亦会使部分患者产生激素依赖及激素抵抗等问题,加之激素的副作用,严重影响患者后期生活质量[1-2]。中医以“整体调节、辨证施治”为方向,在慢性肾脏病的治疗上发挥着独特的诊疗优势,故进一步探索中医药对本病的作用机制具有极为重要的临床意义。
萆薢分清颗粒是导师马鸿斌教授继承刘宝厚教授肾病“湿热不除,蛋白难消”的学术思想,结合现代医学研究及自身临床体会,在清代医学大家程钟龄所撰《医学心悟》之古方程氏萆薢分清饮的基础上加减化裁而来,方由丹参12 g、车前草30 g、茯苓15 g、关黄柏12 g、绵萆薢12 g、续断12 g、槲寄生12 g、石菖蒲10 g、甘草10 g 组成。全方共奏健脾益肾、清热利湿之效,使气虚得复,瘀祛湿利,精微封藏。导师临床运用此方治疗肾虚湿热之肾疾病均屡获良效,临床证实其能减少NS 患者尿蛋白的排泄率,为其常用之验方。而其具体作用机制尚不明确。因此本研究拟通过观察萆薢分清颗粒对阿霉素肾病大鼠足细胞相关蛋白podocalyxin、α-actinin-4表达的影响,探讨其治疗肾病综合征蛋白尿的具体作用机制,为客观评价此药疗效提供实验依据。
1 材料和方法
1.1 实验动物
雄性SD 大鼠60 只,SPF 级,6 周龄,体重(200±20)g,购自甘肃中医药大学实验动物中心[SCXK(甘)2020-0001],饲养于甘肃中医药大学实验动物中心[SYXK(甘)2020-0009],光照明暗各12 h,每日予以新鲜水及饲料。经由甘肃中医药大学实验动物伦理委员会批准(2021-234;2021-235),实验操作遵循3R 原则。
1.2 主要试剂与仪器
萆薢分清颗粒(绵萆薢12 g、续断12 g、槲寄生12 g、茯苓15 g、关黄柏12 g、丹参12 g、车前草30 g、石菖蒲10 g、甘草10 g,以上均选用中药配方颗粒剂):购于甘肃中医药大学附属医院制剂中心。醋酸泼尼松片(prednisone acetate,PRE),购自山东鲁抗医药集团赛特有限责任公司,规格:每片5 mg,国药准字:H20033023,生产批号: 210122;注射用盐酸多柔比星(阿霉素Adriamycin,ADR):酷儿化学科技(北京) 有限公司,规格:每支25 mg,国药准字RE294501,生产批号:HY613701。
α-actinin-4 抗 体(美 国Genetex 公 司,批 号402205);podocalyxin 抗体(美国Genetex 公司,批号822102958);β-actin 抗体(美国Immunoway 公司,批号 B2804);PVDF 膜(Millipore 公 司,批 号IRVH00010);ECL 发光液(上海翊圣生物科技有限公司,批号36208-A/B);蛋白电泳Marker(上海翊圣生物科技有限公司,批号26616);BCA 蛋白定量试剂盒(北京索莱宝生物科技有限公司,批号20210419);RIPA 蛋白裂解液(北京索莱宝生物科技有限公司,批号20210911)。MiniChemi 610 型全自动化学发光成像系统(北京六一生物科技有限公司);5424R 型高速冷冻离心机(德国 Eppendorf);KD-P 组织摊片机(浙江省金华市科迪仪器设备有限公司);RM2016 病理切片机(上海莱卡仪器有限公司);JB-P5 石蜡包埋机(俊杰电子有限公司);DW-HL528 超低温冰箱(中科美菱低温科技公司);iMark 酶标仪(美国Bio Rad 公司);Cobasc701 全自动生化分析仪(瑞士Roche 公司);SK-O180-E 摇床(SCILOGEX 公司);BX43+sc50 显微拍照系统(奥林巴斯有限公司)。
1.3 实验方法
1.3.1 制备模型、动物分组、给药与取样
SD 大鼠适应性喂养1 周后,随机选取12 只作为空白组,余48 只大鼠为造模组。造模组采用分2次隔周尾静脉注射阿霉素(0.4+0.1) mg/100 g 的方法建立阿霉素肾病大鼠模型[3],空白组大鼠注射同等剂量的生理盐水,以尿蛋白定量≥100 mg/24 h提示模型复制成功。
按随机数字表法将造模成功的大鼠分为模型组、中药组、泼尼松组、结合组,每组12 只,进行灌胃。依据大鼠的等效剂量相当于人的6.3 倍,中药组:萆薢分清颗粒成人每天服用125 g/60 (kg·d)。大鼠的等效剂量为125 g/60 (kg·d)×6.3=13.125 g/(kg·d)。制备为2 g/mL 溶液,则需要6.56 mL/kg。泼尼松组:泼尼松成人用量为1 mg/(kg·d),换算后大鼠等效剂量为6.3 mL/(kg·d),配置为浓度1 mg/mL 的药液,需要6.3 mL/kg。结合组给予中药量6.56 mL/kg 和泼尼松溶液6.3 mL/kg 灌胃。空白组及模型组予等体积生理盐水灌胃。每日灌胃1 次,连续4 周。给药期间每天测体重并调整灌胃剂量,每2 周检测1 次24 h-UTP。
干预4 周后,大鼠禁食水12 h 后,麻醉大鼠,心脏采血,静置30 min 后转速离心10 min,取上层血清,放于-80℃冰箱保存。取血完毕后,打开腹腔,剥离肾周围组织,摘取大鼠双侧肾,用0.9%生理盐水冲洗干净后,剔除肾被膜,一侧置于装有4%多聚甲醛固定液的小离心管中进行固定,用于HE、Masson 染色观察。另一侧置于冻存管中,液氮速冻后移至-80℃冰箱,用于免疫组化和Western blot检测。
1.3.2 检测24 h-UTP 水平
取收集的24 h 尿液,送至甘肃中医药大学附属医院检验科,使用比浊法测定24 h 尿蛋白定量。
1.3.3 生化指标检测
血TC、ALB,使用全自动生化分析仪,由甘肃中医药大学附属医院检验科生化实验室检测。
1.3.4 HE、Msaaon 染色观察大鼠肾组织病理学改变
4%多聚甲醛固定肾组织,经梯度乙醇脱水、二甲苯透明、浸蜡包埋、切片(4 μm)、烤片后分别进行HE、Msaaon 染色处理,光镜下观察肾组织病理学变化。
1.3.5 免疫组织化学法(IHC)法检测大鼠肾组织podocalyxin、α-actinin-4 蛋白表达
取出4%多聚甲醛固定的肾组织,梯度乙醇洗脱切片,滴加3% H2O2冲洗,配制0.01 mol/L 柠檬酸钠缓冲溶液(pH=6.0)90℃进行抗原修复。加入一抗(podocalyxin,1 ∶100;α-actinin-4,1 ∶100),4℃孵育过夜,PBS 液洗3 次,每次5 min,37℃孵育二抗1 h,PBS 液洗5 次。DAB 显色,苏木素复染、梯度乙醇脱水,二甲苯透明,中性树胶封片。染色结果呈棕黄色颗粒为阳性。使用Image J 计算各张片子灰度值,最终平均光密度值以AOD=IOD/Area(即intDen/area)表示。
1.3.6 蛋白免疫印迹法(Western blot)检测大鼠肾组织podocalyxin、α-actinin-4 蛋白表达水平
取100 mg 冷冻组织,剪碎,加入1 mL 预冷的生理盐水,冲洗两遍,置于低温匀浆仪中充分匀浆,4℃ 12000 r/min 离心15 min,留上清备用。根据BCA 蛋白定量试剂盒检测组织总蛋白浓度;上样、电泳、转膜。用5%脱脂牛奶封闭后分别用podocalyxin(1 ∶1000),α-actinin-4(1 ∶1500),内参β-actin(1 ∶5000)加入相应的一抗4℃孵育过夜,使用封闭液按1 ∶5000 稀释二抗,室温孵育1 h,洗脱,置于化学发光仪中曝光,使用Image 软件分析相关蛋白表达。
1.4 统计学方法
使用SPSS 21.0 软件进行统计学分析,计量资料进行正态性及方差齐性检验,满足正态性和方差齐性时,以平均数±标准差()表示。组间比较采用单因素方差分析,方差齐时,用LSD 检验;方差不齐时,用Grames-Howell 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠一般状态改变
实验过程中,空白组大鼠一般状态良好,精神佳,反应灵敏,皮毛有光泽,进食量正常;模型组大鼠精神差,活动量减少,毛发干枯,反应迟钝,时有大便质稀,阴囊水肿,部分烂尾,体重增加缓慢;各药物干预组初期和模型组有相同表现,随着用药,后期诸症逐渐改善,活动量增多,进食量增加,大便形质正常。
2.2 萆薢分清颗粒对阿霉素肾病大鼠24 h 尿蛋白定量的影响
造模2 周末,与空白组比,造模组大鼠24 h 尿蛋白定量升高(P<0.05),提示成功复制模型;灌胃2、4 周时,模型组24 h 尿蛋白水平进一步升高,各药物干预组比同期模型组不同程度减少(P<0.05),结合组降低趋势最为显著(P<0.05),见表1。
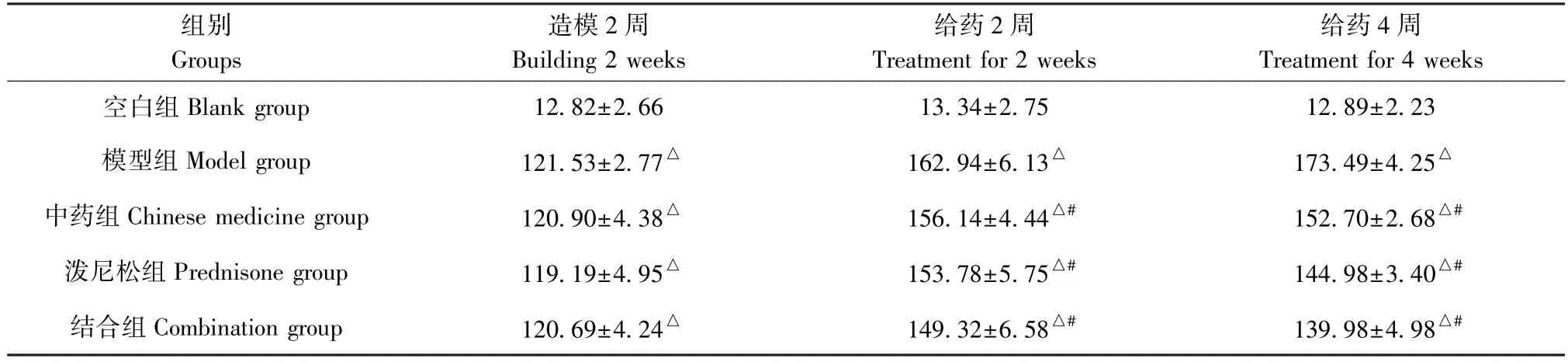
表1 不同时间各组大鼠 24 h 尿蛋白定量(¯x±s,mg/24 h)Table 1 24 h urinary protein in each group at different time
2.3 萆薢分清颗粒对阿霉素肾病大鼠血清TC、ALB 的影响
灌胃4 周末,与空白组比较,模型组大鼠TC 值升高,ALB 下降(P<0.05);与模型组比较,各药物干预组大鼠TC 值均有不同程度下降,ALB 不同程度升高(P<0.05);与中药组和泼尼松组比较,结合组大鼠血清TC 值明显降低,ALB 明显升高(P<0.05),见表2。
表2 各组大鼠TC、ALB 水平()Table 2 TC and ALB levels of rats in each group
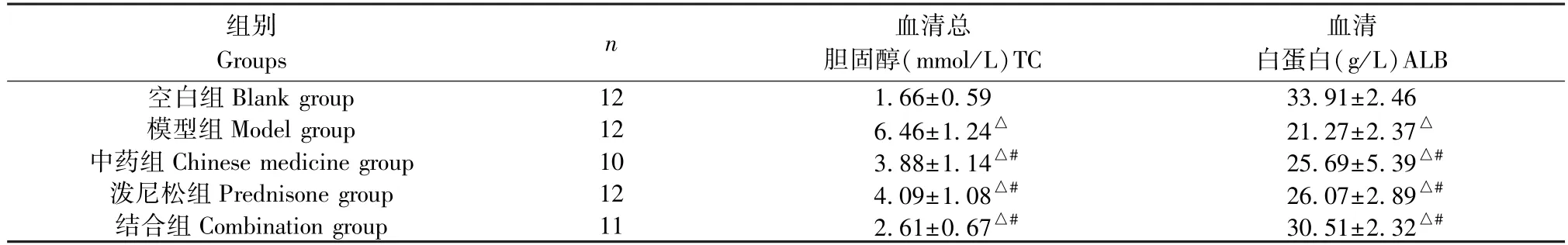
表2 各组大鼠TC、ALB 水平()Table 2 TC and ALB levels of rats in each group
注:与空白组相比,△P<0.05;与模型组相比,#P<0.05。Note.Compared with the blank group,△P<0.05.Compared with the model group,#P<0.05.
2.4 光镜下HE、Masson 染色后阿霉素肾病大鼠肾组织的病理变化
经HE、Masson 染色后,使用200 倍光镜观察,结果显示:空白组大鼠肾小球形态结构清晰,基质部未见增生、坏死,小管及间质无明显病理学改变;模型组肾小球可见局灶节段性瘢痕形成,系膜细胞及系膜基质增生,肾小管空泡变性,管腔内可见蛋白管型,间质纤维细胞增生伴炎性细胞浸润;各药物干预组间肾小球及肾小管病变均有所改善,结合组改善最为明显。见图1、图2。
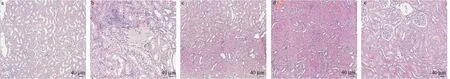
图1 各组大鼠 HE 染色Figure 1 HE staining of rats in each group
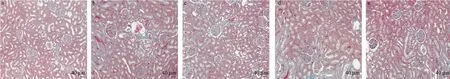
图2 各组大鼠Masson 染色Figure 2 Masson staining of rats in each group
2.5 免疫组化法检测肾组织podocalyxin、αactinin-4 的表达
肾组织podocalyxin、α-actinin-4 蛋白结果显示,与空白组相比,模型组和各药物干预组大鼠podocalyxin 表达均明显降低,α-actinin-4 表达明显升高(P<0.05);与模型组相比,各药物干预组podocalyxin 表达均升高,α-actinin-4 表达均有所下降(P<0.05);且结合组podocalyxin 表达高于中药组、泼尼松组,α-actinin-4 表达低于中药组、泼尼松组(P<0.05),见表3、图3、图4。

图3 免疫组化法测肾组织podocalyxin 的表达Figure 3 Immunohistochemical staining of renal tissue expression of podocalyxin

图4 免疫组化法测肾组织α-actinin-4 的表达Figure 4 Immunohistochemical staining of renal tissue expression of α-actinin-4
表3 各组大鼠肾组织podocalyxin、α-actinin-4 蛋白表达比较(平均光密度,)Table 3 Comparison of podocalyxin and α-actinin-4 protein expression in kidney tissues of rats in each group(Mean optical density)

表3 各组大鼠肾组织podocalyxin、α-actinin-4 蛋白表达比较(平均光密度,)Table 3 Comparison of podocalyxin and α-actinin-4 protein expression in kidney tissues of rats in each group(Mean optical density)
注:与空白组相比,△P<0.05;与模型组相比,#P<0.05。Note.Compared with the blank group,△P<0.05.Compared with the model group,#P<0.05.
2.6 Western blot 检测podocalyxin、α-actinin-4 蛋白的相对表达量
与空白组相比,模型组和各药物干预组大鼠podocalyxin 表达强度降低,α-actinin-4 表达强度升高(P<0.05);与各模型组相比,各药物干预podocalyxin、组有达强度均升高,α-actinin-4 表达强度均降低(P<0.05);且结合组podocalyxin、表达优于中药组、泼尼松组,α-actinin-4 表达弱于中药组、泼尼松组(P<0.05),见表4、图5。
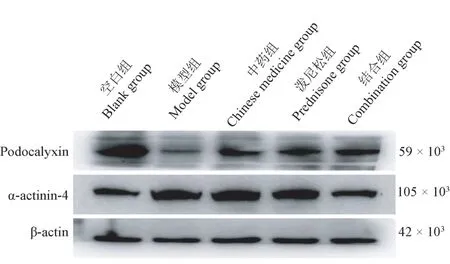
图5 各组大鼠肾组织podocalyxin、α-actinin-4 蛋白表达Figure 5 podocalyxin and α-actinin-4 protein expression in renal tissue of rats in each group
表4 各组大鼠肾组织podocalyxin、α-actinin-4 蛋白表达量()Table 4 Podocalyxin and α-actinin-4 protein expression intensity in renal tissues of rats in each group
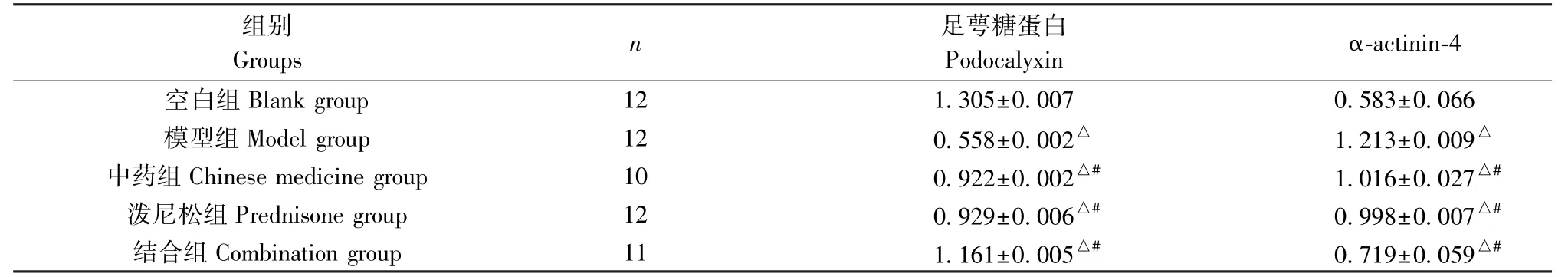
表4 各组大鼠肾组织podocalyxin、α-actinin-4 蛋白表达量()Table 4 Podocalyxin and α-actinin-4 protein expression intensity in renal tissues of rats in each group
注:与空白组相比,△P<0.05;与模型组相比,#P<0.05。Note.Compared with the blank group,△P<0.05.Compared with the model group,#P<0.05.
3 讨论
根据病理表现,阿霉素肾病模型可分为急性阿霉素肾病模型与慢性阿霉素肾病模型,急性阿霉素肾病模型病理改变与人类微小病变肾病相似[4]。本实验根据文献报道[3]采用分2 次隔周尾静脉注射阿霉素(0.4+0.1) mg/100 g 的方法制备阿霉素肾病模型。模型组动物在造模后第15 天24 h 尿蛋白定量显著上升,第28 天出现明显的组织病理学改变,与空白组比较有统计学意义,表明本次实验复制阿霉素肾病模型较为理想。
NS 临床表现为持续大量蛋白尿,而足细胞结构及功能的改变是导致蛋白尿及NS 发病和进展的关键环节。长期持续大量蛋白尿可造成肾小球硬化、肾小管损伤和肾间质炎症细胞浸润及纤维化,导致足细胞病变,最终肾功能下降,从慢性肾病发展为终末期肾病[5-6]。因此,开展对podocalyxin、αactinin-4 等足细胞蛋白的研究,寻找安全有效降低尿蛋白的方法,防止肾病理损伤的恶化,延迟肾替代治疗的时间,逐渐成为治疗肾病综合征蛋白尿的新靶点。
NS 属于中医“水肿”、“关格”等范畴。本病病机为本虚标实,虚以肺、脾、肾三脏气血阴阳亏虚为主,邪实则以湿、热、瘀为甚,三者相互胶浊,致疾病反复迁延难愈。本研究采用临床经验方萆薢分清颗粒进行干预,方中绵萆薢利湿通淋,分清去浊为君药;车前草通利小便,清膀胱湿热;续断补肝肾,强筋骨。二药合用,补肾清热利湿,达标本兼治之功,共为臣药;茯苓利水渗湿健脾;黄柏清泻下焦湿热;加用槲寄生以增强续断补肾之力;石菖蒲交通心肾,化湿通窍;丹参通心窍、清血热;五药合用,加强补肾清热利湿之力,共为佐药;生甘草一味以调和诸药亦增清热解毒之力为使药;诸药合而成方,使得此方配伍严谨,疗效显著。共奏健脾益肾、清热利湿之效,使气虚得复,瘀祛湿利,精微封藏,以调节脏腑阴阳动态的平衡。现代药理研究表明,萆薢水提物可通过减少肾组织中TNF-α、MCP-1 和ICAM-1 的表达及血清MCP-1 蛋白合成水平,起到保护肾的作用[7]。车前草有抗氧化和免疫调节作用[8];续断可增强小鼠非特异性免疫功能[9];茯苓多糖可通过激活PPAR-γ 表达,抑制p38 MAPK 磷酸化,从而延缓db/db 小鼠肾小球硬化,保护肾损伤[10];黄柏中的主要成分黄柏碱可明显降低大鼠血清中Scr、BUN 含量,抑制炎性因子的释放,减轻肾的病理损伤,改善肾功能[11]。丹参多酚酸盐可通过抑制糖尿病肾病小鼠体内氧化应激反应及调控TGF-β1/Smad 信号通路的活化状态,减轻肾纤维化,延缓肾组织病理学改变[12]。本实验中,模型组大鼠24 h 尿蛋白定量升高,肾小球可见局灶节段性瘢痕形成,系膜细胞及系膜基质增生,肾小管空泡变性,管腔内可见蛋白管型,间质纤维细胞增生伴炎性细胞浸润;经萆薢分清颗粒干预后,24 h 尿蛋白、血清TC 明显下降、ALB 升高,肾组织病理明显改善,提示萆薢分清颗粒能降低阿霉素肾病大鼠24 h 尿蛋白量、血清TC 值,升高ALB 及减轻肾病理变化进而延缓疾病进展的作用,并且中西医结合用药效果显著。
足细胞是一种附着在基底膜上的高度终末分化上皮细胞,位于肾小球毛细血管壁最外层,由胞体、主突和足突构成。足细胞之所以能在基底膜上稳定附着并发挥其正常功能,主要依赖于足细胞相关蛋白的维持。目前研究较多的是顶膜区蛋白podocalyxin 和骨架区蛋白 α-actinin-4。足细胞podocalyxin、α-actinin-4 与裂孔膜一起构成滤过屏障,共同维持足细胞的形态结构以及足细胞与GBM的功能完整,podocalyxin 的缺失及α-actinin-4 表达改变可引起足突融合,引发蛋白尿。podocalyxin 是一种带有大量负电荷的CD34 家族的唾液酸蛋白,位于足细胞的胞膜顶端,也是维持肾小球滤过屏障结构和功能正常发挥的最主要物质基础[13]。临床研究发现微小病变、IgA 肾病等各种肾小球疾病患者,其肾组织穿刺病理活检中肾小球足细胞podocalyxin 表达明显降低,并与蛋白尿严重程度相关[14]。实验研究表明podocalyxin 蛋白与肾小球足细胞关系密切,podocalyxin 的表达减少可引起足突融合,并与蛋白尿产生关系密切[15]。骨架蛋白αactinin-4 是收缩蛋白超家族成员,是维持足细胞骨架和裂隙隔膜功能的重要肌动蛋白相关分子,可将松散的肌动蛋白纤维交联成可收缩束状结构[16]。α-actinin-4 特异表达于肾小球脏层上皮细胞即足细胞[17],α-actinin-4 能将细胞骨架与裂孔隔膜分子连接起来,在保持足细胞生理结构中起核心作用。其中,肌动蛋白细胞骨架的改变与α-actinin-4 分子表达和分布的异常密切相关。近年的许多实验证实足细胞功能及结构的异常,滤过膜的损伤及蛋白尿的出现是由α-actinin-4 的异常表达所导致[18]。本实验中,模型组大鼠免疫组化结果显示podocalyxin阳性表达明显减弱,α-actinin-4 呈强阳性表达;免疫印迹结果显示podocalyxin 表达强度降低,α-actinin-4 表达强度升高;药物干预后,各治疗组podocalyxin阳性表达增强,α-actinin-4 阳性表达减弱,podocalyxin 表达强度升高,α-actinin-4 表达强度下降。且结合组表现出明显的优势。这提示萆薢分清颗粒能通过下调大鼠肾组织足细胞骨架αactinin-4 及上调足细胞顶膜区podocalyxin 表达,修复受损的足细胞,稳定足细胞结构与功能,减少尿蛋白的排泄,延缓慢性肾病的发展。
综上,萆薢分清颗粒可能通过上调阿霉素肾病大鼠肾组织中足细胞podocalyxin 表达,下调αactinin-4 表达,修复受损的足细胞,减轻大鼠肾病理损伤,减少尿蛋白排泄,延缓肾病综合征大鼠病情进展。
