口腔诊疗环境细菌群落的时间变化趋势研究
2022-03-16杨加震张颖刘育含李帆曾飞李修珍马玉莹杨芳
杨加震 张颖 刘育含 李帆 曾飞 李修珍 马玉莹 杨芳
1.青岛大学附属青岛市市立医院口腔医学中心 青岛 266071;2.大连医科大学口腔医学院 大连 116044;3.中国人民解放军东部战区总医院口腔科 南京 211299;4.天津医科大学口腔医院 天津 300070
口腔是多种微生物的天然栖息地,这些生态位可成为细菌、病毒、真菌等致病微生物的储存库,在诊疗操作中构成交叉感染的风险,甚至可能导致全身感染[1]。口腔诊疗操作中,高速手机、三用枪等设备的使用都会产生大量气溶胶,这些含有致病微生物的悬浮颗粒可在距患者2 m范围内活动[2],沉积定植于诊室环境表面。在口腔诊室综合治疗椅、电脑等位置均检测到致病微生物的存在[3],且有患者在经口腔诊疗后感染军团病的相关病例被报道[4],这些发现凸显了诊疗环境作为致病微生物储存库和院内交叉感染的可能来源,因此,口腔诊疗环境中微生物种群及其功能属性的认识了解对于感染防控至关重要。
环境表面的清洁与消毒是医院感染防控工作计划中的基本要素,但达到所需的消毒水平仍是挑战之一[5]。目前,口腔诊疗环境微生物检测研究主要通过培养技术。然而,在各种环境中有99%以上的微生物很难通过培养识别[6],导致缺乏某些独特微生物在不同环境生态位间传播和定植的检测研究[7]。随着不依赖培养的高通量测序技术发展,对环境微生物群落有了进一步了解,不再局限于单一物种或种群。目前,借助该技术对于口腔诊疗环境的相关研究仅限于综合治疗椅水中微生物的检测[8-9],缺乏对口腔诊疗环境表面微生物的相关研究,阻碍了口腔诊疗环境有效感染防控策略的制定与实施。
因此,本研究采用16S rRNA高通量测序方法并结合多元统计分析手段,探究了口腔诊疗环境细菌群落特征及其随诊室投入使用时间增加的变化趋势,为口腔诊疗环境感染防控提供一定的理论依据。
1 材料和方法
1.1 研究对象
选取青岛市市立医院3间新装修诊室,分别于投入使用前、使用1月、使用3月3个时间点进行采样。在此期间,各诊室进行日常清洁及消毒,治疗区每名患者治疗后使用75%乙醇擦拭消毒,治疗外周区每日工作结束后进行消毒及通风,遇污染及时清洁、消毒,每周对诊室环境进行1次彻底清洁消毒。每间诊室选取5个采样位点:综合治疗椅灯柄、治疗台按键、综合治疗椅扶手、清洁物品存放抽屉把手、鼠标。
1.2 样本采集
采样当日诊疗活动结束后,采样者无菌条件下操作,使用预先用无菌盐溶液润湿的拭子在采样面横竖各涂擦5次,边涂擦边旋转拭子。所有样本均由同一采样者完成。样本采集后置于-20 ℃冰箱保存备用。
1.3 基因组DNA 提取、聚合酶链式反应(polymerase chain reaction,PCR)扩增及测序
采用DNeasy PowerSoil Kit(Qiagen公司,美国)试剂盒对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳和NanoDrop 2000检测DNA的浓度。选取16S rRNA片段上V3-V4高变区(引物343F 和798R)进行PCR扩增。PCR产物使用电泳检测,检测后使用磁珠纯化,纯化后作为2轮PCR模板,并进行2轮PCR扩增,并再次使用电泳检测,检测后使用磁珠纯化,纯化后对PCR产物进行Qubit定量。根据PCR产物浓度进行等量混样,并上机测序。
1.4 生物处理及统计分析
为了研究菌群多样性,原始双端序列去杂生成优质序列之后,采用Vsearch(Version 2.4.2)软件[10],根据序列的相似性(相似度≥97%),将序列归为多个操作分类单元(operational taxonomic units,OTU)。基于OTU构建稀释曲线,计算物种丰富度指数(Chao1) 和物种多样性指数,即Shannon和Simpson指数,以展示环境菌群的Alpha多样性。进一步基于样本的未加权Unifrac距离,以及主坐标分析(principal coordinate analysis,PCoA),进行Beta多样性分析,以展示不同时间3组间的物种结构特征。使用QIIME (Version 1.8.0)软件[11]挑选出各个OTU的代表序列,并将所有代表序列与Greengene数据库(http://greengenes.secondgenome.com/)进行比对注释,计算出门、属等水平各物种相对丰度,进行分析比较。Alpha多样性两两进行独立样本t检验,Adonis检验测定Beta多样性的显著性,菌群水平差异采用Kruskal Wallis检验,P<0.05认为差异有统计学意义。
2 结果
2.1 测序结果质量分析
基于97%相似水平下,对各样本序列信息进行聚类分析并统计得知,45个样本在过滤掉低质量的序列后,有效序列的总数为2 674 086,每个样本平均得到59 424条序列。从稀释曲线(图1)可知,序列数量到2 000时,各样本稀释曲线均基本趋于平缓,说明取样合理,能较真实地反映诊室环境样本的细菌微生物。

图1 样本稀释曲线图Fig 1 Rarefaction curves of three groups
2.2 基于OTU的菌种多样性分析
对口腔诊疗环境中细菌群落的构成进行解析,由基于OTU水平的Venn图(图2)可知,3组样本共得到17 814个OTU,其中核心OTU为3 576个,独有OTU数量分别为3 761(G1组)、3 653(G2组)和2 841(G3组)。3组样本的Alpha多样性分析如图3所示,G1组的Chao1指数明显高于G3组(P<0.05);但3组间的Shannon和Simpson指数差异无统计学意义(P>0.05)。
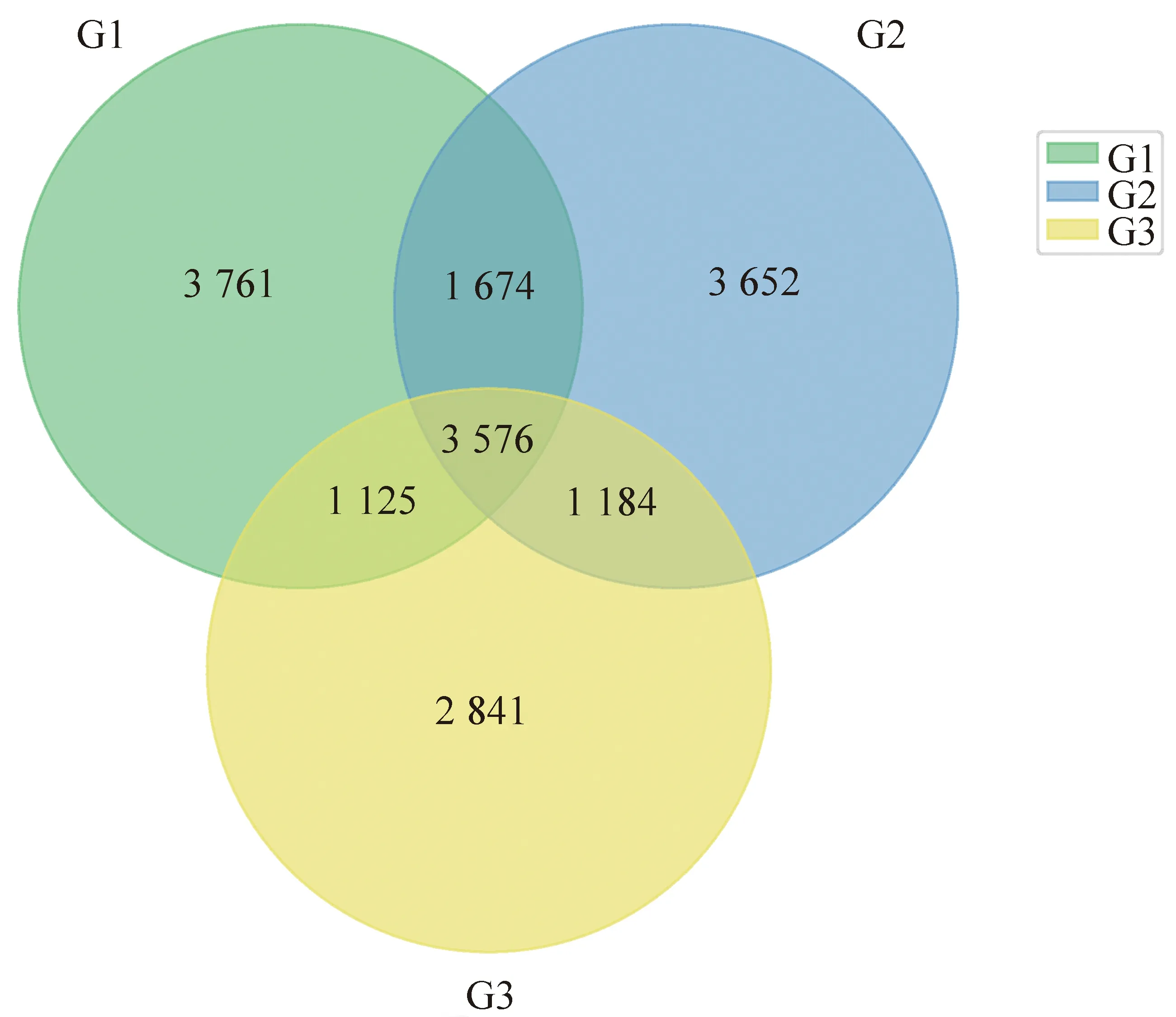
图2 基于OTU水平的Venn图Fig 2 Venn diagram based on OTU level

图3 Chao1、Shannon和Simpson指数Fig 3 Index of Chao1,Shannon and Simpson
2.3 基于未加权Unifrac距离的菌落结构特点
诊疗环境细菌群落结构分析结果(图4)显示,随着诊室投入使用周期的增加,菌群物种变化存在显著差异(F=1.141,P<0.05,图4A);进一步通过距离矩阵进行PCoA分析(图4B),可以看出:G3组与G1、G2组相比,样本间差异变小。

图4 3组细菌群落结构比较Fig 4 Comparison bacterial community structure in three groups
2.4 基于门水平口腔诊疗环境菌群结构分析
基于细菌门水平,对诊室环境样本的菌群微生物相对丰度进行比较分析,结果见图5。超过95%的群落组成由以下7个优势细菌门构成,包括变形菌门(34.86%)、厚壁菌门(26.02%)、拟杆菌门(22.76%)、放线菌门(8.12%)、硝化螺旋菌门(1.92%)、酸杆菌门(1.67%)、芽单胞菌门(1.37%);3组样本在门水平上的物种组成较为近似,差异无统计学意义(P>0.05)。

图5 门水平上细菌类群比较Fig 5 Comparison of bacterial groups at phylum level
2.5 基于属水平口腔诊疗环境菌群结构分析
对3组样本中丰度前30的细菌属的分析结果显示,口腔诊疗环境优势菌属(相对丰度>1%)有8种(图6A),主要依次是:乳杆菌属(9.61%)、埃希氏菌-志贺氏菌属(8.94%)、拟杆菌属(4.82%)、双歧杆菌属(3.34%)、链球菌属(2.23%)、副拟杆菌属(2.21%)、毛螺菌属(1.61%)、瘤胃菌属(1.01%);共检测到7种潜在致病菌(图6B),包括:埃希氏菌-志贺氏菌属、拟杆菌属、链球菌属、普氏菌属、黄杆菌属、加德纳菌属以及假单胞菌属,随着诊室使用周期延长埃希氏菌-志贺氏菌属的相对丰度明显增加(P<0.05),而假单胞菌明显减少(P<0.05)。

图6 属水平上细菌类群比较Fig 6 Comparison of bacterial groups at genus level
3 讨论
众所周知,医院感染管理工作不仅仅局限于过程管理,更重要的是风险管控,及时识别、控制风险是降低院内感染发生的重要措施。随着对多种传染性疾病传播途径的不断研究,医院环境被认为是包括病原菌在内的最大微生物库之一,可供微生物定植,并最终导致医院内感染的发生[12]。由于口腔诊疗操作的开放性、侵入性特点,以及口腔诊疗器械复杂、腔隙多等结构特征,均增加了清洁灭菌的难度,导致患者及医务人员发生交叉感染的概率增大。了解微生物群落如何在环境中的无生命表面定植并持续生存,对于评估微生物群落可能对公共健康构成的风险至关重要[13]。在这项研究中,笔者通过16S rRNA基因测序,对口腔诊疗环境表面细菌的多样性进行了描述,进一步分析了细菌群落随诊室投入使用时间的动态变化趋势。
基于16S rRNA基因测序结果,口腔诊疗环境表面随着投入使用时间的增加,观察到组内独有OTU数量逐渐减少,表明口腔诊疗环境中稀有细菌物种有所降低。进一步考察了3组环境样本的菌群物种多样性差异,发现3菌群物种多样性Shannon和Simpson指数均无差异,但G1组的菌群物种丰富度,即Chao1指数显著高于G3组,这与OTU计算及PCoA分析结果相一致,提示诊疗环境表面菌群物种丰富度随着投入使用时间增加而降低,组内样本间相似性增加,考虑为日常清洁消毒或较为单一的口腔诊疗活动对生态演替影响的结果。既往研究表明,人类可以通过呼吸、脱落细胞、直接或间接将微生物转移至周围的物体表面,进而影响环境中细菌群落的组成,但口腔诊疗环境中菌落物种丰富度的变化关系还有待进一步验证。
为研究口腔诊疗环境表面菌群具体构成,笔者基于种系发育信息对样本中的细菌进行了分析。研究[14]发现,诊疗环境微生物中主要细菌门构成包括变形菌门、厚壁菌门、拟杆菌门等,这与既往关于手术室、重症监护室的环境表面微生物研究结果较为一致。这些优势菌门在人类健康口腔以及龋病、牙周炎患者口腔菌群中均占有较大比重[15-17],它们可借助诊疗操作过程中产生的大量气溶胶沉降定植在环境表面。在这项研究中还发现了高致病性和机会致病菌,如埃希氏菌-志贺氏菌、假单胞菌、链球菌及黄杆菌等,既往在口腔综合治疗椅水路微生物研究中同样证实了这些细菌的存在[8]。尽管这些致病微生物的物种丰富度较低,但交叉感染的危害不容忽视。埃希氏菌-志贺氏菌不仅与口腔扁平苔藓有关,而且在溃疡性结肠炎患者中明显增加,与宿主免疫微生物相互作用相关[18-19]。假单胞菌与人类多种感染相关,包括医院获得性肺炎[20]、尿路感染[21]、皮肤感染[22]以及眼部感染[23]等,对人类健康具有较强的潜在致病性,特别是对免疫功能低下的患者。而这2种致病菌属的相对丰度随着口腔诊室使用时间的延长,表现出不同的变化趋势,推测为物种间相互作用的结果。不同的微生物间存在着共生、拮抗等相互关系,且与生物膜的形成密切相关[24],复杂的生态关系使得诊疗环境消毒面临巨大挑战。
利益冲突声明:作者声明本文无利益冲突。
