串联质谱用于糖肽结构表征的研究进展
2022-03-16杨红艳刘广斌刘传铎
杜 蘅,杨红艳,刘广斌,刘传铎,卢 奎*
1.河南工业大学 粮油食品学院,河南 郑州 450001
2.郑州大学 化学学院,河南 郑州 450001
3.郑州工程技术学院 化工食品学院,河南 郑州 450044
糖基化是在生物体内对蛋白(多肽)分子进行的一种翻译后修饰,通常在高尔基体、内质网上进行。由于糖基化位点及糖基团的多样性,糖基团对所修饰的蛋白(多肽)分子产生了多种影响,包括对蛋白折叠的操纵、对酶水解区域的保护,以及与碳水化合物识别受体(如凝集素)的直接相互作用。由于糖基化蛋白对稳态变化具有响应性,在组学研究的基础上它也成为生物标记物研究的一个重要目标物质[1]。对动植物组织中提取的糖蛋白或其水解得到的糖肽在功能性、生物活性方面的研究也越来越深入。例如在食品原料中提取功能性物质,研究其有效的生物活性成分并分析构效关系,可应用于食品、生物医药及化妆品等多个领域,提高食品原料加工的附加值。当对大量存在的糖基化蛋白结构进行深入研究时,就意味着需要具有高灵敏度和高通量的分析工具来表征蛋白质部分和糖基团的结构特征细节。
蛋白(多肽)的糖基化涉及免疫防御、细胞与细胞的黏附、细胞识别和病原体结合,是生物体内大量存在的一种蛋白共修饰和翻译后修饰[2-3]。在生物体中聚糖对蛋白的修饰具有一定规律,最常见的连接方式是通过N-糖苷键连接到天冬酰胺上;通过O-糖苷键连接到蛋白肽骨架的丝氨酸或苏氨酸残基上形成O-聚糖结构,是不被固定肽序所约束的,所以这种方式具有多样的生物活性;蛋白侧链也有C-聚糖或S-聚糖结构的存在[4]。由于组成聚糖的单糖基团的数量、类型以及连接方式的不同导致了聚糖的多样性,且对蛋白糖基化修饰形式的多样性,造成了糖蛋白的性质多样性,例如有无位点结合的宏观异质性、聚糖结构造成的微观异质性[5]。正是由于糖蛋白(肽)的微观异质性,这些结构特征的细节影响了其生物活性。
在糖蛋白(糖肽)活性研究的过程中,结构的鉴定是至关重要的。质谱(MS)由于分析速度快、灵敏度高,是一种较适合对糖蛋白进行组学研究的成熟分析方法,典型的工作流程是将蛋白质通过胰蛋白酶消化,经碰撞诱导解离或高能碰撞解离后进行液质联用(LC-MS)分析[3, 6]。质谱也非常适合用于利用化学方法或内切糖苷酶水解所释放的聚糖序列的分析,常用的分析策略有经过基质辅助激光解离-质谱(MALDI-MS)分析[7-9],或经亲和色谱、超高效液相色谱分离后的质谱联用分析[10-11],或经由温和离子化即电喷雾离子源(ESI)得到糖蛋白(肽)的定性或半定量检测结果[12-13]。由于糖肽结构的复杂性,分离方式、电离方式以及碎裂技术对糖基和蛋白(肽)起到不同的作用,这使得上述标准操作流程并不容易实现。因此,促进了新的糖蛋白(肽)组学分析流程的研究,新的质谱碎片化策略的开发应用[5,14]。
1 串联质谱碎片化技术的概况
已被报道适用于质谱的碎片化策略繁多,包括诱导离解(碰撞诱导裂解,CID;高能诱导裂解,HCD)、电子驱动离解(电子捕获离解,ECD;电子转移离解,ETD)和各种形式的光解离(红外离解,IRPD;紫外离解,UVPD)。对于糖肽,一方面,CID/HCD优先解离糖苷键(形成B-和Y-离子,为聚糖的组成提供信息),并且根据碰撞能量还可能产生交叉环碎片(A-和X-离子,为聚糖结构提供潜在信息)[3];另一方面,电子驱动离解则优先切割肽键(例如可形成c-和z-离子,提供肽的序列信息)。由于糖基团和肽基团对不同解离方式感受性的差异,糖蛋白组学的质谱分析工作流程是使用CID、ETD轮流进行碎片化解离,然后通过LC-MS对碎片离子分析,可以得到糖肽的全部信息[15]。近年的研究是将多种碎片化方法结合使用,被称作混合碎片化法。此方法倾向于形成更多离子碎片和离子类型,通常能得到更多分析目标物的结构特征信息[16]。例如,磷蛋白组学领域常用的分析方法:先ETD再HCD(该联合法被称为电子转移高能碰撞解离,EThcD)解离得到许多简单的离子碎片[17],不仅可以提供肽序的信息,还能提供磷酸化的具体位点。在Aboufazeli等[18]的研究中,通过碰撞诱导解离,分析了一组具有相关性的高人鼻胰蛋白糖肽酸,双饱和离子和混合质子化钠外加物离子通过能量解析振动激活或解离形成双质子化离子,这种双质子化离子与双饱和混合带电离子相比,具有不同成分的双质子糖肽离子,在相对较低但较广泛的碰撞能量范围内发生碎裂,并且糖和肽的碎裂程度取决于施加的碰撞能量。这一方法也迅速地应用于糖蛋白组学。
混合碎片法包括研究组成和结构特征的能量步进法(能量步进CID和HCD)、选择离子触发顺序破碎技术(例如:CID-pd-ETD、HCD-pd-ETD)、对前体单一选择的多碎裂技术联用(例如:EThcD和电子转移/碰撞诱导解离,ETciD)[19]。
1.1 能量步进式碰撞解离
在蛋白组学研究中应用最广泛的碎片化方法是碰撞诱导解离,通常是指离子陷阱仪器的共振激发离子碰撞解离,HCD则是具有更高能量的CID,例如利用轨道型仪器进行电子碰撞解离。肽前体离子,可通过CID和HCD首先形成b-和y-离子,聚糖可形成B-和Y-离子(优先解离单糖间不稳定的糖苷键)[18]。虽然CID可以揭示释放的聚糖水平上的序列和分支信息[20],但对于糖蛋白组学,该技术主要用于提供序列信息[19,21]。由于不同的能量能将样品解离成不同类型的离子碎片,所以可将不同碰撞能应用于同一样品,得到一系列离子群,这种方法称作能量步进碰撞解离。目前这种碎片化方式有两种策略:(1)轻度破碎得到大的离子片段(B-离子),然后对其进行循环的靶向碰撞诱导解离;(2)重度破碎得到Y-离子序列(O-糖肽的Y0-离子;N-糖肽的Y1-离子)从而获得肽序。
1.2 目标离子引发碎片化策略
虽然不同的解离方法联合使用可以分别准确地得到N-糖肽和O-糖肽的信息[15, 18, 22],但是由于仪器无法适用多种解离方式,所以需要将样品破碎为接近仪器、试剂可测定的样品片段,并结合数据分析得到具体的结构信息。这就是针对得到目标离子而制定的碎片化策略。HCD可以通过测定特异的碎片离子来判断某种聚糖是否存在,这些聚糖的片段离子还会引发额外的破碎循环,通常是由ETD得到,也有文献报道使用HCD-pd-CID方法[20, 23]。近年来,基于轨道型质谱仪的普及,已经可以实现将不同的解离方式在单一仪器上应用。值得注意的是,在应用HCD-pd-CID的情况下,必须应用HCD-MS3获得关于肽骨架的足够信息[5],同时,CID可以提高对聚糖部分的确定性。这种触发方法的明显优点是最终的数据集相当简洁,只包含糖肽的常见片段,有利于对稀有和低丰度的复杂蛋白水解产物的分析。
1.3 混合碎片化策略
常见的混合策略是将电子碰撞解离(CID或HCD)与电子驱动解离(ETD或ECD)结合,发展出了电子转移碰撞解离(ETciD)。这一方法的应用,最初是为了提高碎片离子的收率,而后又发展出对ETD的前体离子进行HCD,即电子转移高能碰撞解离(EThcD)。有文献报道为了得到能进行分析物解释的、和谱图匹配的强烈信号,将电子还原的碎片与未经解离的片段同时进行碰撞活化,Acs等[24]团队又开发了通过红外光子活化离子进行的电子转移解离(AI-ETD),衍生出了紫外光子补充活化(后活化)电子转移解离(ET-UVPD)。
综上所述,混合片段化机制在糖蛋白组学领域已显示出较大的优势,在样品制备和数据解释方面也有发展。预计糖蛋白组学的未来将是对聚糖、糖肽和完整糖蛋白等不同信息量分析物的综合分析,而深度片段化技术的进一步发展对于所有这些方向都是至关重要的,并且有望在糖型结构表征和肽的序列覆盖方面取得进展。
2 串联质谱在寡糖链结构表征方面的应用
寡糖在许多生物过程中都起着重要的作用。寡糖的结构不同于肽等其他聚合物,因为有大量的连接组合和分支。这种复杂性使得对寡糖的分析与对多肽类的分析相比更加独特。质谱法为测定寡糖组成提供了一种有力的方法,串联质谱法提供了具有高灵敏度的结构信息[25]。
寡糖经历两种主要的片段化作用。糖苷键裂解发生在两个相邻的糖环之间,并提供有关序列和分支的信息。交叉环裂解涉及糖环上任何两个键的断裂,但是糖苷键裂解方式更为普遍。它们可以提供有关连接方式和分支的有效信息[26]。糖苷键裂解离子是低能方法得到的主要产物,但在高能方法中经常能观察到交叉环裂解。而且,诸如电荷载体(即H+、Na+等)、电荷状态、聚糖类型(O-连接的聚糖与N-连接的聚糖)、反应能量和离子在检测之前的寿命等因素,都可以影响寡糖片段化的程度以及糖苷与交叉环切割的比例。科研人员已经研究了交叉环裂解和糖苷键裂解的机制,但没有像肽裂解研究的那样广泛[27]。图1描述了在阳性模式下钠配位寡糖的两种裂解的最常见机理。对于糖苷键裂解(图1a),最常观察到的产物与该机理一致,产生了氧离子中间体[22]。实际上,B型离子是在正离子模式下最常观察到的碎片,但是这种机理虽然有用且与观察结果一致,但可能并不正确。
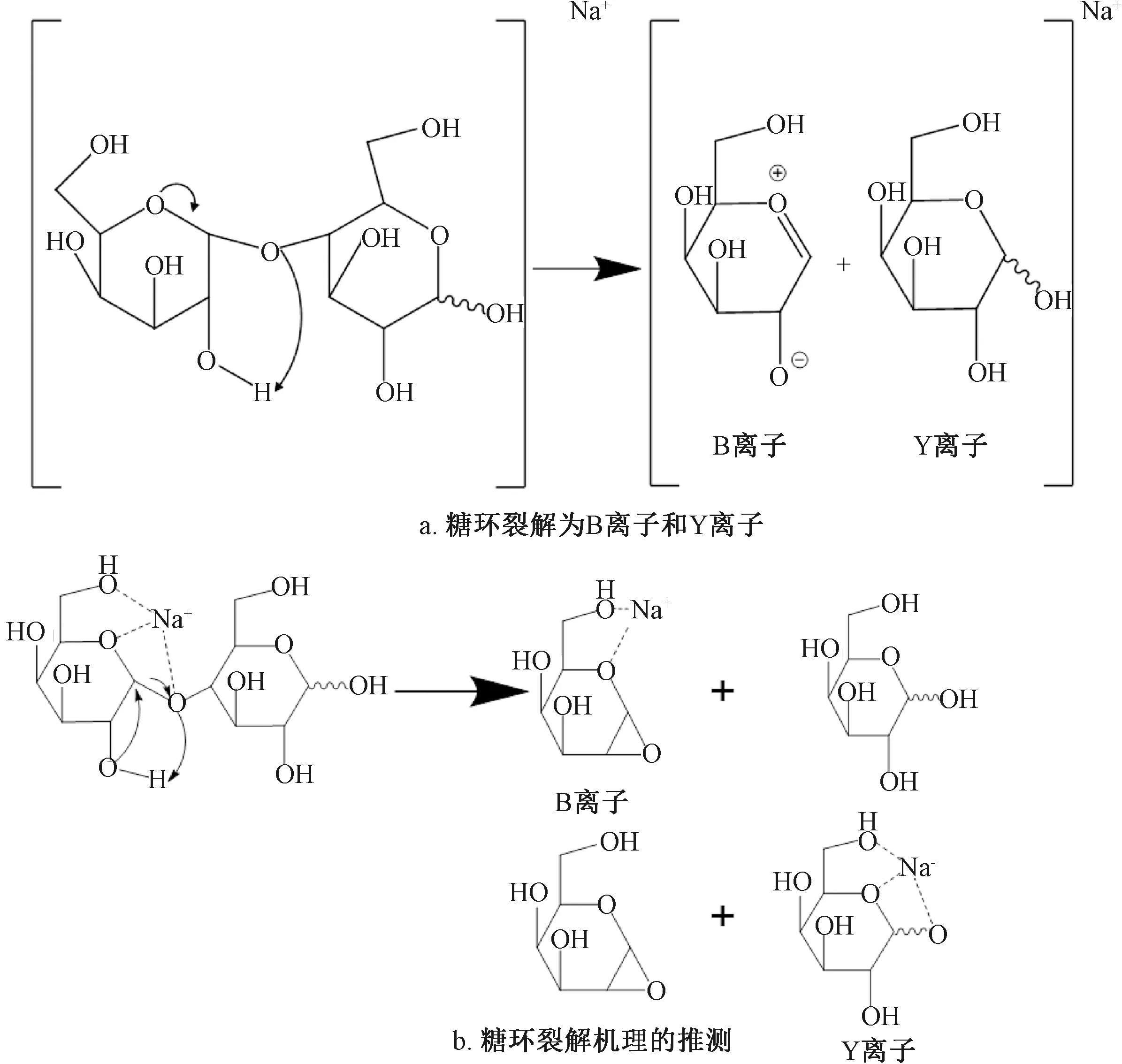
图1 糖环交叉环裂解的机理推测Fig.1 Supposed mechanism of cross ring cleavage of sugar rings
An等[25]对标记的前体进行了广泛的机理研究,表明最可行的机理如图1b所示,中间体涉及高能的环氧化物代替氧鎓离子。由于难以产生位点特异性同位素富集的糖类,因此尚未对机械方法进行广泛的研究。通常提出的方法涉及一系列逆醛醇缩合反应,以产生60、90和120单位质量的损失,其产品可用于确定连接方式。例如,仅损失60个质量单位表示存在1,4-连接,损失90个质量单位表示存在1,3-连接,损失120个质量单位表示存在1,2-连接。 60、90和120质量单位的损失表明存在1,6-连接。但交叉环断裂的发生频率不足以提供连接信息。如果末端丢失,它们似乎很少发生或根本不发生。因此,对于通常与碱性硼氢化钠一起释放的O-连接聚糖,产生还原的寡糖醛糖醇,在标准的低能CID条件下很少观察到交叉环裂解[21]。寡糖的分析是一项具有挑战性的任务,因为它们具有高度的亲水性、相似的化学结构,并且缺乏着色团和荧光团。所以除了质谱碎片峰的分析,研究人员通过液相方式进行分离研究,降低糖基团在体外的降解,利用糖基团的轻微性质差别对糖肽进行鉴定[28]。Wang等[29]对黄芪中铱糖苷和寡糖同时进行分析,虽然两种成分相近,测定的难度增加,但利用亲和色谱-超高效液相-串联二级质谱(HILIC-UHPLC-TQ-MS/MS)联用能达到相关系数在0.999 1以上的良好的线性结果,精度高、回收率好。
岩藻糖和唾液酸残基在结构上截然不同,但在CID条件下却能产生类似的不稳定特征结构。两个残基都容易解离而丢失结构信息,特别是在阳性模式下这种现象更常出现。即使在电离期间唾液酸也是非常不稳定的,尤其是在MALDI方法中[8]。除非分子的化学性质稳定,否则唾液酸结构的质量损失经常发生。当酸被酯化时,其解离特性与中性寡糖残基没有显著差异。尽管没有关于唾液酸解离的机理研究,但其裂解与酸性质子的诱导裂解一致[25]。羧酸的相对接近性促进了质子向糖苷键的迁移,将羧酸转化为酯可除去质子并稳定残留物。将唾液酸乙基化可显著减少电离过程中唾液酸的损失,并且在阳性模式下获得强唾液酸化寡糖信号[19]。
岩藻糖由于是中性寡糖,在解离中展现出更不稳定的性质。岩藻糖的片段是首先产生的离子之一,甚至在电离过程中也经常产生[26]。岩藻糖与其他中性残基的最大不同之处在于C6上的羟基丢失,这在糖类的结构鉴定中起着重要作用。这个片段作为一个内部残基上的基团,存在与否可以用作推测C6位置是否是稳定末端,是表明C6羟基与另一个羟基之间是否存在重要的相互作用[30-31]。目前并没有类似唾液酸的可以稳定寡糖中岩藻糖残基的简单方法。
3 串联质谱的自动化数据分析在糖肽结构解析中的应用
在串联质谱分析过程中,由于多种解离策略与分析检测方法的综合联用,科研人员的研究重点之一是为该方法分配详细的机制和功能。糖蛋白(肽)的组成、结构的鉴定通过高精度质谱法确定,尤其是与色谱分离结合使用时,能产生的数据量巨大,因此需要用于数据分析的高通量分析平台,尤其是复杂生物混合物的平台。
在生物有机质谱应用的早期,直接利用肽产生的碎片对蛋白质进行测序。由于碎片化方法的限制,Edman降解是更有效的蛋白质测序方法。随着电喷雾电离技术的发展,离子通过液相色谱柱到质谱变得更容易,这使得串联质谱测定肽序的灵敏度提高了一个数量级。与此同时,研究人员发现可以通过基因组学的信息来解释串联质谱数据。研究人员首先开发了用于直接解释肽串联质谱数据的软件工具[32]。这种测定肽序的方法是利用对产物离子的质量位移计算从而进行串联质谱数据的近似分析,相关软件包括PepNovo、PEAKS和Uninovo。数据库搜索方法是根据消化肽的基因组信息从串联质谱数据中计算出最可能的序列。最初,数据库搜索方法是通过从数据库(PeptideSearch)提取肽序标签,结合交互函数算法进行的自动数据库搜索(SEQUEST)。而后出现了多个数据库搜索方法:Protein Prospector、 Mascot、 X!Tandem、 OMSSA、MyriMatch、 Andromeda以及Comet。近几年出现了搜索引擎的设计,例如基于高分辨率串联质谱数据的Morpheus和MS Amanda。科研人员还研发了整合搜索引擎结果和管理搜索引擎参数的专用工具[33]。
由于糖肽同时含有肽和聚糖的结合物,需要先对样品中存在的蛋白质和聚糖进行假设。对于净化或重组的糖蛋白,通常是假设一个单一的、已知的蛋白质序列,并从血糖组学数据库中选择一个聚糖序列。然后根据这些假设,从串联质谱数据中匹配肽的序列和聚糖的组成。通常得到串联质谱数据后,通过ProteoWizard或OpenMS软件转换数据格式,用DeconTools软件进行反褶积和反同位素的质谱数据预处理,然后基于假设的肽序和已知聚糖的数据库设置匹配范围,常见的数据库有Glycome DB、Unicarb和GlyTouCan。也可以根据样品的蛋白组学和糖组学数据细化匹配范围,但并不能保证匹配的准确性。肽的质量由串联质谱数据得到,评价参数为假阳性率(FPR),肽序由碎片化的肽骨架信息得到,评价参数为错误发现率(FDR),评价参数可以通过一种被称为目标诱导的置换检验方法(TDA)来计算[34]。最后通过计算获得聚糖位点及组成的信息,相关软件有:GlycoMod、GlycoX、Glyco、peakfinder、GlycoPep DB、GlycoMiner和GlycoSpectrumScan[35]。
不同的软件适用于不同的串联质谱方法。Sweet substitute适用于分析理论去容、去同位素的碰撞解离糖肽QTOF型串联质谱数据;GlycoPeptideSearch适用于碰撞解离串联质谱数据匹配糖肽结构;GlycoPep detector适用于电子转移解离串联质谱数据推测糖肽结构;GlyDB可用来分析低分辨率CID串联质谱数据;GlycoFragwork利用TDA的方法用碰撞解离数据确定聚糖结构,用电子转移解离的数据确定肽序列;Sweet-Heart可以用来分析低分辨率和低质量精度的离子阱串联质谱;GP Finder可以用来确定非特异性蛋白酶水解产生的糖肽的去容、去同位素的碰撞解离串联质谱的数据;MAGIC算法用来进行糖肽的碰撞解离片段串联QTOF质谱的数据计算分析。还有一些辅助计算软件也是非常必要的数据分析工具[36]。LaCy工具可以处理多个电荷状态,给出每个电荷状态的输出,并提供了各种分析物和光谱质量标准[37]。Medicel N-glycopeptide library可以根据输入的糖肽串联质谱数据确定复杂的生物混合物是否有目标糖肽;GlyPID是根据反相LC-MS得到的单糖单元的一系列质量迁移的数据对糖肽进行归类;GlycoPep grader通过目标糖肽序列和一系列的聚糖组成来计算理论糖肽组成;Peptoonist使用蛋白质组学数据库引擎匹配未修饰的水解肽,然后通过拟合稳定的同位素簇以及串联质谱数据来匹配糖肽;GlycoPep Evaluator用来计算诱导糖肽的组成来计算错误发现率(FDR);SweetSEQer用来依次动态构建糖肽的肽骨架序列以及聚糖的有向子图;GlycoMasterDB用来搜索蛋白质序列数据库和聚糖数据库,以确定与碰撞或活化电子离子或混合解离模式解离产生的离子碎片质谱数据最匹配的肽-聚糖对[38]。GlycoPAT数据平台可用于MSn数据分析的糖肽的最小线性表示。这种格式允许肽主链和PTM在一个或多个位置进行序列断裂;它是一种基于“集合分数”计算的新评分方案,这是一种使用交叉相关和基于概率分析的方法对N和S/M链糖苷的S/M谱进行评分和排序的方法;也可以作为一种错误发现率(FDR)计算方案,通过扰动原糖质量引入人工单糖来诱导诱饵糖肽[39]。最新报道的DecoyDeveloper[40]、GlycopeptideGraphMS[41]、GPSeeker[42]、Glyco-DIA[43]、GproDIA[44]、Glyco-SISPROT[23]、DIANA[45]、pGlyco[46]、pGlyco2.0[47]、GlycReSoft[48]的数据库软件都是应用于计算、匹配与串联质谱数据聚糖、糖肽的生物学数据。更多的数据库应用可以使糖肽结构信息更完善,数据更准确。
结合数据库匹配,虽然可以使被分析的糖肽的结构信息更准确,但精确的质量测定也不足以确定糖肽结构。这种限制源于糖基化是一种在内质网和高尔基体中发生的非模板驱动的生物合成过程,导致了其产物化学形式的多样性[49]。这种复杂性应当将肽的其他常见修饰,包括氧化、脱酰胺、脱水和部分蛋白水解消化等列入考虑。因此,应用软件进行数据分析匹配时要注意:一方面,精确的质量测量不能充分测定糖肽组成;另一方面,大量的分子形式差异为糖肽的串联质谱数据提供了很多解释的可能。同时还要保证测定样品的纯度,如果混入污染蛋白,则更需要分析其对数据的影响。由于是推测结果,还要进行数据准确性的评价。
4 串联质谱应用于食源性糖肽结构鉴定的现况与展望
串联质谱分析法测定、完善糖肽结构在食品工业中可以应用在食品来源的活性物质结构分析,形成相关种类的生物活性物质的组学分析,建立食品来源糖肽的数据库,以便发现、对比验证相似生物活性的安全成分,经由相似的结构信息,推断构效作用;也可以应用在对生物体内生理过程代谢产物的组学分析,在糖肽类产品的生物制备中作为高效、灵敏、准确率高的筛查、测定方法。Liu 等[27]的课题组就我国传统的中药保健饮品——养肺活血汤进行了研究,利用UPLC/QTOF/MSE进行了活性成分的鉴定,其有效成分可达55种,在此基础上,研究人员对数据进行分析,建立数据库,总结计算得到多组分TCM公式,期望由此能更好地制订具有保健作用的中药饮品的质量评价体系及成分归类,便于更深入地对各种活性成分作用机制、基因靶点及构效关系进行研究。
食品工业越来越多地与生物工程相结合,更多的动物来源酶应用于食品工业生产当中并起到了重要的作用。酶的运用开始于经验的总结,但科研人员们发现酶在不同环境条件下可能进行多种反应的催化,这种现象有可能是生产过程中所期望的,也有可能是需要避免的。这跟生产环境有关,也与酶和底物特异结合的构效有关,所以利用串联质谱解析生物酶活性也是酶应用开发的重要工作之一。Yin等[50]的团队在抗胰蛋白酶的糖基化研究中将串联质谱用于筛选复杂的糖基化位点。Pont等[51]团队采用多酶消化方法实现如胰蛋白酶、内蛋白酶Glu-C和非特异性酶Pronase酶等特定酶的分离提纯,然后使用无鞘CE-MS/MS进行分析,共鉴定了893种不同的N-糖肽,其中有128种独特的N-糖肽组成。
食品安全问题被广泛关注,也是食品领域研究人员工作的重点。食品行业进入高效的工业化生产,随之出现的食品安全问题也是不可回避的,如生鲜食品中抗菌素含量超标。国外研究人员将液相与串联质谱连用,检测血清中的糖肽类抗生素成分[52-54],应用该方法,研究人员发展出利用液相色谱或超高压液相质谱与串联质谱联用的形式检测牛奶、鱼类、禽畜等制品中糖肽类抗生素[55-56]。Deng[57]的团队通过溶剂提取目标糖肽抗生素,采用混合强阳离子交换和亲水性/亲脂平衡盒,采用串联固相提取步骤清洗提取物、溶脱,然后用UHPLC-M正电离模式下的S/M通过多反应监测进行定量,测得5种糖肽抗生素在1.0~20.0 g/L质量浓度范围内为1.0 g,线性相关系数>0.998,具有良好的线性相关性。一些食品来源的糖肽具有一定毒性,在毒理学的范畴内,研究人员开展了一系列工作试图解析其结构并归类整理这些食品来源的有毒物质,为避免误食误用或在生产加工过程中产生新的有毒有害物质,这项工作中,液相色谱/串联质谱法(C/MS/M)是一种有效、高灵敏度的检测手段[58]。同时,富集策略的选择对试验结果有深远的影响,因此回顾了基于现代质谱(MS)的糖蛋白组学实验中常用的富集策略,包括凝集素和其他亲和色谱、亲水性相互作用色谱(HILIC)及其衍生物、多孔石墨碳(PGC)、可逆和不可逆化学耦合策略,以及经常利用生物正交处理的化学生物学工具。随着MS仪器和软件的改进,研究人员需要选择适当的补充策略,才能更准确地进行样品中不确定物质的测定[59-60]。
本文重点总结了串联质谱及与其他制备、富集、分离等仪器方法联用,应用于完整糖肽的质谱解析技术,从质谱技术的碎片化方式、质量分析器、碎裂方式,以及糖蛋白(肽)数据库建立、应用等方面对近年来的串联质谱技术进行综述。由于生物来源糖肽结构的复杂性,其结构分析一直以来都是科研人员研究的重点,近年来随着食品领域研究的深入,对食品中提取的糖肽结构鉴定、解析越来越被研究人员所重视,用来探究其活性及作用机理。所以,串联质谱技术在糖肽研究领域取得了较大的突破,技术被不断优化。糖肽数据库的建立,也是在其谱图解析和数据分析中成为不可或缺的一环,虽然结构准确性还需要大量的样本采集、统计从而建立食源性糖蛋白(肽)的数据库,才能在高通量、高灵敏、高准确度的前提下,对具有不均一性的该类物质进行匹配。综上所述,随着质谱技术的不断创新和改进,结合前期的样品制备、富集手段及后期数据分析软件、数据库的开发建立,正在逐步形成一体化、规模化的糖蛋白(肽)结构解析通路,使得串联质谱的检测在食品工业中有广泛的应用并提供强大的支持。
