磁共振弹性成像评估非酒精性脂肪性肝病肝纤维化程度
2022-03-16任浩徐辉杨大为王晓培佟小非赵新颜杨正汉
任浩,徐辉,杨大为,王晓培,佟小非,赵新颜,杨正汉*
1.首都医科大学附属北京友谊医院放射科,北京 100050;2.首都医科大学附属北京友医院肝病中心,北京 100050;*通信作者 杨正汉 yangzhenghan@vip.163.com
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是目前全球最常见的慢性肝病[1],在我国成年人中患病率为29%,且发病率不断升高[2-3]。NAFLD的病理表现主要为脂肪变性、炎症和纤维化,其中脂肪变性和非酒精性脂肪性肝炎活动度积分(non-alcoholic steatohepatitis activity score,NAS)与总体疾病的特异死亡率无相关性,但随着纤维化分期增加,肝相关死亡的风险呈指数增加[4]。由于NAFLD在早期纤维化时可经治疗后逆转,因此NAFLD纤维化的量化十分重要[5]。
临床中通常采用肝脏穿刺活检诊断肝纤维化,但穿刺活检为局部采样,具有抽样误差,且为侵入性检查,存在潜在风险,不同医师的病理评分具有差异性,使其在随访应用中受限[6-7]。随着磁共振弹性成像(magnetic resonance elastography,MRE)新技术的出现,在影像学上可以量化肝纤维化引起的肝脏硬度改变,因此可以用于无创评估NAFLD的纤维化程度。本研究以病理检查为“金标准”,评估2D-MRE弹力值对肝纤维化的诊断效能。
1 资料与方法
1.1 研究对象 回顾性纳入2016年11月—2020年11月首都医科大学附属北京友谊医院临床诊断为NAFLD并行MRE检查的72例患者。排除标准:①MRE参数不符合要求或图像质量欠佳;②NAS病理评分缺失;③肝脏局灶性病变(>3 cm)。本研究通过本院伦理委员会批准(批号:2020-P2-235-01),免除患者知情同意书。
1.2 影像学检查 所有患者均在3.0T MR(GE Discovery 750W)完成扫描,采用二维自旋回波-回波平面成像MRE序列,扫描参数:TR/TE 1 000 ms/min full,矩阵64×64,视野42 cm×42 cm,层厚10 mm,层间距5 mm,层数7,激励次数1,带宽±250 Hz,驱动器频率60 Hz,幅度70%。主动驱动器(美国Resoundant公司)放置在扫描室外的MR设备间。
1.3 图像分析 所有图像经由MR主控计算机的后处理软件Volume Viewer 13.0自动处理波形信息,使用反演算法生成波形图像、弹力图和幅度图像,并在弹性图形成交叉线区域(后处理算法排除的低置信度数据区域)。由1位接受MRE图像后处理培训的放射科住院医师采用盲法勾画感兴趣区(ROI),尽量避开肝左叶区域,并在肝脏右叶区域勾画ROI。ROI选择在邻近门静脉右支水平肝脏层面,并尽可能多地包括肝实质,其最小面积>3 cm2,同时避开大血管、胆管及肝脏周围1 cm以内的区域和交叉影线区域(低置信度数据区域),随后将ROI复制到弹力图上测量肝脏弹力值。同一名放射科住院医师测量2次,2次测量间隔3周以上,取2次测量数据的平均值进行分析。
1.4 病理学检查 所有患者均在超声引导下进行肝活检,每例患者在右肝叶取一条长度>15 mm的肝脏组织。所有病理组织标本均采用HE染色和Masson三色染色。所有病理结果均由1名具有10年以上经验的肝病医师进行判读,该医师了解每位患者的临床资料,但不知道影像测量结果。
1.5 肝脏纤维化分期 由于NAFLD肝小叶纤维化出现部位与病毒性肝纤维化有一定的区别,因此采用NAS评分系统[8](分为0~4期)评估肝脏纤维化:F0为无纤维化,F1为小叶中心或汇管区纤维化,F2为小叶中心和汇管区纤维化,F3为桥接纤维化,F4为肝硬化。因NAS纤维化METAVIR和NAS均为肝纤维化半定量系统评分,在反映纤维化严重程度分组上基本相似,因此采用中国肝纤维化诊断和治疗共识[9]进行分组:F0为无纤维化组,F≥1为轻度纤维化组,F≥2为显著纤维化组,F≥3为进展期纤维化组,F4为肝硬化组,本研究中F1~F4统称为肝纤维化组。
1.6 统计学方法 采用SPSS 25.0和MedCalc 19.0软件进行分析。用Shapiro-Wilk对数据进行正态性检验,符合正态分布的计量资料以±s表示。MRE参数在不同纤维化分组间(F0~F4单类分组及二分类分组)差异比较时,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。在二分类分组中,纤维化组、显著纤维化组、进展期纤维化组和肝硬化组定义为阳性结果。MRE弹力值与病理纤维化分期的相关性采用Spearman相关分析。采用受试者工作特征(ROC)曲线检验MRE弹力值的诊断效能。截断值为探索性,通过计算最大约登指数确定。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 72例NAFLD患者中,男23例,女49例,平均年龄(51±13)岁;F0期11例,F1期18例,F2期12例,F3期15例,F4期16例。
2.2 不同纤维化分期肝脏MRE弹力值的差异和相关性肝纤维化F0~F4分期的MRE弹力图见图1。F0~F4组的肝MRE弹力值分别为(2.28±0.28)kPa、(2.77±0.66)kPa、(3.32±0.68)kPa、(4.93±1.59)kPa、(6.84±2.49)kPa,F0~F4组MRE弹力值差异均有统计学意义(F=24.296,P<0.001)。肝脏MRE弹力值在有无纤维化组、有无显著纤维化组、有无进展期纤维化组、有无肝硬化组间差异均有统计学意义(P均<0.001),见表1。肝脏MRE弹力值与病理纤维化分期呈正相关(r=0.812,P<0.001)。
表1 不同纤维化分组的MRE 弹力值比较(kPa,±s)
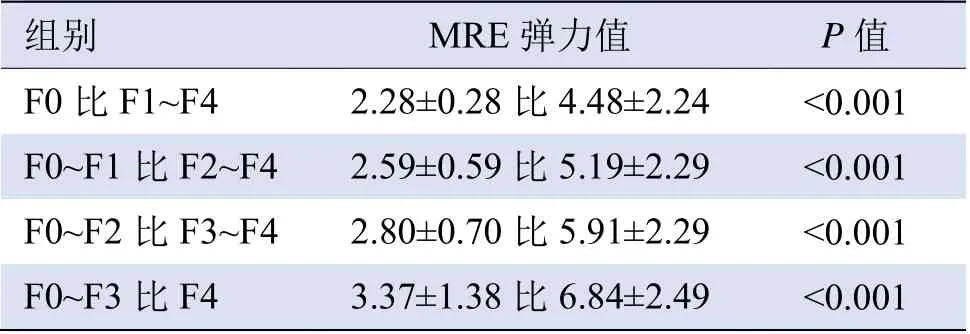
表1 不同纤维化分组的MRE 弹力值比较(kPa,±s)
组别MRE 弹力值P 值F0 比F1~F4 2.28±0.28 比4.48±2.24 <0.001<0.001 F0~F2 比F3~F42.80±0.70 比5.91±2.29 <0.001 F0~F1 比F2~F4 2.59±0.59 比5.19±2.29 F0~F3 比F4 3.37±1.38 比6.84±2.49<0.001
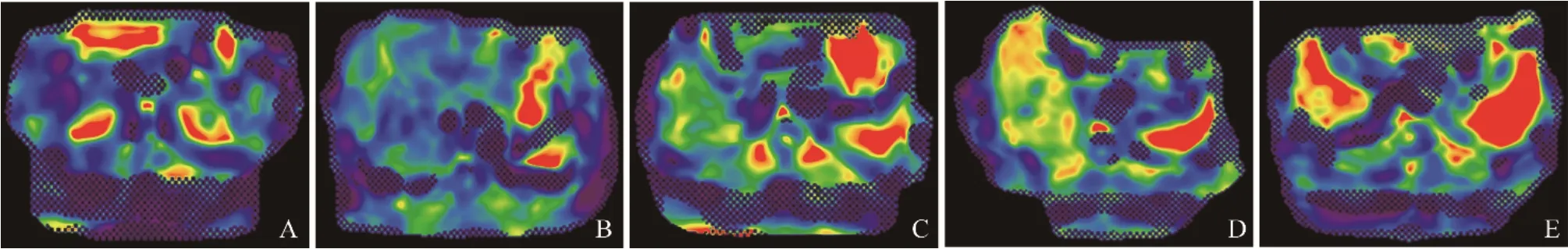
图1 肝纤维化F0~F4的MRE弹力图。A~E分别为肝纤维化F0期、F1期、F2期、F3期、F4期,MRE弹力值分别为2.22 kPa、2.94 kPa、3.31 kPa、4.63 kPa、6.51 kPa
2.3 MRE弹力值对不同纤维化分期的诊断效能MRE弹力值诊断肝纤维化组(F≥1)、显著肝纤维组(F≥2)、进展期肝纤维化组(F≥3)及肝硬化组(F4)的AUC分别为0.903、0.914、0.937和0.898,其阈值分别为2.80 kPa、2.93 kPa、3.51 kPa和4.80 kPa。不同纤维化分组的MRE弹力值诊断模型的AUC、最佳阈值、敏感度和特异度见表2及图2。

表2 不同纤维化分组的MRE弹力值诊断模型相应参数

图2 MRE弹力值诊断不同纤维化分期的ROC曲线。A~D分别为诊断有无肝纤维化、显著肝纤维化、进展期肝纤维化及肝硬化
3 讨论
NAFLD通常发生脂肪性肝炎,进而激活肝脏星形细胞,从而造成细胞外基质异常沉积与分布,外基质聚集导致小叶中心和汇管区纤维化形成,最终进行性纤维化导致肝硬化和肝癌[10]。这一病理变化会影响肝组织的力学性能,使之区别于生理状态下的肝组织。MRE采用磁共振相位成像技术,利用机械波在不同弹力介质中的传导波长不同,可以将体内组织在剪切波作用下产生的质点位移通过反演算法计算肝脏组织的定量弹力图,因此MRE技术可以直接反映肝纤维化程度。本研究证实肝弹力值和病理肝纤维化分期具有强相关性,而且MRE弹力值可以有效地区分纤维化的不同分期。
3.1 不同研究MRE弹力值的差异 Loomba等[11]报道2D-MRE弹力值诊断肝纤维化、显著肝纤维、进展期肝纤维化及肝硬化的效能均较高,AUC分别为0.838、0.856、0.924和0.894。本研究不同纤维化分期的MRE弹力值诊断效能均高于该研究,而且诊断阈值也有一定的差别。Morisaka等[12]采用1.5T和3.0T场强的MRE技术对肝纤维化患者进行无创评估,诊断阈值与本研究存在显著差异,而且其诊断效能低于本研究。既往研究中,MRE弹力值诊断早期肝纤维化时,阈值为2.5~4.9 kPa[13],数值并不固定。因此,临床应用肝MRE弹力值诊断肝纤维化时,并无确定的阈值可以参考,其原因可能为:①MRE技术不同,如平面回波成像(echo planner imaging,EPI)和梯度回波采集技术或2D-MRE和3D-MRE采集技术,其中2D-MRE和3DMRE技术测得的弹力值具有显著差异[14];②MRE所用的被动驱动器不同,柔性或刚性MRE被动驱动器也可能会产生肝脏弹力值的差异;③医师测量肝脏MRE时所采用的ROI也不尽相同,有的采用单个或多个ROI以及全肝的ROI[15];④不同屏气状态也会影响MRE弹力值[16];⑤MRE弹力值受肝脏血流动力学因素的影响[17]。综合上述多种因素,MRE诊断早期纤维化时并无确切的固定阈值,因此临床上MRE弹力值阈值标准难以统一。
3.2 MRE技术诊断效能探讨及未来展望 本研究较Loomba等[11]研究的优势是采用自旋回波平面成像(spin-echo echo-planar imaging,SE-EPI)的MRE技术,SE-EPI的MRE较梯度回波采集成功率更高、采集时间更快,从而减少采集中的呼吸误差,因此可能提高诊断准确度。与Morisaka等[12]的研究相比,本研究采用单一病因的肝纤维化患者及单一3.0T场强下的MRE扫描,可能是造成不同阈值差异的主要原因。本研究使用统一病种、设备、序列参数以及呼气末屏气方式采集获得的MRE弹力值,与上述两项研究相比具有更高的诊断效能,也印证了不同参数及条件对MRE弹力值阈值的影响较大。因此,在未来的研究中需要建立统一规范,才能获得稳定的参考阈值。此外,也有很多关于肝纤维化无创评估的影像技术,如扩散加权成像和超声弹性成像技术等[18-19],既往有研究对两者进行比较,发现MRE技术在肝纤维化无创评估中的可重复性及诊断效能均高于这两种技术,因此在国际肝病指南中将MRE弹力值作为临床的重要参考标准之一[20]。总之,MRE技术对NAFLD肝纤维化的无创评估具有良好的诊断效能,但也存在相应的不足。随着MRE专家共识的建立[21],有望实现MRE技术规范,从而获得更广的临床适用性。
3.3 本研究的局限性 首先,本研究为回顾性研究,可能存在选择偏差,导致不同纤维化阶段患者数量不均衡;其次,本研究中肝脏病理为局部穿刺获得,而MRE的ROI为肝右叶区域,NAFLD作为弥漫性病变存在病变分布不均匀,对照评估可能存在一定偏倚。
总之,NAFLD纤维化是一个动态过程,稳定简便的无创评估技术有助于临床对NAFLD进行评估和治疗。MRE弹力值对NAFLD肝纤维化分期具有良好的诊断效能,其用于评估NAFLD肝纤维化,可以使部分患者免于肝组织活检,尤其是有肝穿刺禁忌证患者。随着3D-MRE新技术的出现,可以获得更多肝纤维化定量参数,有望进一步提高MRE对NAFLD肝纤维化的诊断准确性,值得进一步探索。
