腰椎间盘退变患者髓核组织中半胱氨酸天冬氨酸蛋白酶-1、白细胞介素-1β表达及相关性研究
2022-03-16王岩松刘丹平
冯 昊,王岩松,刘丹平
(锦州医科大学附属第一医院,辽宁 锦州 121001)
腰椎间盘退变(Lumbar disk degeneration,LDD)是常见的肌肉骨骼退行性疾病之一,可导致骨不稳定,神经元件受压,椎管尺寸减小,可能导致下腰痛和单侧或双侧小腿疼痛[1-2]。LDD患者中70%~85%终身出现腰痛,生活质量受到严重影响[3]。流行病学研究[4]指出,大约40%的30岁以下和90%的55岁以上的人存在LDD。随着社会的老龄化发展,LDD发病率不断上升,LDD逐步成为主要的社会健康问题。目前LDD的具体原因和发病机制研究已有很大进展,但尚未完全阐明。研究[5]指出,LDD是一个复杂的多因素过程,其机制包括组织纤维化、炎症反应、椎间盘营养不良、细胞外基质变化、自然衰老和累积损伤等。目前已知,LDD患者椎间盘组织中的炎症分子水平升高,并已被证明与退变程度有关。椎间盘组织由髓核、纤维环和终板软骨构成,其中髓核组织退变在LDD病理过程中扮演重要角色[6]。成年人椎间盘髓核主要由胞外基质及软骨样髓核细胞构成[7]。在髓核组织中,髓核细胞参与调控细胞外机制的合成/降解平衡。研究[8]显示炎症因子过度表达能够促进髓核细胞凋亡,从而抑制细胞外基质合成,最终促进LDD疾病进程。白细胞介素-1β(Interleukin-1β,IL-1β)是炎症反应中的关键细胞因子,在LDD病理过程中扮演重要角色[9-10]。有研究[11]指出,退化椎间盘组织中IL-1β表达水平与正常椎间盘组织相比明显升高,其表达与椎间盘退变程度呈正相关。此外,IL-1β能够通过促进具有降解细胞外基质的酶表达上升而导致椎间盘退化;IL-1β还参与LDD过程中疼痛的发展。Kawaguchi等[12]研究指出,IL-1β T等位基因携带者患有LDD的风险显著上升。IL-1β首先作为非活性前体合成IL-1β前体(pro-IL-1β),需要由半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)裂解其氨基末端区域以改变成活性形式。虽然已知IL-1β参与了LDD的发病机制,但Caspase-1在这一过程中的作用仍然未知。因此,本研究探讨在LDD患者髓核组织Caspase-1、IL-1β表达水平变化,并分析其与LDD疾病严重程度的相关性。
1 资料与方法
1.1 一般资料 选取2018年6月至2020年12月在我院就诊的LDD患者45例为观察组,均经MRI诊断为LDD,并因腰痛接受了脊柱融合手术或椎间盘置换手术。另选取同期因脊柱创伤导致非退行性椎间盘病变并需要手术干预的患者43例为对照组。排除标准:患有坐骨神经痛、退行性椎管狭窄、肿瘤、感染,既往有腰部手术史。观察组男性26例,女性19例;年龄39~64岁,中位年龄42岁;体重指数(22.14±4.18)kg/m2。对照组男性27例,女性15例;年龄29~63岁,中位年龄41岁;体重指数(23.26±4.12)kg/m2。两组患者一般资料比较,差异无统计学意义(均P>0.05)。根据Pfirrmann分级系统[13],观察组又分为轻度病变组(10例)、中度病变组(16例)和重度病变组(14例)。所有患者已签署知情同意书。
1.2 研究方法
1.2.1 实时荧光定量PCR(RT-qPCR)检测Caspase-1、IL-1β mRNA表达:使用TRIzol试剂(批号:15596026,赛默飞世尔科技公司)提取LDD患者髓核组织中总RNA。使用分光光度计在260/280 nm处对mRNA进行定量。根据制造商协议,使用Prime Script RT reagent Kit with gDNA Eraser试剂盒(批号:RR047QT,Takara Bio Inc公司)将1 μg RNA反转录成cDNA。在含有2 μl cDNA(500 ng/μl)、0.8 μl正向引物(10 μmol/L)、0.8 μl反向引物(10 μmol/L)、10 μl 2× SYBR Premix Ex Taq Ⅱ的反应混合物中进行qPCR反应。热循环条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环。Caspase-1、IL-1β mRNA表达水平用2-ΔΔCT方法进行量化。以GAPDH为内参。各基因引物序列见表1。
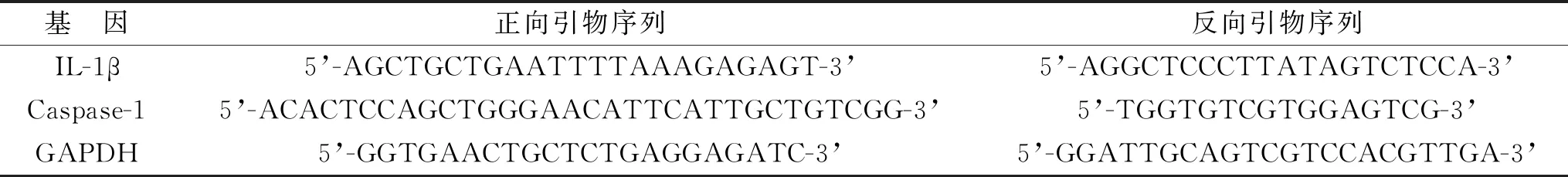
表1 各基因引物序列
1.2.2 Western blot检测Caspase-1、IL-1β蛋白表达:制备蛋白样品后置于-70 ℃保存备用。变性后用10% SDS-PAGE凝胶电泳分离蛋白,湿转法将蛋白转移到PVDF膜上。5%脱脂奶粉封闭2 h后,用三羟甲基氨基甲烷缓冲液(TBST)洗涤3次,一抗(Caspass-1一抗批号:E-AB-18207,武汉伊莱瑞特生物科技股份有限公司; IL-1β一抗批号:AP8531C,美国ABGENT公司)孵育4 ℃过夜。TBST洗涤3次后,二抗室温孵育1 h。TBST 洗涤4次后,使用超敏ECL化学发光试剂盒处理PVDF膜,之后将PVDF膜快速放入X线片暗盒曝光。曝光好的X线片放于显影液,黑暗环境显影,定影。底片扫描,用Image J软件对条带进行定量分析,以目的条带和GAPDH条带积分吸光度比值作为最终结果。
1.2.3 免疫组化法检测Caspase-1、IL-1β蛋白表达:髓核组织切片在含有5%山羊血清和0.25% Triton X-100的PBS中进行阻断。通过在0.6%的过氧化氢中孵化来减弱内源性过氧化物。使用相同的缓冲液,然后将切片在室温下与一抗孵育过夜。在室温下用相应生物素化的山羊二抗(1∶500)孵化2 h。使用DAB辣根过氧化物酶显色试剂盒进行染色。上述每个步骤之后,在TBS-0.25% Triton X-100中漂洗4次,每次5 min。使用显微成像系统镜检,拍照观察并进行分析。
1.2.4 HE染色和病理学评分(HDS):应用4%多聚甲醛将椎间盘组织进行固定,随后应用冰冻切片法进行切片,制备厚度为5 μm的冰冻切片。应用常规HE染色方法进行染色,使用显微成像系统镜检,拍照观察并进行分析。应用HDS[14]方法对椎间盘组织的病理损伤程度进行组织学评分。
1.3 观察指标 比较各组患者髓核组织HE染色结果;比较各组患者髓核组织Caspase-1、IL-1β mRNA及蛋白表达水平;分析Caspase-1、IL-1β mRNA表达水平与Pfirrmann分级、HDS组织学评分的相关性,以及Caspase-1与IL-1β mRNA表达水平间的相关性;分析LDD患者疾病严重程度的影响因素。
1.4 统计学方法 采用SPSS 21.0统计学软件进行分析。组间计量资料比较采用方差分析或LSD-t检验。相关性分析采用Spearman法。LDD患者疾病严重程度的影响因素采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组患者髓核组织HE染色结果 见图1。对照组髓核组织整体结构较疏松,基质成分基本完整,细胞外基质中可见较多髓核细胞分布,呈圆形或扁卵圆形,胞核较大,有“核团聚”现象。观察组髓核组织密集皱缩,基质成分不完整,可见少量髓核细胞分布于细胞外基质,呈不规则形状,轮廓模糊,结构不完整,有新生血管长入,髓核细胞密度较对照组明显降低,髓核细胞减少与病变程度呈正比。

A:对照组;B:轻度病变组;C:中度病变组;D:重度病变组
2.2 各组患者髓核组织Caspase-1、IL-1β mRNA及蛋白表达水平比较 见图2、3。与对照组相比,观察组Caspase-1、IL-1β mRNA及蛋白表达水平均显著上升(均P<0.05);在观察组中,随着疾病程度逐渐加重,Caspase-1、IL-1β mRNA及蛋白表达水平均逐渐上升(均P<0.05)。免疫组化结果显示,Caspase-1、IL-1β蛋白主要分布于细胞质中,表达水平及趋势同Western blot结果。

注:与对照组比较,*P<0.05;与轻度病变组比较,#P<0.05;与中度病变组比较,△P<0.05
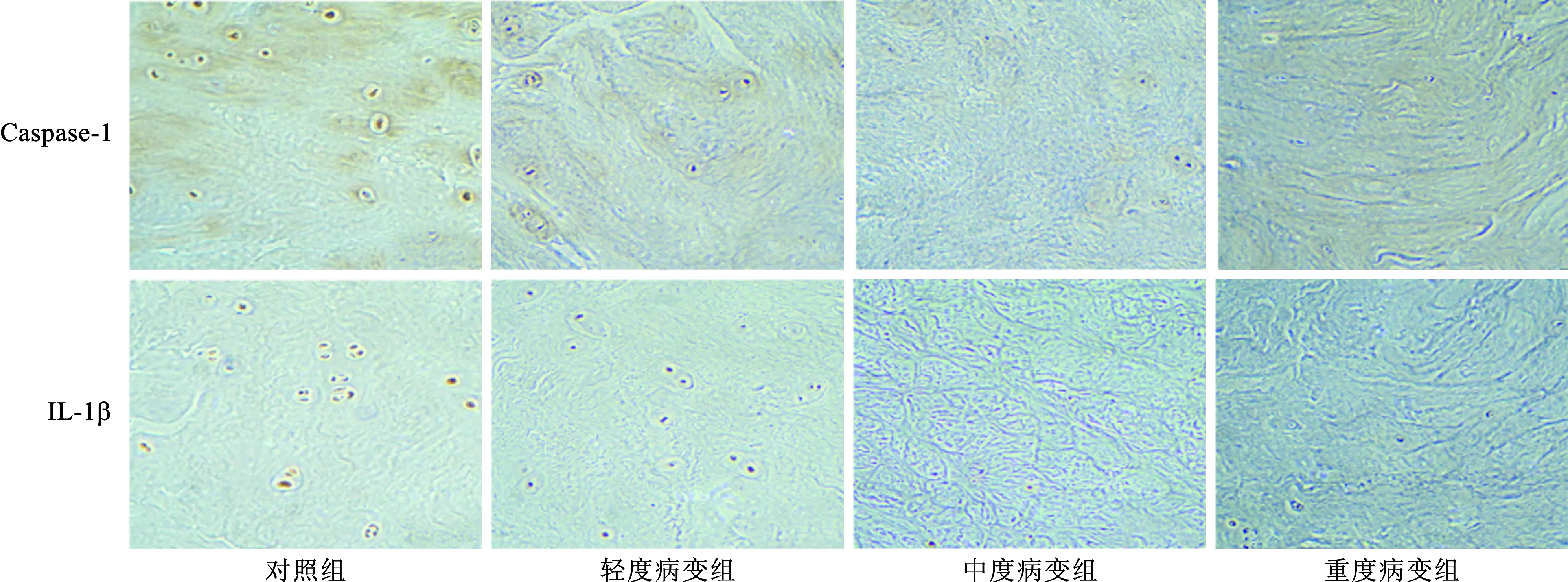
图3 各组患者髓核组织Caspase-1、IL-1β蛋白免疫组化染色结果(×100)
2.3 髓核组织中Caspase-1、IL-1β mRNA表达含量与Pfirrmann分级相关性分析 见图4。Spearman相关性分析表明,Caspase-1、IL-1β mRNA表达水平与Pfirrmann分级呈正相关关系(r=0.5386、0.6656,均P<0.05),与HDS评分呈正相关关系(r=0.5585、0.4899,均P<0.05);此外,Caspase-1与IL-1β mRNA表达水平间亦呈正相关关系(r=0.4441,P<0.05)。

图4 LDD患者髓核组织Caspase-1、IL-1β mRNA表达水平与Pfirrmann分级、HDS评分相关性分析
2.4 LDD患者疾病严重程度影响因素分析 见表2。Logistic回归分析显示,髓核组织中Caspase-1、IL-1β mRNA表达水平与LDD患者疾病严重程度具有相关性,是LDD患者疾病严重程度的影响因素。

表2 LDD患者疾病严重程度影响因素分析
3 讨 论
本研究结果显示,在LDD患者髓核组织中,Caspase-1、IL-1β mRNA及蛋白表达水平显著上升,且LDD患者髓核组织Caspase-1、IL-1β表达水平的上升与LDD患者疾病严重程度显著相关。这一发现为髓核组织中Caspase-1/IL-1β途径的激活在LDD疾病进展中扮演的促疾病发展角色提供了证据。
椎间盘组织力学特征的变化由椎间盘髓核组织的弹性与张力决定。成年人椎间盘髓核内主要由胞外基质以及软骨样髓核细胞构成。髓核组织力学特征的退变与髓核组织的细胞外基质降解的增多存在因果关系[15]。在LDD中,髓核组织中出现普遍的细胞外基质降解,而基质金属蛋白酶(MMP)家族表达水平和活性的显著增多在细胞外基质降解中扮演着重要角色[16]。与本研究结果一致,目前研究认为IL-1β在LDD患者的疾病进程中扮演着重要的角色,IL-1β与MMP家族表达水平和活性以及基质基因的表达具有显著的相关性。例如,Xu等[17]研究指出,在腰椎小关节退变中,IL-1β能够显著促进MMP-1的过表达;Le-Maitre等[18]研究指出,应用IL-1β处理人类椎间盘细胞能够导致基质降解酶MMP-3、MMP-13、含Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶-4(ADAMTS-4)基因表达水平显著增加,而基质基因聚蛋白多糖、胶原蛋白Ⅱ、胶原蛋白Ⅰ和SOX6的表达减少。此外,研究[19]指出,在人关节软骨细胞中,IL-1β还能诱导MMP-7的表达。本研究表明,在LDD患者髓核组织中,IL-1β表达水平较对照组显著上升,事实上由于对照组患者并不是健康人群,他们是经历过严重创伤的患者,这可能影响了我们观察到的IL-1β表达水平,在真实状态下IL-1β的表达水平差异可能会更大。
促炎症刺激诱导非活性IL-1β原形的表达,但其活性、成熟和分泌受炎症体和Caspase-1的控制。Caspase-1介导了炎症的信号通路,促进促炎症因子IL-1β的活性形式表达增多。此外,还有研究[20]表明,在多种细胞系中,Caspase-1能够促进IL-1β的表达,而敲低Caspase-1的表达能够在mRNA水平抑制IL-1β的表达。Caspase-1不仅能在蛋白水平调控IL-1β的活性,还能够在mRNA水平调控IL-1β的表达。本研究中,Spearman相关性分析发现,Caspase-1、IL-1β mRNA表达水平与Pfirrmann分级、HDS评分呈正相关关系,Caspase-1与IL-1β mRNA表达水平间亦呈正相关关系。研究[21]表明,Caspase-1是一个与骨关节炎有密切联系的危险因素,并加速了关节软骨的破坏。此外,Tang等[22]研究指出,NOD样受体家族3(NLRP3)/Caspase-1/IL-1β轴能够显著促进腰椎软骨终板的退变,而后者可导致营养供应减少、氧张力降低和乳酸累积,从而加速退变过程。然而,促进软骨终板退变的IL-1β源自何处目前尚不知晓。本研究中,在LDD患者的早期髓核组织中IL-1β表达水平即发生显著增加,因此促进软骨终板退变的IL-1β可能源自髓核组织,这一点仍待进一步的验证。
综上所述,LDD患者髓核组织Caspase-1、IL-1β表达水平上升,且与疾病严重程度相关。因此,Caspase-1/IL-1β轴参与了LDD的发病机制,可能成为LDD的治疗靶点。
