全直肠系膜切除术后低位前切除综合征的发生率及相关危险因素分析
2022-03-16李洲马勇方仕旭曾柯瑞
李洲,马勇,方仕旭,曾柯瑞
643000 四川 自贡,自贡市第一人民医院 普通外科
结直肠癌是全球范围内最常见的恶性肿瘤[1-2],据GLOBOCAN 2018全球癌症数据显示[3],2015年全球结直肠癌新发病例约为185万,其中直肠癌约70多万;最新中国肿瘤登记数据显示[4],2015年中国结直肠癌新发病例约为38.8万,发病率呈明显上升趋势。随着腹腔镜技术的提高和普及,越来越多的低位直肠癌患者选择保留肛门括约肌功能的全直肠系膜切除术(total mesorectal excision,TME),术后5年生存率可达70%左右[5-6]。在生存率提高之余,患者术后生活质量问题就更加受到大家的关注[7],直肠癌TME患者由于术中盆底神经、肌肉损伤,以及重建的直肠储存能力下降等原因,造成患者出现排便次数增多、排便不净、排便紧迫感、排便困难、排便失禁等,即低位前切除综合征(low anterior resection syndrome,LARS),影响患者术后生活质量[8-9]。LARS的病因是多因素的,且目前尚存在争议[10],本研究旨在探讨直肠癌患者TME术后LARS的发病率和严重程度及相关危险因素。
1 对象与方法
1.1 研究对象
纳入2017年1月至2019年12月在我院普外科行TME的直肠癌术后患者200例作为研究对象。纳入标准: 1)采用腹腔镜TME保肛根治术,由同一手术团队完成;2)术后病理证实为直肠癌;3)年龄≥18岁;4)临床病理资料完整。排除标准:1)有骨盆骨折史、盆腔手术史等有可能影响肛门功能疾病史患者;2)合并有慢性便秘、肠易激综合征、药物性腹泻等可能影响术后排便功能疾病史患者;3)永久造瘘手术患者;4)术后短期内复发者或发生远处转移患者;5)术后长期服用影响胃肠道或肛门功能的药物者。
1.2 研究方法
1.2.1 资料收集 通过医院病案管理系统查阅并采集研究所需的数据资料,包括:性别、年龄、身高、体重、手术方式、肿瘤大小、肿瘤下缘距肛缘的位置距离、病理分级、TNM分期、术前新辅助放化疗、术后放化疗等。
1.2.2 观察评估方法 采用LARS量表对患者的肛门排便功能进行评价,LARS量表最早有丹麦学者Bryant提出,并在欧洲进行多中心验证[11],汉化版经国内学者闫晶晶等证实用于评估我国直肠癌术后患者排便功能具有很好的信度和效度[12]。量表通过5个独立条目评估患者肛门排便功能,包括:排气失禁(0、4、7分)、稀便失禁(0、3、3分)、排便频率(0、2、4、5分)、里急后重感(0、9、11分)、排便急迫感(0、11、16分),量表总分范围0~42分,根据得分划分为无LARS(0~20分)、轻度LARS(21~29分)、重度LARS(30~42分)。本研究中根据LARS得分将患者分为LARS组(包括轻度和重度LARS)和无LARS组。
1.2.3 术后随访 采用门诊随访或电话随访的方式对患者进行LARS量表评分,分别在术后3、6、12个月门诊复诊过程中对患者进行LARS评分,对未及时到门诊复诊的患者进行电话LARS评分。
1.3 统计学分析
采用Excel 2010软件建立数据库,将数据导入SPSS 22.0统计分析软件对数据进行统计学处理。对满足正态或近似满足正态分布的连续性计量资料采用均数±标准差进行统计描述,组间比较采用两独立样本的t检验;对计数资料采用率或构成比或百分比(%)进行统计描述,组间比较采用χ2检验。在单因素分析基础上,采用多因素Logistic回归模型分析TME术后发生LARS的相关危险因素。以P<0.05作为差异有统计学意义。
2 结 果
2.1 一般资料
本研究共纳入符合入排标准的行TME的直肠癌手术患者200例,有188例(94.0%)在随访期间完成了LARS评分。其中,男性113例、女性75例;年龄31~87岁,平均(66.5±12.7)岁;患者基线资料见表1。
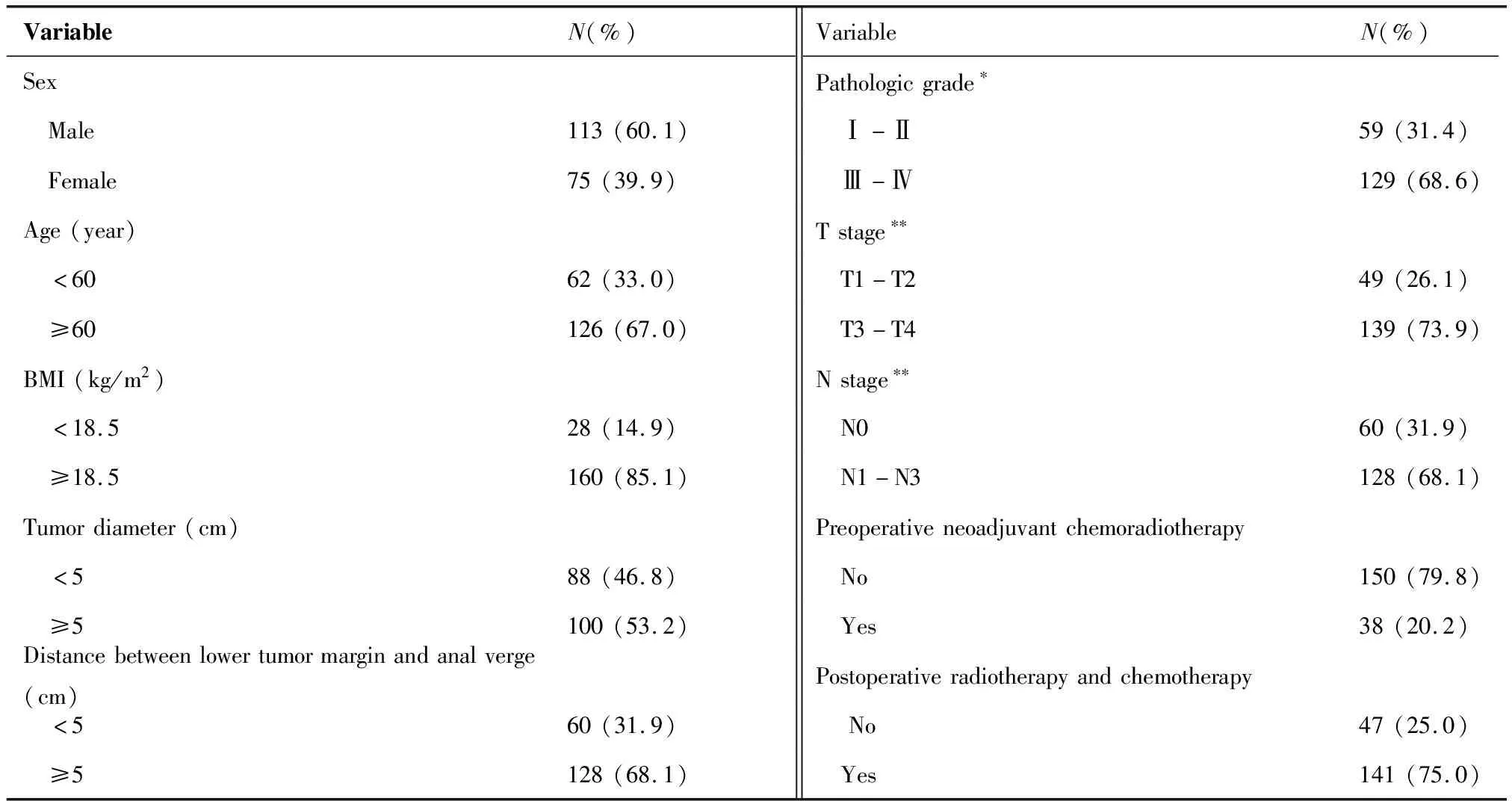
表1 188例行全直肠系膜切除术(TME)患者基线资料
2.2 术后LARS发生情况
根据LARS评分量表,79例(42.0%)患者术后发生重度LARS、49例(26.1%)发生轻度LARS、60例(31.9%)无LARS症状。轻度/重度LARS组评分21~41分,平均(31.5±5.4)分;无LARS组评分0~20分,平均(7.7±2.8)分。术后3、6、12个月LARS的发生率分别为43.6%(82/188)、28.7%(54/188)和19.1%(36/188)。患者术后12个月LARS的发生率明显低于术后6个月(χ2=4.733,P=0.030)和术后3个月的发生率(χ2=26.134,P<0.001)。
2.3 影响TME直肠癌患者术后LARS发生危险因素的单因素分析
分别对LARS组(包括轻度和重度LARS)和无LARS组的一般资料、临床资料等进行单因素分析,结果显示:肿瘤直径、肿瘤下缘距肛缘距离、术前新辅助放化疗、术后放化疗是影响TME直肠癌患者术后LARS发生的危险因素(均P<0.05)(表2)。

表2 TME直肠癌患者术后LARS发生的危险因素的单因素分析
2.4 影响TME直肠癌患者术后LARS发生危险因素的Logistic回归分析
以直肠癌患者TME术后是否发生LARS作为因变量(LARS组:Y=1,无LARS组:Y=0),将上述单因素分析有意义的危险因素作为自变量纳入Logistic回归模型,结果显示:肿瘤下缘距肛缘距离<5 cm(OR=2.375, 95%CI: 1.269~7.064)、术前新辅助放化疗(OR=3.007, 95%CI: 1.161~7.759)、术后放化疗(OR=3.572, 95%CI: 1.160~6.456)是影响TME直肠癌患者术后发生LARS的独立危险因素(均P<0.05)(表3)。

表3 影响TME直肠癌患者术后LARS发生危险因素的Logistic回归分析
3 讨 论
近年来随着健康体检的普及、早期筛查的推广以及治疗手段的改进,越来越多的直肠癌患者被早期诊断并获得根治性手术机会,患者术后5年生存率也明显提高,在一定程度上提高了患者的术后生活质量[15],但即使是行TME保肛根治术,术后仍有很大的几率发生LARS综合征,有报道显示[16],直肠癌根治术后有高达80%的比例承受着LARS综合征带来的痛苦。而在本研究中患者TME术后LARS的发生率为68.1%,而重度LARS的发生率更高达42.0%,目前已有越来越多的临床医生关注到LARS对直肠癌TME保肛根治术后患者生活质量的影响,但是国内至今仍缺乏系统深入的研究。
目前LARS综合征的病理生理机制尚不清楚,因为在保肛根治术期间可能受损的正常排便的解剖学成分和生理功能尚未完全确定。关于LARS的发生目前认为受多种因素影响[17-18],主要包括肛门内括约肌的损伤及解剖结构的改变、神经的损伤、直肠的顺应性、耐受容积下降,肠道的运动与感觉功能受人体自主神经的调节与支配,手术操作是神经损伤的主要原因,盆腔神经的范围广;与手术方式也有关系,低位直肠癌的保肛根治术手术难度大,可操作性空间小,手术过程中分离直肠前方易进入壁层筋膜,其中的神经血管束与排便功能密切相关,损伤该神经会造成术后的排便功能失调。
本研究中通过对LARS组患者与无LARS组患者的临床资料进行单因素及多因素分析,结果显示,肿瘤下缘距肛缘距离<5 cm、术前新辅助放化疗、术后放化疗是患者术后LARS发生的独立危险因素。腹腔镜直肠癌保肛根治术的难度较大,肿瘤的位置越低,术中对于直肠括约肌的损伤几率越大,从传统的外科解剖观点来看,外科肛管包括肛管及距齿状线以上2 cm的部分,齿状线以上部分存在着天然高压区在控制排便中起重要作用,低位直肠癌保肛根治术中,我们往往需要切除到齿状线甚至齿状线以下,不可避免的损伤到直肠内括约肌,造成术后LARS的发生。近年来,新辅助疗法在中低位、进展期直肠癌患者中的应用越来越普遍,已经成为国内外指南推荐的诊疗模式。在降低肿瘤复发、提高生存率的同时,术前新辅助放化疗会造成直肠肠壁功能的损害,Contin等[19]研究发现术前进行新辅助放化疗的患者术后排便功能障碍的发生率是单纯手术患者的2倍。术前放疗对直肠括约肌也能造成一定程度的损伤,损伤正常的排便功能。术前的新辅助放化疗,会造成吻合口瘘的几率增加,吻合口瘘后,发生LARS几率加大,且放疗本身也会加大LARS可能性。因此,术前及术后的放化疗均会增加LARS几率。
综上所述,直肠癌行TME保肛根治术患者术后发生LARS综合征具有较高的发生率,肿瘤下缘距肛缘距离<5 cm、术前新辅助放化疗、术后放化疗是患者术后LARS发生的独立危险因素。对具有高危因素的直肠癌患者,术后肠道功能恢复及生活质量更应受到关注。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
