RMI4评分、IOTA简易标准和GI-RADS分类用于鉴别卵巢良恶性肿块:一项对比分析*
2022-03-16刘春胡紫玥李媛朱熠何容林静卢漫
刘春,胡紫玥,李媛,朱熠,何容,林静,卢漫
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 超声医学中心
卵巢癌发病率仅次于子宫体癌和宫颈癌,但死亡率一直高居女性生殖系统恶性肿瘤首位。超声是评估卵巢病变最常用的成像技术[1],但超声诊断卵巢肿瘤的准确率受超声医师的经验影响比较大[2],故应用各客观预测模型辅助低年资超声医师诊断卵巢肿瘤很有必要。多项研究证实[3-5],恶性风险指数4(risk of malignancy index 4,RMI4)、国际卵巢肿瘤分析组织(International Ovarian Tumor Analysis,IOTA)简易标准和妇科影像报告与数据系统(gynecologic imaging reporting and data system,GI-RADS)均可客观、高效地鉴别诊断附件良恶性肿块,但目前有关三者诊断效能比较报道尚少。本研究旨在对比研究RMI4、IOTA简易标准及GI-RADS在鉴别诊断卵巢肿块良恶性中的临床价值。
1 资料与方法
1.1 研究对象
收集2018年10月至2020年8月于我院接受妇科超声检查并获得手术病理结果或最终临床随访结果的卵巢肿瘤患者的资料,根据纳入排除标准进行筛查。纳入标准:1)术前1周内的肿瘤标记物资料完备;2)超声图像清晰。排除标准:1)既往接受双附件手术或盆腔放化疗的患者;2)妊娠或哺乳期妇女;3)超声检查后1周内未接受手术的患者。
1.2 仪器与方法
应用GE Logiq E9超声诊断仪,配备阴道探头(频率5~9 MHz)和腹部探头(频率1~5 MHz)。所有患者均接受经阴道或腹部超声检查。重点观察并记录卵巢肿瘤的大小、形态、边界、内部回声、与周围脏器的关系及血流情况,同时观察子宫、腹盆腔有无转移或积液等情况,保存图像,规范超声报告。第一作者(具有5年妇科超声诊断经验)在不知道临床资料与病理结果的情况下对纳入研究肿瘤的声像图特征进行分析总结,并分别采用RMI4、IOTA简易标准和GI-RADS对其良恶性进行评估。其中,存在多发肿瘤时,纳入超声形态最复杂的肿瘤;如果两个肿瘤的超声特征相似,则选取最大的肿瘤或超声容易探及的肿瘤[6]。
1.3 评价标准
1.3.1 RMI 本研究使用的RMI4结合超声诊断(U)、绝经状态(M)、肿瘤大小(S)和血清CA125来预测肿瘤良恶性[7]。评价公式:RMI4=U×M×S×CA125。超声评价指标:实性成分、多囊结构、双侧附件肿瘤、腹腔积液和转移病灶,每项阳性评1分;超声评分≤1时,U=1,超声评分≥2时,U=4。绝经状态评分:绝经前M=1,绝经后M=4;将年龄≥50岁且子宫切除者、距离末次月经时间≥1年评价为绝经状态,其余评价为绝经前状态。肿瘤大小评分:肿瘤最大直径<7 cm时,S=1,肿瘤最大直径≥7时,S=2。RMI4>450诊断为恶性。
1.3.2 IOTA简易标准 良性肿瘤特征(B):B1:单房囊肿;B2:实性部分(最大直径<7 mm);B3:多房囊肿,分隔光滑、厚薄均匀,最大径<100 mm;B4:无血流信号;B5:存在声影。恶性肿瘤特征(M):M1:腹腔积液;M2:乳头状结节≥4个;M3:实性肿块且形态不规则;M4:丰富血流;M5:囊实性肿块且形态不规则(最大直径>100 mm)。有良性肿瘤特征(≥1)且无恶性特征存在评价为良性肿瘤;有恶性肿瘤特征(≥1)且无良性特征存在评价为恶性肿瘤;良、恶性特征均具备,或均不具备评价为不确定类[8]。
1.3.3 GI-RADS GI-RADS 1类:良性,正常附件;GI-RADS 2类:很可能是良性,功能性组织;GI-RADS 3类:可能是良性,良性赘生性肿瘤;GI-RADS 4类:可能是恶性肿瘤,不包括2~3类病变,且有1~2个恶性特征者[9]:厚壁分隔(≥3 mm)、实性部分≥50%、乳头状结节突起(≥7 mm)、中心血流信号、最低阻力指数<0.5、腹腔积液;GI-RADS 5类:很可能是恶性肿瘤,肿瘤具有≥3个4类病变所述恶性征象者。将GI-RADS 1~3类评价为良性肿瘤,4~5类评价为恶性肿瘤。
1.4 统计学分析
采用SPSS 19.0软件行统计分析,与术后病理结果或最终临床随访结果对照。以χ2检验对卵巢良恶性肿瘤声像图特征进行比较,P<0.05为差异具有统计学意义。计算RMI4、IOTA简易标准及GI-RADS鉴别卵巢良恶性肿瘤的效能并以χ2检验进行两两比较,依据比较次数调整检验水准,P<0.017为差异具有统计学意义。
2 结 果
2.1 病理学及超声检查结果
根据纳入排除标准,本研究共获得299例附件肿块患者的病例资料,年龄25~89岁,平均(45.63±3.41)岁,其中绝经期前226例,绝经后73例。296例经术后病理证实,3例经最终临床随访证实;其中良性肿瘤191例,交界性肿瘤19例,恶性肿瘤89例。本研究将19例交界性肿瘤纳入恶性肿瘤。卵巢良性肿块超声表现多呈单房囊肿,多房囊性团块囊壁光滑、囊内纤细分隔,乳头状结节最大直径<7 mm,无血流信号,伴声影;而恶性肿块多表现为实性或囊实性、囊壁及分隔较厚且厚薄不均匀,乳头状结节≥4个,中心血流信号,最低阻力指数<0.5,合并腹腔积液;两组差异均有统计学意义(P<0.05)(表1,图1、2)。
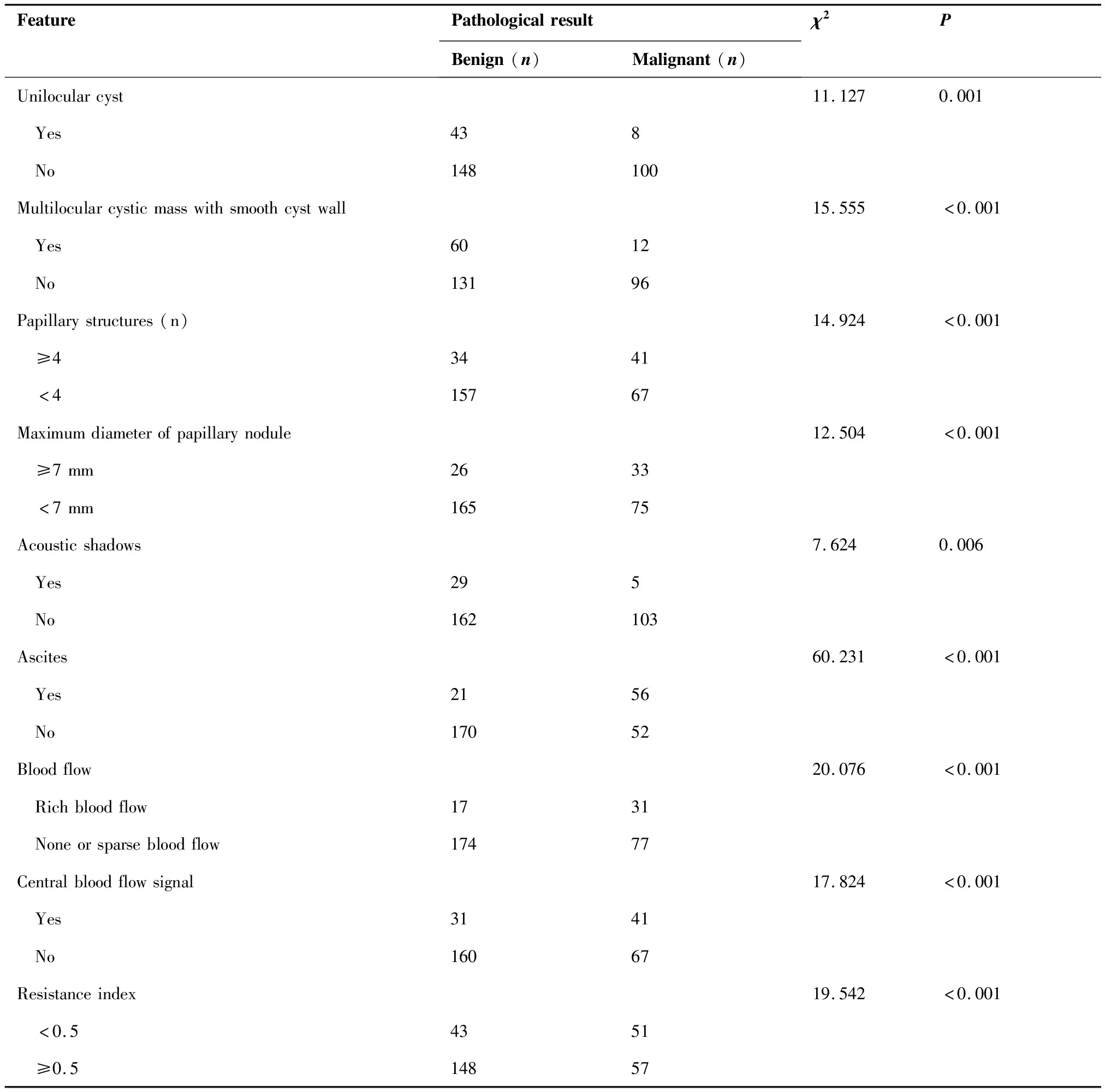
表1 卵巢良恶性肿瘤超声声像图特征
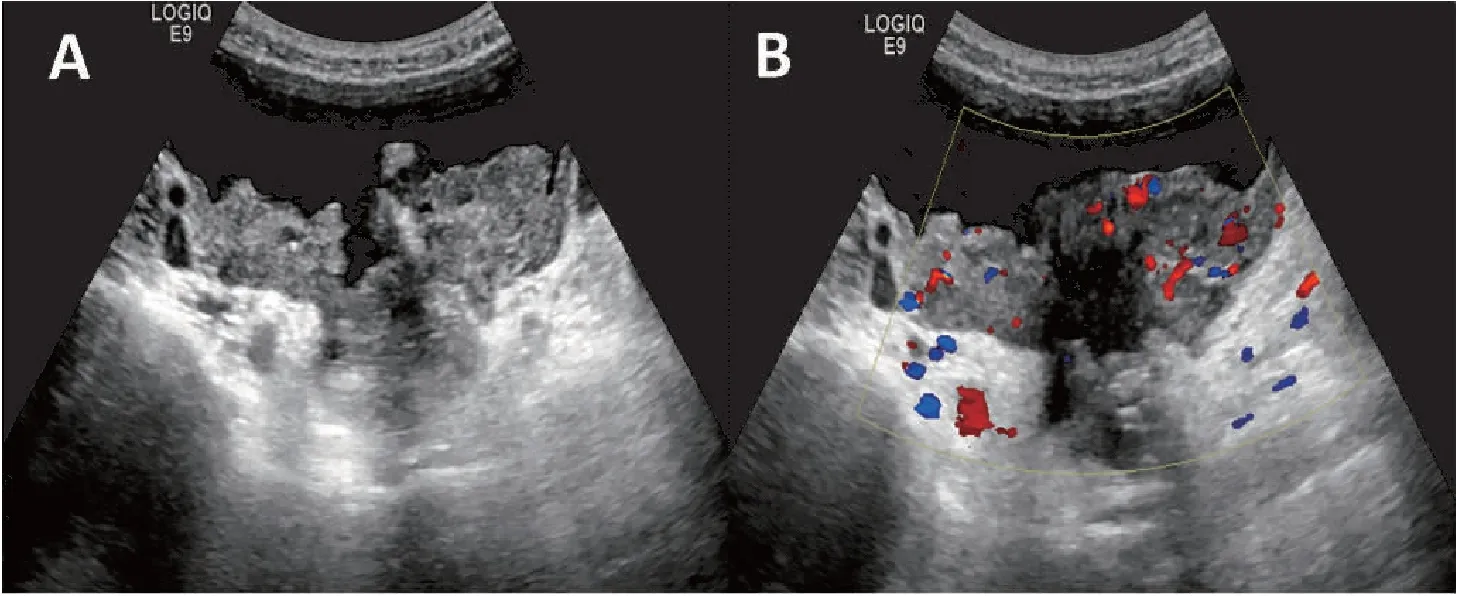
图2 浆液性恶性肿瘤超声声像图
2.2 IOTA简易标准、GI-RADS及RMI4诊断效能
IOTA简易标准诊断良性肿瘤176例,恶性肿瘤92例,不确定类31例,适用率89.63%。IOTA简易标准、GI-RADS及RMI4预测卵巢良恶性肿块的效能见表2。IOTA简易标准的敏感度与准确度均高于GI-RADS,差异有统计学意义(χ2=5.860,P=0.015;χ2=7.650,P=0.006),特异度、阳性预测值及阴性预测值差异无统计学意义(χ2=2.276,P=0.131;χ2=2.599,P=0.107;χ2=5.465,P=0.019);IOTA简易标准的敏感度、阳性预测值、阴性预测值及准确度均高于RMI4,差异有统计学意义(χ2=20.415,P<0.017;χ2=6.841,P<0.017;χ2=16.897,P<0.017;χ2=22.643,P<0.017),特异度差异无统计学意义(χ2=4.702,P=0.030);GI-RADS的敏感度高于RMI4,差异有统计学意义(χ2=5.939,P=0.015),特异度、阳性预测值、阴性预测值及准确度差异无统计学意义(χ2=0.517,P=0.472;χ2=1.220,P=0.269;χ2=4.336,P=0.037;χ2=5.050,P=0.025)。

表2 IOTA简易标准、GI-RADS与RMI4诊断卵巢肿瘤良恶性的效能(%)
3 讨 论
卵巢癌早期症状不典型,大约70%~75%的患者发现时已为晚期,5年生存率仅约28%[10]。早期准确诊断卵巢肿瘤良恶性是保证患者获得最优化治疗方案以改善预后的关键。研究表明,超声鉴别诊断卵巢肿瘤良恶性的最优方法是经验丰富超声医师的主观评估[11]。然而对于附件肿块的评估,即使经验丰富的超声医师也有误判的可能,此时应用各客观高效预测模型辅助鉴别诊断非常必要。目前,已经提出了多种预测模型用于附件肿块鉴别诊断,主要有RMI评分、ADNEX模型、Logistic回归模型、IOTA简易标准及GI-RADS等。本研究旨在对比目前较常用的RMI4、IOTA简易标准与GI-RADS三者鉴别诊断附件肿块良恶性的临床价值。
IOTA简易标准是国际卵巢肿瘤研究组提出的基于超声声像图特征的预测模型,其对超声声像图定义明确,诊断客观、高效简便,即使低年资医师也可依据肿块的大小、血流、囊实性区等声像图信息进行评估[12]。本研究记录分析了IOTA提出的诊断标准,卵巢良恶性组差异均有统计学意义(P<0.05)。本研究中IOTA简易标准适用率为89.63%(268/299),与Fathallah等[13]研究结果一致,但高于孟璐等[14]报道的适用率(80.2%),这可能与因为本组研究恶性病例比例相对较高有关。Koneczny等[15]研究显示,高年资超声医师预测卵巢肿瘤良恶性的敏感性85.9%,特异性96.9%,本研究IOTA简易标准诊断了268例肿瘤,敏感性88.78%,特异性97.06%,与其结果类似,说明两者诊断效能相当。陈念等[16]研究也提到了IOTA简易标准与高年资医师主观评估诊断效能类似且均较高。但IOTA简易标准局限性在于诊断结果中存在11%~24%不确定类[4,6],当无法做出良恶性诊断时,需结合高年资医师主观评估或GI-RADS与RMI4等其他客观预测模型[15]。
借鉴乳腺影像报告与数据系统(breast imaging reporting and data system, BI-RADS),Amor等[17]学者提出的评估附件肿瘤的GI-RADS分类系统具有简便易行、客观高效及规范超声报告等优点。但本研究结果显示,相比于IOTA简易标准,GI-RADS鉴别良恶性肿瘤效能相对较低,这与先前多项研究结果基本一致[15,18]。首先,这可能归因于GI-RADS预测卵巢肿瘤良恶性对超声医师的经验有一定的依赖性,而IOTA简易标准不涉及超声医师主观评估;刘婧等[19]研究结果显示,GI-RADS在高年资组医师的诊断效能优于低年资组医师(P<0.05),IOTA简易标准诊断效能在不同年资超声医师之间差异不明显(P>0.05)。其次,GI-RADS存在较高的假阳性率,这一现象与GI-RADS 4类肿块恶性风险(5%~20%)范围较大、4类肿瘤分类困难有关,Amor等[20]研究报道了4类肿块中高达近80%的假阳性结果;如本研究中部分实性或以实性为主的性索间质类肿瘤被误诊。因此,这在一定程度上限制了GI-RADS预测卵巢良恶性肿瘤的诊断效能。近年有学者提出的按恶性肿瘤风险程度将GI-RADS 4类肿块分为4a、4b及4c类3个亚分类[21-22],以降低4类肿块假阳性率并提高其特异性,但还需大样本、多中心研究探索。
RMI4是一种基于绝经状态、超声特征、肿瘤大小和血清CA125水平的简单评分方法,目前应用较广泛,但其诊断效能有限[7]。本研究结果显示,与GI-RADS、IOTA简易标准相比,RMI4鉴别诊断卵巢良恶性肿块的效能较低,与黄冰冰和Koneczny等[7,15]的研究结果一致。主要原因有:1)RMI4中的超声评价指标实性区域、多房、双侧性及腹水等声像图特征也常见于良性肿瘤,如本研究中1例成熟型畸胎瘤表现为以实性为主的囊实混合回声,3例纤维瘤合并有腹水;2)由于卵巢良恶性肿瘤组织病理学的差异,其两组病变在血管数目、分布、走形及灌注状态等方面存在显著不同;有研究[16]显示卵巢恶性病变血管分布常呈中心型、且走形不规则,血流丰富,多为低阻力指数动脉血,而良性肿瘤新生血管形成较缓慢,分布多周边型,以静脉血为主,血供稀疏,本研究卵巢良恶性病变超声表现符合上述特征。因此,RMI4超声评价指标未涉及病变血流信息,影响了其诊断效能;3)RMI4诊断主要依赖于CA125水平,但其往往缺乏特异性。CA125指标在交界性肿瘤、早期侵袭性卵巢癌和低度恶性肿瘤中通常正常[23],而在许多良性肿瘤或盆腔炎的情况下(例如子宫内膜异位症、卵巢囊肿、早期妊娠和手术等)呈假阳性增高[24],这降低了其特异度。因此,RMI4诊断卵巢良恶性肿瘤的效能有限。
综上,IOTA简易标准、GI-RADS与RMI4对鉴别卵巢良恶性肿块均有重要临床价值,其中IOTA简易标准诊断效能最优。但IOTA简易标准不适用于所有卵巢肿瘤评估,当判断结果不确定时,需结合GI-RADS、肿瘤标记物及临床等进行综合分析,以提高诊断效能。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
