糙皮侧耳对培养料中木质纤维素的降解研究
2022-03-16胡素娟康源春张玉亭孔维丽
刘 芹,胡素娟,崔 筱,康源春,张玉亭,孔维丽
(河南省农业科学院 植物营养与资源环境研究所,河南 郑州 450002)
我国是农业大国,秸秆资源丰富,对秸秆的综合利用有利于减少农村面源污染,促进社会可持续发展[1]。秸秆的主要成分是木质纤维素(纤维素、木质素、半纤维素),其结构复杂坚固,难以破坏,传统的化学处理工艺复杂且易造成环境污染[2]。利用农作物秸秆培养食用菌,不仅可以实现农林副产物的无害化、减量化、资源化利用,还可以收获优质的蛋白质,具有较好的经济效益和生态效益。
玉米产量在我国粮食作物中居第3位,仅次于稻、麦,该作物主要分布于黄淮海、东北和西南山区。玉米芯约占玉米产量的21%,是一种产量巨大的农副产品,来源广泛,价廉易得[3]。目前,玉米芯除少部分用于制备糠醛、木糖醇外,绝大部分被直接燃烧或随意堆置,造成资源浪费和环境污染。玉米芯组织均匀、硬度适宜、吸水性强,可用于黑木耳、双孢蘑菇、糙皮侧耳、杏鲍菇等食用菌的栽培[2-4]。糙皮侧耳(Pleurotus ostreatus)年产量居世界食用菌产量的前列[5],具有丰富的营养(如蛋白质、矿物质和维生素),显著的抗氧化、抗病毒、提高免疫力等生物活性,深受消费者的青睐[6]。糙皮侧耳易于栽培,可以在各种农业副产物(玉米芯、秸秆、稻草等)上生长,其年产量在世界范围内持续快速增长[2]。在生长发育过程中,糙皮侧耳可以通过分泌多种胞外酶如纤维素酶、木聚糖酶、漆酶等将培养料中的木质纤维素进行降解,使其变成相对简单的营养物质,以利于糙皮侧耳的吸收利用[7]。
本研究以玉米芯为主料栽培糙皮侧耳,检测了糙皮侧耳在不同生长期间对培养料中木质纤维素的降解以及相关降解酶的活性变化,并采用扫描和透射电子显微镜对培养料的微观结构变化进行了观察,旨在为研究糙皮侧耳的营养生理,以及提高培养料的利用率、减少农业面源污染提供理论支撑。
1 材料和方法
1.1 供试菌株
糙皮侧耳(Pleurotus ostreatus)由河南省食用菌种质资源库提供。
1.2 培养料配方
玉米芯84%,麸皮10%,石灰5%,尿素1%,含水量68%。
1.3 试剂与仪器
玉米芯、麸皮、石灰、尿素购自本地农贸市场;羧甲基纤维素钠(CMC-Na)、桦木木聚糖、ABTS和藜芦醇购自美国Sigma公司;柠檬酸、硫酸锰、DNS试剂购自国药集团化学试剂有限公司。BSA124S-CW天平(美国Sartorius公司)、D3024R高速冷冻离心机(美国Scilogex公司)、高速组织捣碎机(美国Cole-Parmer公司)、普析GWB-1纯水仪(北京普析通用仪器有限责任公司)、PS-60AL超声仪(深圳市雷德邦电子有限公司)、电热鼓风干燥箱(龙口市先科仪器公司)、UV-2550紫外-可见分光光度仪(美国Lab Tech公司)。
1.4 糙皮侧耳的栽培和取样
根据以往的报道[8-9],制备糙皮侧耳栽培用的发酵培养料。按照河南省地方标准《平菇发酵料栽培技术规程》(DB 41/T 1211─2016)进行糙皮侧耳的栽培。分别在糙皮侧耳菌丝萌发(T1)、发菌中期(T2)、发菌末期(T3)、现蕾期(T4)、子实体采收(T5,子实体七成熟)5个时期进行取样。在每个生长时期各随机选取9个不同的栽培袋,将其中的培养料揉碎,混合均匀后作为1个代表性的样品,每个时期设3个重复。
1.5 培养料木质素、纤维素、半纤维素含量的测定
取在50 ℃下烘干的培养料样品,按照中华人民共和国农业行业标准NY/T 3494─2019《农业生物质原料纤维素、半纤维素、木质素测定》进行木质素、纤维素、半纤维素含量的测定。
1.6 培养料木质素、纤维素、半纤维素的结构表征
1.6.1 培养料木质素、纤维素、半纤维素的单糖组成分析 根据张瑞[10]的方法进行木质素、纤维素、半纤维素组分的分离和提取,各组分的单糖组成分析通过装备有Dionex ICS-5000 HPIC系统的离子交换层析仪进行[11]。对样品(5.0 mg)采用2 mol/L的三氟乙酸在110 ℃下水解4 h,用甲醇去除三氟乙酸后,将水解产物溶于蒸馏水中;然后以12000 r/min的转速离心5 min,收集水解液,经0.22 μm尼 龙 膜(MSI, Westborough, MA, USA)过滤后进样。进样体积10 μL,进样方式为自动进样。色谱柱为Dionex CarboPac PA-200阴离子交换柱(3 mm×250 mm),洗脱液为1 mmol/L NaOH,洗脱速度为0.45 mL/min。柱温为30 ℃。与L-阿拉伯糖(Ara)、D-半乳糖(Gal)、D-葡萄糖(Glu)、D-木糖(Xyl)、D-甘露糖(Man)、葡萄糖醛酸(Glua)和半乳糖醛酸(Gala)标准品的保留时间比较进行单糖组分鉴定,并根据各吸收峰的峰面积计算各组分的质量分数。
1.6.2 培养料木质素、纤维素、半纤维素组分的分子量测定 木质素、纤维素、半纤维素分子量分布采用高效凝胶色谱(High performance gel permeation chromatography,HPGPC)进行检测。将样品上样到配备有TSK-GEL G3000 SWXL凝胶色谱柱(300 mm×7.8 mm,柱温35.0 ℃±0.1 ℃)的Agilent 1100高效液相色谱仪(Agilent, Santa Clara, CA, USA), 采 用0.05 mol/L的NaH2PO4-Na2HPO4缓冲液(pH 6.7,加0.05% NaN3)洗脱,流速为0.5 mL/min,洗脱峰采用示差折光检测器检测。参试样品的分子量根据多糖标准品的分子量(738、5800、1.22×104、2.37×104、4.80×104、1.00×105、1.86×105、3.80×105和8.53×105Da)和保留时间进行计算[12]。
1.7 木质纤维素酶活力的检测
1.7.1 粗酶液的制备 称取培养料样品10 g,加入5倍体积的蒸馏水,冰浴抽提2 h后进行匀浆,在4℃下以10000 r/min离心15 min,收集上清液作为粗酶样品,用于酶活力的测定。
1.7.2 木质素过氧化物酶(LiP)活性的测定 在0.4 mL酶液中加入0.2 mL 10 mmol/L藜芦醇溶液、0.4 mL 0.25 mol/L酒石酸缓冲液(pH值3.0),混匀,加入20 μL 20 mmol/L H2O2溶液,然后启动反应,以未加H2O2溶液的反应体系为对照,检测在波长310 nm处5 min前后反应液吸光值的变化[13]。将酶活力单位(U)定义为每分钟每毫升反应体系转化1 μmol藜芦醇所需的酶量。
1.7.3 锰过氧化物酶(MnP)活性的测定 在0.2 mL酶液中加入0.8 mL 10 mmol/L MnSO4溶液,混匀,再加入20 μL 20 mmol/L H2O2溶液,然后启动反应,以未加H2O2溶液的反应体系为对照,检测在波长290 nm处5 min前后反应液吸光值的变化[14]。将酶活力单位(U)定义为每分钟每毫升反应体系中将1 μmol Mn2+转化为Mn3+所需要的酶量。
1.7.4 漆酶(Laccase)活性的测定 在10 μL酶液中加入190 μL 1 mmol/L ABTS溶液(pH值4.6),在30 ℃下反应10 min;再加入300 μL 5%三氯乙酸终止反应,测定在波长405 nm处的吸光值[15]。对照组采用10 μL加热失活的酶液,其余条件相同。将酶活力单位(U)定义为每分钟每毫升反应体系产生1个吸光值所需要的酶量。
1.7.5 木聚糖酶(Xylanase)活性的测定 在1 mL酶液中加入1 mL 1%的木聚糖溶液,在50 ℃下反应10 min;再加入2 mL DNS试剂,沸水浴10 min;取出立即冷却,加蒸馏水定容至10 mL,测定波长520 nm处的吸光值[16]。还原糖含量根据木糖的标准曲线进行计算。将酶活力单位(U)定义为每分钟每毫升反应体系产生1 μmol木糖所需要的酶量。
1.7.6 纤维素酶(Cellulase)活性的测定 在0.25 mL酶液中加入0.75 mL 1%的CMC-Na溶液,在50 ℃下反应10 min;再加入0.75 mL DNS试剂,沸水浴10 min;取出立即冷却,加蒸馏水定容至10 mL,测定波长520 nm处的吸光值[17]。还原糖含量根据葡萄糖的标准曲线进行计算。将酶活力单位(U)定义为每分钟每毫升反应体系产生1 μmol葡萄糖所需要的酶量。
1.8 电镜观察分析
1.8.1 扫描电镜分析 取材固定:随机选取培养料中的玉米芯颗粒,切取组织面积不超过3 mm2,迅速投入电镜固定液固定。将固定好的样品采用0.1 mol/L磷酸缓冲液(pH值7.0)漂洗4次,每次20 min。在用1%锇酸后固定2 h后,再用双蒸水漂洗样品2次,每次15 min。将样品采用不同浓度(30%、50%、70%、80%、90%、95%、100%、100%)的乙醇进行逐级脱水,每次15 min;再用乙酸异戊酯脱水15 min。样品经二氧化碳临界点干燥、喷金后,用Hitachi S3000 N扫描电子显微镜(日本经营电子电气公司)观察采图[5]。
1.8.2 透射电镜分析 后固定:将1.8.1节中固定好的样品放入用0.1 mol/L磷酸缓冲液(pH值7.0)配制的1%锇酸中在避光、室温下进行后固定7 h。经磷酸缓冲液漂洗后,将样品用不同浓度(30%、50%、70%、80%、95%、100%、100%)的 乙 醇 进行逐级脱水,每次1.0 h;然后用无水乙醇∶丙酮=3∶1的混合液脱水0.5 h;用无水乙醇∶丙酮=1∶1脱水0.5 h;用无水乙醇∶丙酮=1∶3脱水0.5 h;最后用丙酮脱水1.0 h。渗透包埋:先用丙酮∶812包埋剂=3∶1在37 ℃下包埋2~4 h;用丙酮∶812包埋剂=1∶1在37 ℃下渗透过夜;再用丙酮∶812包埋剂=1∶3在37 ℃下包埋2~4 h;最后用纯812包埋剂在37 ℃下包埋5~8 h;将纯812包埋剂倒入包埋板,将样品插入包埋板后于37 ℃烤箱过夜。聚合:将包埋板放于60 ℃烤箱聚合48 h,取出树脂块备用。超薄切片:将树脂块于超薄切片机上进行超薄(60~80 nm)切片,用150目方华膜铜网捞片。染色:将铜网于2%醋酸铀饱和酒精溶液中避光染色8 min;用70%酒精清洗3次;用超纯水清洗3次;用2.6%枸橼酸铅溶液避二氧化碳染色8 min;最后用超纯水清洗3次,用滤纸稍吸干。将铜网切片放入铜网盒内在室温下干燥过夜[5]。在Hitachi H-7500透射电子显微镜(日本经营电子电气公司)下观察,采集图像进行分析。
1.9 数据统计与分析
所有实验均设3个重复,数据以平均数±标准差(SD)表示。采用IBM SPSS统计软件(Version 20; IBM Institute, Armonk, New York, USA)进行单因素方差分析, P<0.05表示具有显著性差异。
2 结果与分析
2.1 培养料中纤维素、半纤维素和木质素含量的变化
分别对糙皮侧耳菌丝萌发(T1)、发菌中期(T2)、发菌末期(T3)、现蕾(T4)、子实体采收(T5)5个阶段糙皮侧耳培养料中的木质纤维素含量进行检测,结果如图1所示。随着糙皮侧耳的生长,纤维素、半纤维素、木质素的含量均显著降低,从T1到T5,三者的含量分别下降了9.21%、21.25%和3.95%,半纤维素含量的下降趋势最为明显。
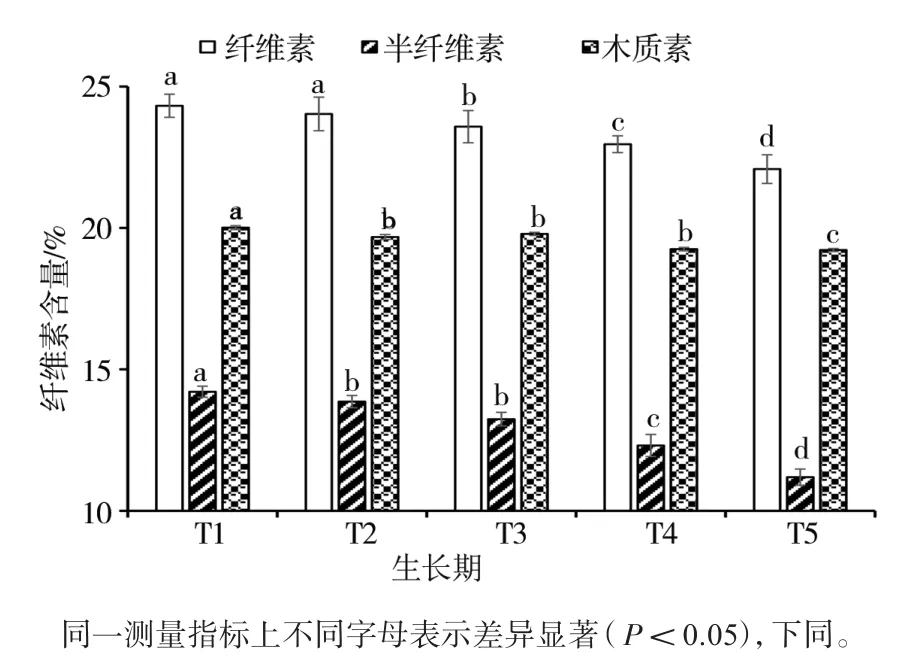
图1 在糙皮侧耳不同生长时期培养料中纤维素、半纤维素和木质素含量的变化
2.2 培养料中木质纤维素降解酶活性的变化
如图2所示,在糙皮侧耳生长前期,培养料中的纤维素酶活性较低;但随着糙皮侧耳的生长,培养料中的纤维素酶活性不断增加,且在子实体采收期(T5)达到高峰(3.37 U/mL)。与纤维素酶活性的变化趋势相似,随着糙皮侧耳的生长,培养料中的木聚糖酶活性不断增加,并在采收期(T5)达到高峰(4.17 U/mL)。但是,随着糙皮侧耳的生长,培养料中漆酶活性呈现先升后降的变化趋势,在发菌末期(T3)达到峰值(3.38 U/mL),此后呈不断下降的趋势。培养料中的MnP活性变化与漆酶类似,随糙皮侧耳的生长而不断增加,并在发菌末期(T3)达到最高值(1.62 U/mL)。培养料中的LiP活性较低,与菌丝萌发期(T1)相比,LiP的活性在发菌中期(T2)时上升,随后逐渐下降,但在采收期(T5)又有所增加。
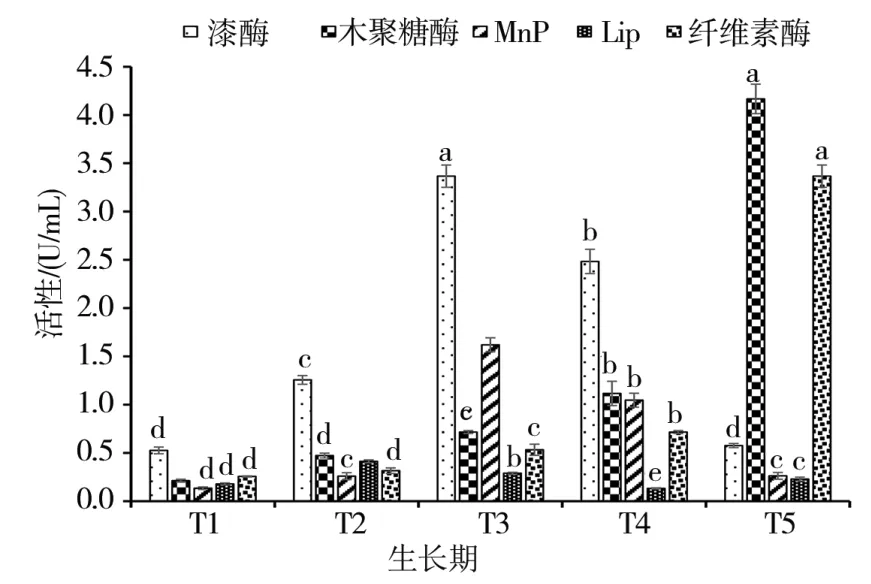
图2 在糙皮侧耳不同生长时期培养料中木质纤维素降解酶活性的变化
2.3 培养料中纤维素、半纤维素和木质素组分的结构表征
表1~表3显示了在糙皮侧耳不同生长时期培养料中纤维素、半纤维素和木质素组分中单糖的组成变化。结果表明,纤维素中的单糖主要是Glu,还有微量的Xyl、Man、Gal和Ara,这可能是由于该分离提取的纤维素含有微量的半纤维素。纤维素中的Glu含量随糙皮侧耳的生长而逐渐降低(81.06%~73.60%)。半纤维素中的主要单糖是Xyl(64.30%~73.21%)和Ara(11.02%~14.70%),且 两者的含量均在采收期(T5)最低。在糙皮侧耳5个生长时期的培养料木质素中均检测到Glu和Xyl,在现蕾期(T4)两者的含量最高,而且与其他4个时期相比,在现蕾期(T4)和子实体采收期(T5)的木质素中新出现了Ara和Gal这2种单糖。
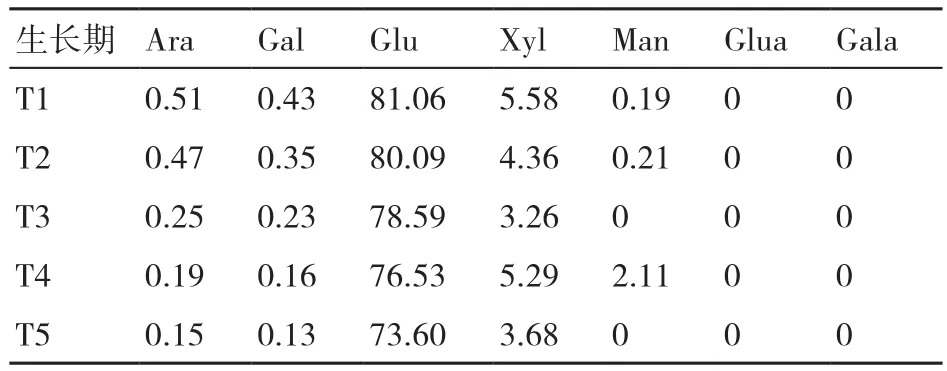
表1 在糙皮侧耳不同生长时期培养料中纤维素组分的单糖含量 %
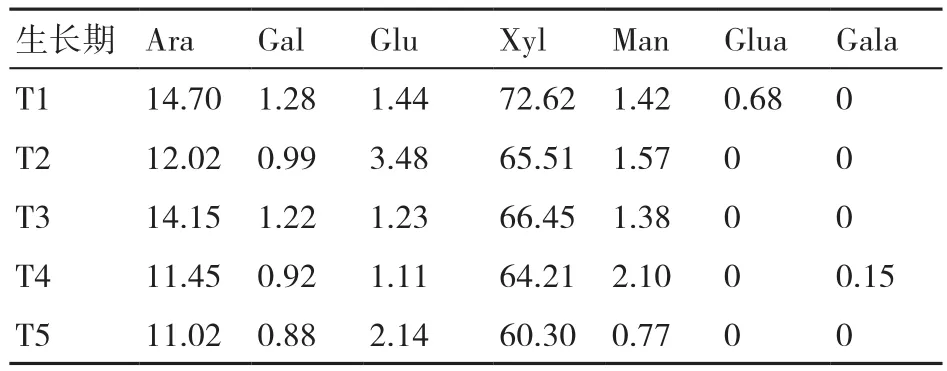
表2 在糙皮侧耳不同生长时期培养料中半纤维素组分的单糖含量 %
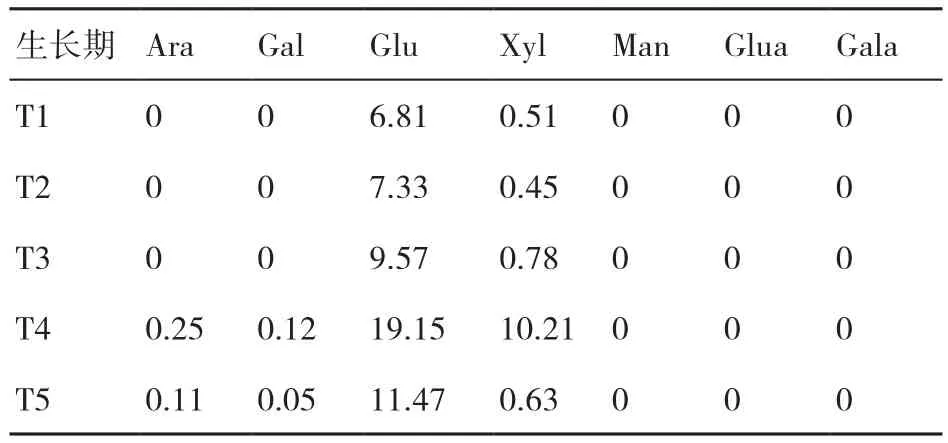
表3 在糙皮侧耳不同生长时期培养料中木质素组分的单糖含量 %
从培养料中提取的纤维素、半纤维素和木质素组分的分子量分布变化如表4~表6所示。纤维素Mn的变化表现为T4>T1>T2>T3>T5,Mw表 现为T1>T2>T4>T3>T5,D表现为T1>T2>T3>T4>T5;半纤维素Mn的变化表现为T1>T2>T4>T3>T5,即随着糙皮侧耳的生长而不断下降,Mw表现为T2>T1>T4>T3>T5,D表现为T5>T4>T2>T3>T1;纤维素和半纤维素的Mn和Mw均在子实体采收期最低。木质素的Mn变化表现为T4>T1>T5>T2>T3,Mw表现为T4>T5>T1>T2>T3,均在菌丝生长期(T2和T3)最低,在现蕾期(T4)最高。

表4 在糙皮侧耳不同生长时期培养料中纤维素组分的重均相对分子质量(Mw)、数均相对分子质量(Mn)和分散度(D)
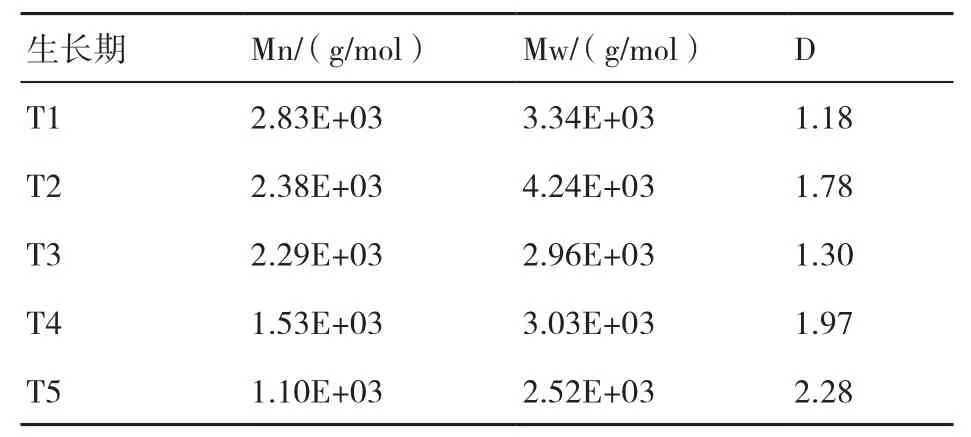
表5 在糙皮侧耳不同生长时期培养料中半纤维素组分的重均相对分子质量(Mw)、数均相对分子质量(Mn)和分散度(D)
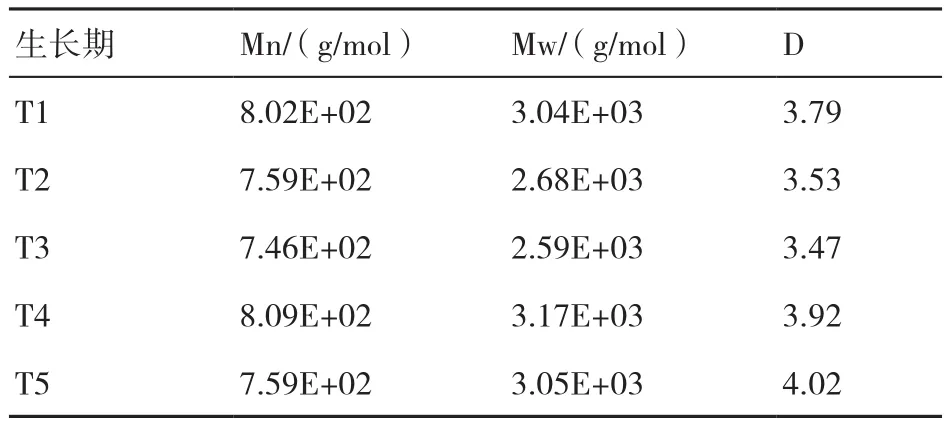
表6 在糙皮侧耳不同生长时期培养料中木质素的重均相对分子质量(Mw)、数均相对分子质量(Mn)和分散度(D)
2.4 扫描电镜观察
采用扫描电镜观察在糙皮侧耳生长过程中培养料中玉米芯组织的纵切面(图3a~图3j)和横切面(图3k~图3t)的形态学变化。从中可以看出,在糙皮侧耳菌丝刚萌发(T1)时,玉米芯维管集聚,其横截面呈不规则圆形且结构清晰,维管内由上至下布满微孔(图3a、图3b);管径较粗且厚实,纤维表面光滑,管与管之间相切排列,界限清晰,结构紧密(图3k、图3l)。这些维管的结构特征有利于植物对空气、水分和养分的吸收及交换利用。随着糙皮侧耳的生长,玉米芯维管明显变得表面粗糙、孔洞多、结构疏松、质地松散,并且其中的糙皮侧耳菌丝明显增多(图3c~图3j和图3m~图3t)。尤其是在糙皮侧耳子实体采收期(T5),玉米芯的维管遭到明显腐蚀和破坏,其横切面的圆形管壁变薄甚至塌陷,壁上微孔无法辨识(图3i、图3j);管径变细,相互交错且界限模糊,维管结构严重受损,且中间布满了糙皮侧耳菌丝(图3s、图3t)。这可能是由于糙皮侧耳菌丝将维管壁上的木质纤维素降解并吸收利用,从而导致维管结构被严重破坏。
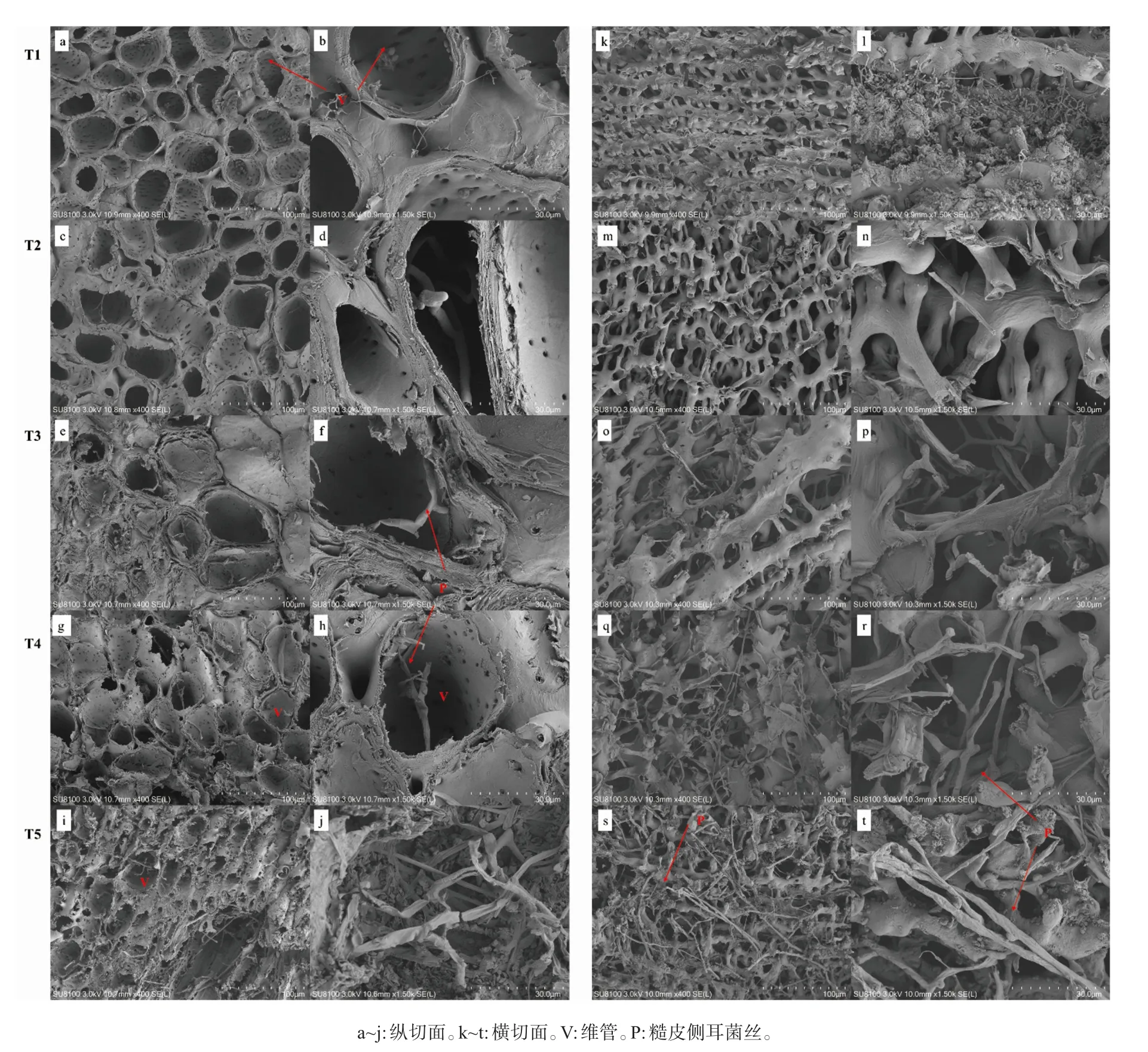
图3 扫描电镜观察糙皮侧耳不同生长时期培养料中玉米芯的显微形态学变化
2.5 透射电镜观察
采用透射电镜观察糙皮侧耳生长过程中玉米芯组织的超微结构变化。从图4a~图4c可以看出,糙皮侧耳菌丝刚萌发时(T1)培养料中的玉米芯细胞形状规则,排列紧密;细胞壁结构较为完整,表面平滑。随着糙皮侧耳菌丝的生长,玉米芯细胞形状逐渐变得无规则,甚至完全被破坏(图4d~图4l)。图中浅色部分为发生降解的细胞壁,深色部分是未降解的细胞壁。随着糙皮侧耳的生长,玉米芯细胞壁逐渐透明或消失,说明其结构明显被降解并出现断裂。从图4h、图4i可以看出,糙皮侧耳菌丝可以进入细胞壁的内部,进而降解其中的物质。这可能是因为糙皮侧耳菌丝优先分泌的木质素降解酶(漆酶、MnP)降解了玉米芯细胞壁上的木质素,引起其结构的破坏,从而使得糙皮侧耳菌丝可以进入到细胞壁内部,通过分泌纤维素酶和木聚糖酶使其中的纤维素和半纤维素发生降解并开始被菌体利用。尤其是在糙皮侧耳子实体采收期(T5),玉米芯内集聚了大量的糙皮侧耳菌丝,细胞之间结合松弛且排列紊乱,骨架结构遭到严重破坏(图4m~图4o)。

图4 透射电镜观察糙皮侧耳不同生长时期培养料中玉米芯的超微结构变化
3 讨论与结论
糙皮侧耳适应性强,可以广泛利用农林副产物(木屑、玉米芯、麦麸和甘蔗渣等)作为培养料进行人工栽培[2]。糙皮侧耳作为木腐型真菌,可以分泌木质纤维素降解酶(Cellulase、Xylanase、Laccase、MnP和LiP等)来降解培养料中的木质纤维素(纤维素、半纤维素和木质素),以获取生长所需的碳源[18-19]。因此,随着糙皮侧耳的生长,培养料中纤维素和半纤维素的比例显著降低,尤其是在采收子实体时,其降解程度分别达到9.21%和21.25%。纤维素和半纤维素在相关的降解酶的作用下转化为小分子糖,可以为糙皮侧耳菌丝和子实体的生长提供碳源[20]。与半纤维素和纤维素相比,木质素含量的降低程度较低(3.95%),类似的结果也出现在白灵侧耳(Pleurotus tuoliensis)[20]和凤尾菇(Pleurotus pulmonarius)[21]的栽培上。这一现象可以通过白腐真菌对木质纤维素生物质的降解特性来解释。植物组织的纤维素和半纤维素被木质素紧密包围,形成一种天然的抗降解的屏障,起到保护纤维素和半纤维素的作用,使其不易被微生物破坏[22]。即使少量木质素被降解,纤维素和半纤维素的可接触性也大大提高,有利于发生进一步的酶解和脱聚,因此纤维素和半纤维素的降解程度较高[23]。HPAEC-PAD的检测结果显示,培养料中的纤维素主要是由Glu组成的,半纤维素主要是由Xyl和Ara组成的,随着糙皮侧耳的生长,纤维素中的Glu含量以及半纤维素中的Xyl含量逐渐降低,并且在子实体采收期达到最低值。同时纤维素和半纤维素的分子量也在子实体采收期最小,这进一步说明糙皮侧耳对两者进行了显著降解。而木质素的单糖主要是由Glu和Xyl组成的,且其含量在现蕾期达到峰值,说明在这个时期木质素的结构发生了某种显著的变化。而各组分的总含量远远低于100%,是因为在木质素的结构中糖单元的含量较苯丙烷结构低得多,而HPAEC-PAD检测只能对其中的糖单元进行测定。同时木质素的分子量在发菌期间较低,在现蕾期最大,其可能的原因是糙皮侧耳在发菌过程中菌丝大量利用培养料中的木质素组分,使得木质素发生部分降解,降解后的木质素在现蕾期发生结构重组,从而导致木质素分子量上调[10]。
糙皮侧耳可以分泌大量的氧化酶和水解酶如Cellulase、Xylanase、Laccase、LiP和MnP以 降 解培养料中的大分子物质,满足生长所需,这些酶活性的变化可以反映糙皮侧耳利用木质纤维素的规律。木质素降解酶类如漆酶和MnP的活性随糙皮侧耳生长而快速升高并最先达到最大值,这表明木质素可能较先发生降解[12]。这一现象在香菇(Lentinula edodes)[24]、巴西蘑菇(Agaricus blazei)[25]、灰树花(Grifola frondosa)[26]等食用菌上也有发生。当菌丝萌发时,作为糙皮侧耳主要碳源的纤维素在培养料中的含量为24.32%。因此,较高的纤维素酶活性有利于降解培养料中的纤维素,以提供糙皮侧耳生长所需的碳源。纤维素酶的活性随糙皮侧耳栽培时间的延长而逐渐升高,并于子实体采收期达到最高,说明这一阶段培养料中的纤维素大量被降解,这与四孢蘑菇(Agaricus campestris)[27]栽培基质的降解特性相似。半纤维素也可以为糙皮侧耳的生长提供一定的碳源,培养料中的半纤维素含量约为14.21%。木聚糖酶是水解半纤维素的主要酶,其活性随糙皮侧耳的生长而不断升高,这有利于菌丝细胞降解培养料中的半纤维素组分,最大程度地利用培养料中的碳源,这与人们对双孢蘑菇(Agaricus bisporus)[27]、榆耳(Gloeostereum incarnatum)[24]等食用菌的研究结果相似。
玉米芯是培养料中的主要成分(84%),其结构的变化可以间接反映栽培糙皮侧耳过程中培养料的结构变化。SEM结果显示,栽培糙皮侧耳后玉米芯的结构松散、孔洞较多、表面粗糙,维管部分被消化并出现断裂,维管之间结合松弛且排列紊乱。结合TEM可以发现,玉米芯细胞骨架结构遭到破坏,细胞壁结构模糊,其中含有的物质(纤维素、半纤维素和木质素)逐渐透明或消失。玉米芯微观结构的变化印证了培养料化学组分的变化。这说明糙皮侧耳通过分泌各种木质纤维素降解酶,大幅降解玉米芯中的木质纤维素(纤维素、半纤维素和木质素)为小分子物质并被自身吸收利用。
根据以上结果,笔者推测糙皮侧耳优先利用培养料中的葡萄糖、氨基酸等小分子物质,然后分泌木质素降解酶(Laccase和MnP)降解培养料中的木质素组分,木质素结构的被破坏使糙皮侧耳菌丝得以进入木质纤维素内部,并开始分泌Cellulase和Xylanase以降解纤维素和半纤维素,从而满足其生长所需。
本文对糙皮侧耳生长过程中培养料中木质纤维素及相关降解酶的活性变化进行了研究,所获得的研究结果可以为提高糙皮侧耳的生产力和培养料的利用率,减少由工农业生产中的副产物造成的潜在环境污染提供理论支撑。
