基于实验情境的“钠及其重要化合物”复习课设计
2022-03-16叶炜华
叶炜华






摘要:高三复习备考中,围绕“钠及其重要化合物”知识,创设物质制备、成分探究、性质探究、定量测定等实验情境,合理设置问题链,引导学生自主建构、内化钠及其重要化合物的认识方式,提升学生自觉运用钠及其重要化合物性质解决化学实验问题的能力,发展“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
关键词:实验情境;钠及其重要化合物;证据推理;模型认知
文章编号:1008-0546(2022)03-0090-06 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.03.020
高考评价体系[1]规定了高考的考查载体——情境,以此承载考查内容,实现考查要求。崔允漷[2]认为,指向素养的学习是有真实情境与任务介入的真实学习,只有在真实情境下运用某种或多种知识完成特定的任务,才能评估关键能力、必备品格和价值观念。基于实验情境开展“钠及其重要化合物”复习,引导学生将所建构的物质类别、化合价、反应原理等物质性质的认识方式真正内化,并自觉运用于解决实验情境下的真实问题,实现对物质性质的系统探究或创造性应用,发展“证据推理与模型认知”等化学学科核心素养。
一、教学主题内容分析
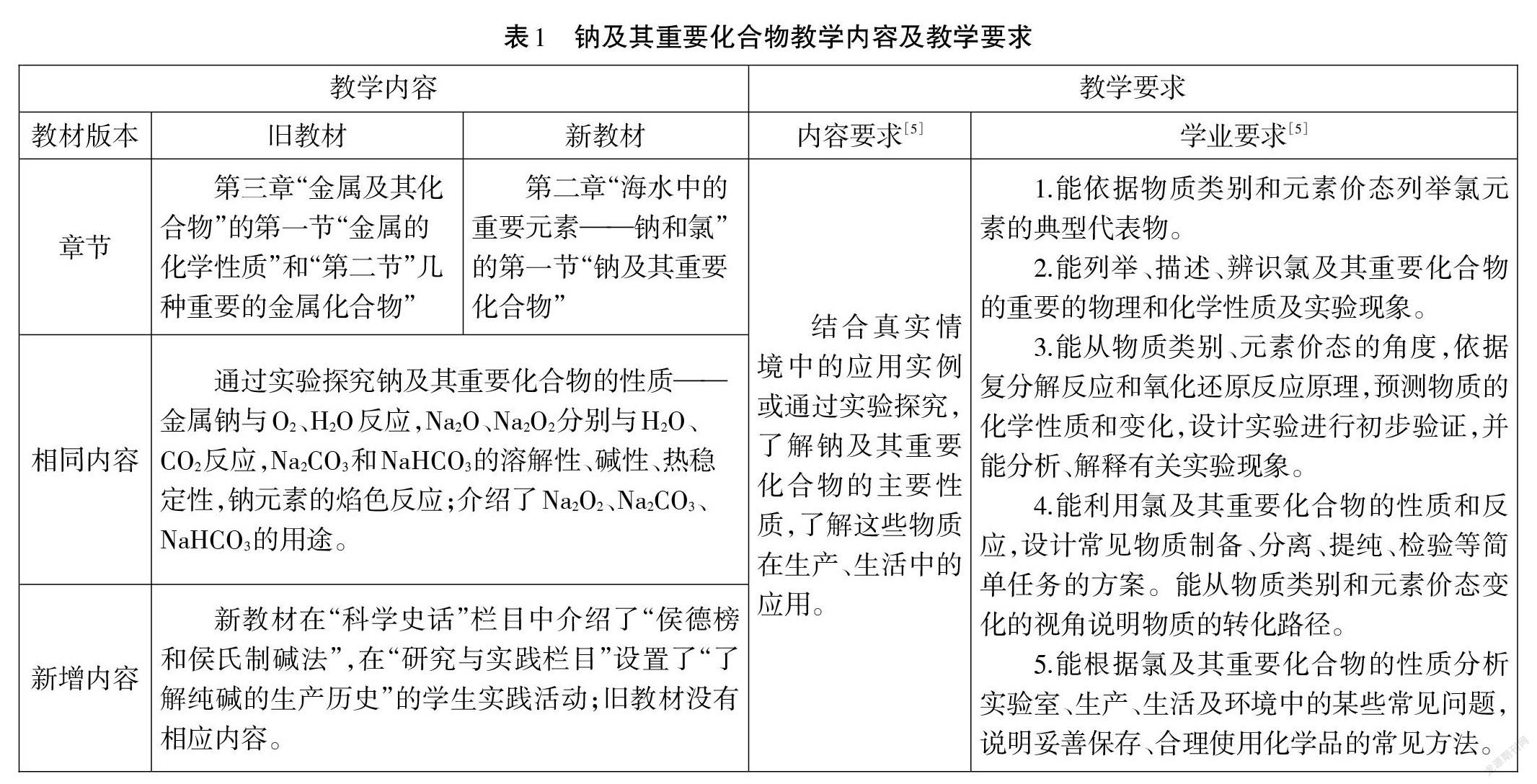
钠及其重要化合物是高中化学必修课程中“主题2 常见的无机物及其应用”的重要组成部分。人教版旧教材[3]和新教材[4]中有关钠及其重要化合物的知识内容和呈现方式几乎一致,主要通过实验探究钠及其重要化合物的性质(详见表1),只是内容所在章节有所调整;另外,新教材在“科学史话”栏目中介绍了“侯德榜和侯氏制碱法”,在“研究与实践栏目”设置了“了解纯碱的生产历史”的学生实践活动。
近年高考常以钠及其重要化合物为载体,考查学生在真实实验情境中接受、吸收、整合化学信息,分析问题和解决问题的能力及化学实验与探究能力。2018年海南省高考通过“探究金属钠与二氧化碳的反应”,考查 CO2的制备、提纯及Na 与 CO2反应产物的推断和化学方程式的书写;2018年全国高考Ⅱ卷考查“Na2CO3可用于去除餐具的油污”等。
二、教学现状分析
1.文献分析
在中国知网(CNKI)以“钠及其重要化合物”为主题进行检索,绝大多数是研究新授课教学,研究复习课教学的很少。叶兰峰[6]等利用工业上制备金属钠、氯碱工业、侯氏制碱法等新情境,提高课堂教学效率。郑雅兰[7]等通过创新设计实验——钠与水反应引发钠与硫反应,体现知识的系统性以及元素化合物作为其他部分知识载体的功能。上述研究,结合实际工业生产、化学实验探究等真实情境,引导学生关注钠及其重要化合物的性质在真实情境中的应用,有利于提高学生化学学科能力,促进学生化学学科核心素养的发展。
2.学情分析
学生已经复习了物质的分类及其变化、离子反应、氧化还原反应等知识,具备建构从物质类别、化合价、反应原理等角度归纳钠及其重要化合物性质的知识基础。基于实验情境开展“钠及其重要化合物”复习,首先要引导学生自主建立元素化合物的认知模型;其次,要强化证据推理意识,培养运用元素化合物知识解决复杂实验情境的问题的能力。
三、教学思想与创新点
单旭峰[8]认为“在真实情境中解决问题的过程展示出的能力才是实际的能力,表现出的态度和情感才是真实的品质特征”“实验目的就是一个问题情境”。笔者提出基于实验情境的元素化合物复习的教学模式(详见图1),开展“钠及其重要化合物”的复习实践。
基于实验情境的“钠及其重要化合物”复习,围绕 Na、Na2O与Na2O2、NaOH、Na2CO3和NaHCO3的性质,创设制备NaH、探究Na2O2与浓盐酸反应的气体产物、探究 CO2缓慢通入 NaOH 溶液 的产物及检 验、测定 Na2CO3和NaHCO3混合物中Na2CO3百分含量等实验情境,有梯度地设计不同复杂和陌生程度的问题,引导学生开展分类与概括、符號与表征、证据与推理、设计与评价等学习活动,基于代表物类别、类别通性、化合价、周期律或反应原理(电离、水解、化学平衡、电化学)等认识角度[9]理解钠及其重要化合物的性质,通过完成物质制备、保存、利用、检验、鉴别、分离等不同类型的应用性问题和活动任务,促进学生建构、内化、自觉运用对钠及其重要化合物的认识方式和问题解决能力,发展“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养。
四、教学目标
结合对教材内容、课程标准、高考真题和具体学情的分析,确定教学目标如下:
1.通过分析NaH的制备实验的装置、操作步骤、产品验纯,掌握Na的强还原性——与O2、H2O、HCl的反应,建构物质制备类实验装置连接模型及实验注意事项。
2.通过分析 Na2O 和盐酸的反应,知道 Na2O 是一种碱性氧化物,掌握碱性氧化物的通性——与 H2O、酸、CO2等发生反应;通过预测 Na2O2和浓盐酸反应的气体产物,掌握 Na2O2与 H2O、酸、CO2的反应,理解 Na2O2的强氧化性;通过设计检验Na2O2和浓盐酸反应的气体产物的实验方案,初步养成排干扰意识;通过 Na2O、Na2O2的性质对比,基于物质类别、类别通性、化合价等认识角度理解物质性质。
3.通过探究 CO2缓慢通入 NaOH溶液中依次发生的反应,理解CO2与NaOH溶液的反应产物与CO2气体的量有关;通过设计实验方案,检验 NaOH 和 Na2CO3混合溶液中的溶质成分、鉴别Na2CO3和NaHCO3,掌握Na2CO3和 NaHCO3的化学性质,强化实验方案设计中的排干扰意识;通过设计利用 CO2和 NaOH溶液制备纯净的Na2CO3的实验方案,掌握实验方案设计与评价的基本原则,提高化学实验与探究能力。
4.通 过设计 测定 Na2CO3和 NaHCO3混 合物 中 Na2CO3的百分含量的实验方案,进一步掌握Na2CO3和 NaHCO3的化学性质,提高设计与评价实验方案的能力;了解热分解法、沉淀法、滴定法、量气法等定量测定的常用方法及其注意事项;理解定量测定實验的关键在于减小实验误差,保证测量数据的准确性。
五、教学流程
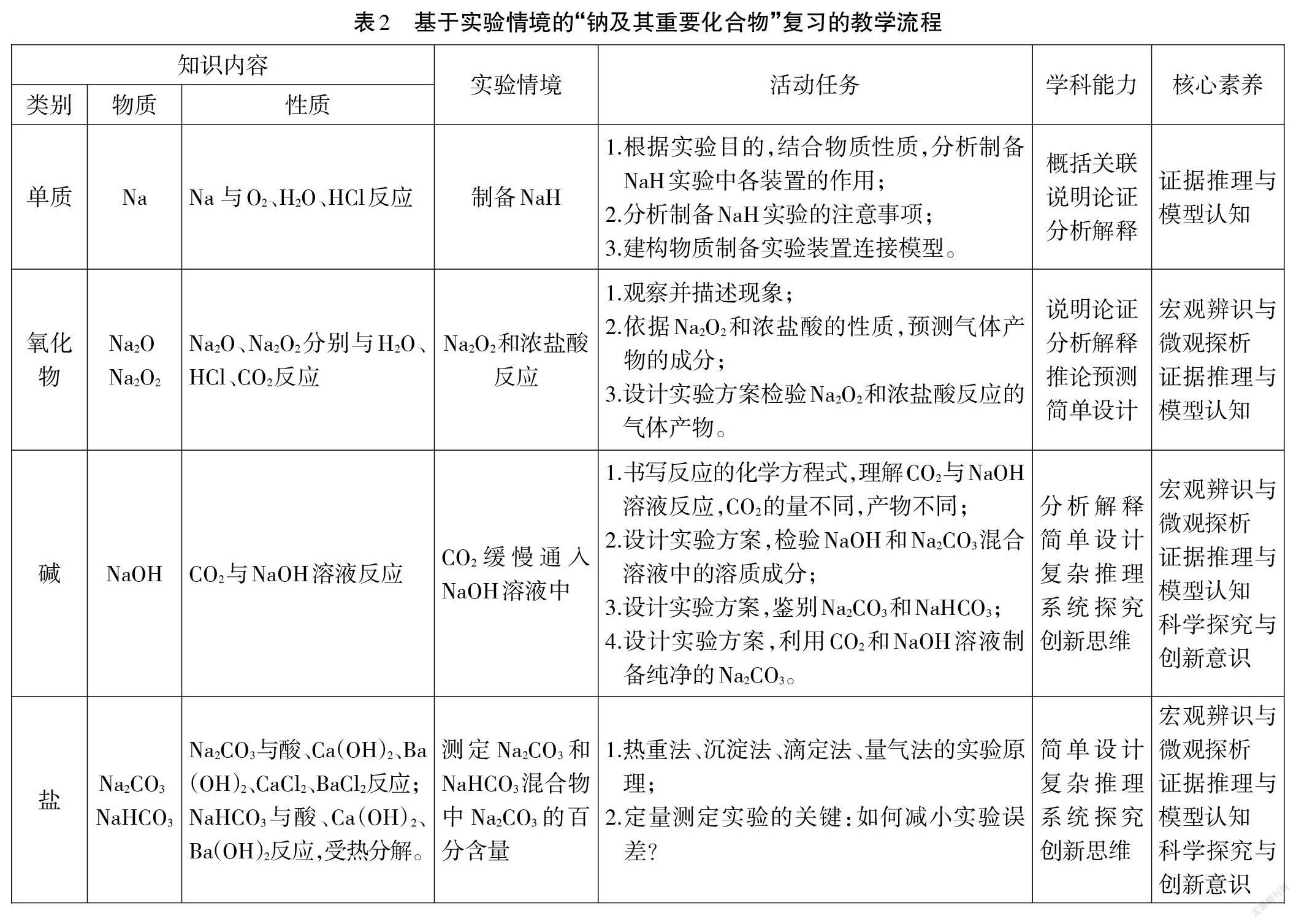
基于上述认识,确定基于实验情境的“钠及其重要化合物”复习的教学流程,详见表2。
六、教学实录
1.基于实验“NaH 的制备”复习金属钠的性质
【实验情境1】氢化钠(NaH)是有机合成中用途很广泛的强碱,可与水反应生成H2。实验室可用氢气和钠在高温下化合制备氢化钠,装置如图2所示。
【问题1】装置A、B 中分别盛放什么试剂?作用分别是什么?
【问题2】装置C 中浓硫酸的作用是什么?
【问题3】实验开始时,应先通一段时间H2,再点燃酒精灯加热,原因是什么?
【问题4】反应一段时间后,取少量硬质玻璃管中的固体物质与水反应,若能生成 H2,证明得到的 NaH一定是纯净的。该验纯方法是否合理?为什么?
【问题5】该装置存在明显缺陷,如何改进?学生思考、分析、交流、回答。
【课堂小结1】(1)钠是一种非常活泼的金属,具有很强的还原性,能与 O2、H2O、HCl 等发生反应。(2)物质制备实验装置连接模型:气体发生装置→除杂装置→干燥装置→核心反应装置→收集装置→尾气处理装置;关注:防氧化、防潮解、防污染、防倒吸、防爆炸、防暴沸。
2.基于实验“探究 Na2O2和浓盐酸反应”复习钠的氧化物的性质
【实验情境2】在试管中加入少量Na2O2,滴加5滴36.5%浓盐酸。
【问题1】观察到什么现象?
【问题2】试管中可能发生的反应有哪些(用化学方程式表示)?
【问题3】对比 Na2O与H2O、HCl 的反应(用化学方程式表示),Na2O2与H2O、HCl 的反应有什么不同?
【问题4】请你设计一个简单实验,证明生成的气体是O2?
【生1】用带火星的木条,复燃。
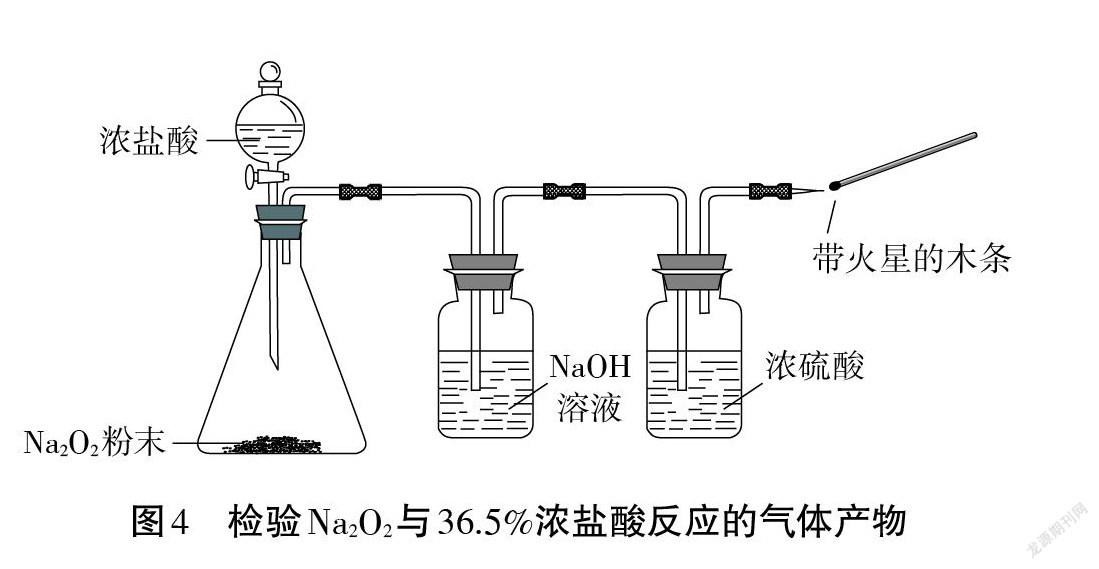
【生2】不行。即使生成的是 O2,木条也不一定复燃 。因为浓盐酸会挥发出大量的 HCl 气体和水蒸气。应将生成的气体依次通过盛有蒸馏水、浓硫酸的洗气瓶,除去 HCl气体和水蒸气,再用带火星的木条检验(见图3)。
【生3】我觉得还是有问题。因为 Na2O2具有强氧化性,浓盐酸的还原性比较强,也可能生成Cl2:Na2O2+4HCl(浓)=2NaCl+2H2O+Cl2↑ 。应该用 NaOH溶液代替蒸馏水,同时除去Cl2和HCl(见图4)。
【问题5】请你设计一个简单实验,证明生成的气体是Cl2?
已知:酸性条件下,O2+ 4I-+ 4H+= 2I2+ 2H2O。
【生1】将生成的气体通入品红溶液,若品红溶液褪色,即可证明是Cl2。
【生2】将生成的气体通入紫色石蕊溶液中,溶液先变红后褪色,也可以证明是Cl2。
【生3】用湿润的蓝色石蕊试纸检验更方便。
【课堂小结2】(1)Na2O 属于碱性氧化物,能与 H2O、酸、CO2等发生反应。(2)Na2O2既有氧化性又有还原性,与H2O、(非氧化性)酸、CO2发生歧化反应,放出 O2。(3)设计检验物质的实验方案,要排除可能存在的干扰。
3.基于实验“探究 CO2与 NaOH 溶液反应”复习氢氧化钠的性质
【实验情境3】将CO2缓慢通入NaOH稀溶液中,通入CO2的量不同,产物也不同。
【问题1】上述实验过程中,依次发生的反应有哪些(用化学方程式表示)?
【问题2】若只通入少量 CO2气体,所得溶液的溶质是什么?请你设计一个简单实验进行验证。
供选试剂:BaCl2溶液、Ba(OH)2溶液、酚酞试剂;供选仪器:pH计、试管、烧杯、滴管。
提示:25℃时,BaCO3饱和溶液的pH=9.6。
【生】只通入少量 CO2气体,反应生成 Na2CO3。此时,溶液中的溶质有过量的 NaOH 和生成的 Na2CO3。检验方案:加入少量 BaCl2溶液,生成白色沉淀,证明有 Na2CO3;因为 Na2CO3水解显碱性,会干扰 NaOH 的检验;所以,加入过量BaCl2溶液,除去Na2CO3;充分静置后,取少量上层清液,用pH计测定溶液的pH,如果 pH 明显大于9.6,证明有NaOH。
【问题3】通入一定量的 CO2气体后,若溶液中只含一种溶质,该溶质可能是什么?请你设计一个简单实验进行验证。
【生】溶液中只含一种溶质,可能是 Na2CO3或者 NaHCO3。可以用BaCl2溶液验证,若产生白色沉淀,说明溶质是Na2CO3;反之,则是NaHCO3。
【问题4】如何利用 CO2气体和 NaOH溶液制备纯净的Na2CO3?请简要描述实验方案,用化学方程式说明实验原理。
【生1】往NaOH溶液中通入适量CO2,控制n(CO2)∶n(NaOH)=1∶2。原理:2NaOH+CO2=Na2CO3+H2O。
【生2】往 NaOH 溶液中通入过量 CO2,将生成的 NaHCO3分离出来,放入坩埚中灼烧至恒重。原理 :NaOH+CO2=NaHCO3,2NaHCO3 Na2CO3+H2O+ CO2↑。
【生3】先将 NaOH 溶液分成两等份,往其中一份中通入过量CO2,再将二者混合。原理:NaOH+CO2= NaHCO3,NaOH+NaHCO3=Na2CO3+H2O。
【思考与交流】从操作的简约性角度考虑,你觉得哪种实验方案最好?
【课堂小结3】(1)CO2和NaOH溶液反应的产物与通 入的 CO2气 体的 量有 关:CO2少 量,生成 正盐 (Na2CO3);CO2过量,生成酸式盐(NaHCO3);(2)设计物质检验方案,要排除相互间的干扰。(3)设计实验方案的原则:科学可行、操作简单、现象明显、绿色经济。
4.基于实验“测定w(Na2CO3)”复习碳酸钠和碳酸氢钠的性质
【实验情境4】某样品中含有 Na2CO3和 NaHCO3,请你设计实验方案,测定样品中Na2CO3的质量分数w (Na2CO3)。
步骤1:取少量样品于试管中,称量,质量记为m1g。
……
要求:简单描述实验方案、实验原理和操作步骤,如有需要,请展示实验装置图。
学生分组讨论,派代表汇报方案。
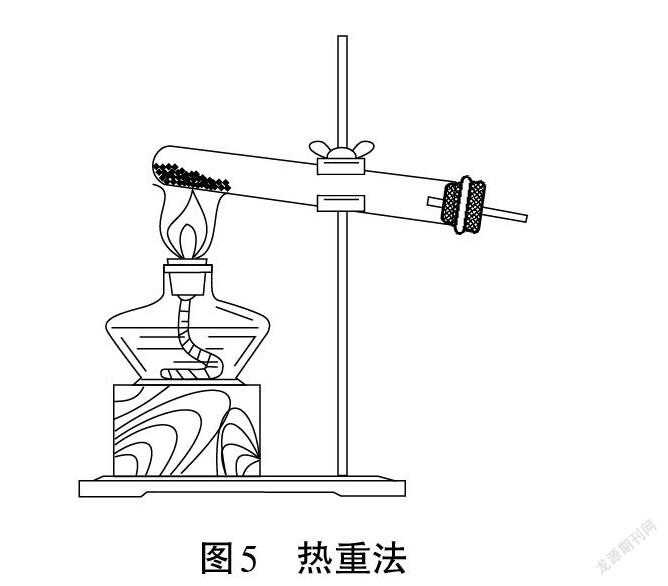
【小组一】我们小组设计的方案采用热重法,装置如图5所示。将固体加热至恒重,加热后固体的质量记为m2g。可以计算得到w(Na2CO3)。
【问题】恒重的标准是什么?
【生】多次称量,结果质量相差很小,就表示恒重。
【教师】一般认为,连续两次称量的质量相差小于0.1g,表示恒重。
【小组二】我们小组设计的方案采用沉淀法。将样品配成溶液,加入足量 Ba(OH)2溶液,过滤、洗涤、干燥、称量,可计算w(Na2CO3)。
【问题】沉淀剂能不能选择其它物质?
【生1】也可以选用Ca(OH)2溶液。
【生2】Ca(OH)2溶液不好,因为 Ca(OH)2微溶于水,需要的 Ca(OH)2溶液量会很大,过滤操作耗时太长。因此,我选择用Ba(OH)2固体作沉淀剂。
【生3】CaCl2溶液或者 BaCl2溶液都可以,都能够和Na2CO3反应生成沉淀。
【问题】CaCl2溶液和 BaCl2溶液,哪个比较好?为什么?
【生1】CaCl2溶液比较好,因为Ba2+是重金属离子,容易造成污染。
【生2】从测量结果的准确性考虑,选择BaCl2溶液更好。因为 Ba 的相对原子质量比 Ca 的大得多,相对误差更小。
【小组三】我们小组设计的方案采用量气法,装置如图6所示。
【问题1】导管a 的作用是什么?
【生】平衡压强,使稀硫酸顺利流下;还可以减小实验误差,使测得的CO2气体的体积更准确。
【问题2】碱式滴定管中盛放的试剂是什么?理由是什么?
【生】饱和NaHCO3溶液,可以抑制 CO2溶解,使测定结果更准确。
【问题3】为了使测定结果更准确,计数时要注意什么问题?
【生】冷却到室温后,上下移动碱式滴定管使两边的液面相平,视线要和凹液面的最低处、刻度线在同一直线上。
【小组四】我们小组设计的方案采用滴定法,装置如图7所示。
【思考与交流】上述方法中,操作最简单的是哪
种?测定结果最准确的是哪种?
【课堂小结4】(1)Na2CO3和 NaHCO3的性质总结;(2)定量实验的思维模型:明确目的→分析原理→设计方案→开展实验→数据处理→误差分析;(3)定量实验的关键:减小实验误差,保证测量数据的准确性。
七、教学反思
1.发挥化学实验价值,精心设计实验活动
以实验为基础是化学学科的重要特征之一,化学实验对于全面发展学生的化学学科核心素养有着极为重要的作用[5]。充分发挥化学实验的教学功能,精心设计实验探究活动,对实验情境素材进行深入探究,完成对实验本体的开发;深入了解学生学习情况,结合学生思维的最近发展区,分析实验情境中学生在知识、能力、素养等方面可能的增长点,设置合理的探究台阶,开发有梯度的问题链,将复杂实验情境转化为学生课堂上可完成的问题解决活动。
2.强化证据推理能力,提升建模用模意识
证据推理是逻辑推理能力在化学学科中的重要的表现形式,要求考生能够根据证据,对物质组成、结构及性质变化进行分析推理[10]。基于实验情境开展元素化合物复习,有利于强化学生的证据意识,引导学生基于证据对物质的性质、变化和实验现象、结论提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系。在分析和解决实验问题的过程中,建立元素化合物性质的认知模型、物质制备实验装置连接模型、定量实验的思维模型等思维程序,以期在后续复习过程中应用、迁移、创新。
参考文献
[1] 教育部考试中心.中国高考评价体系[M].北京:人民教育出版社,2019.11:7.
[2] 崔允漷.学科核心素养呼唤大单元教学设计[J].上海教育科研,2019(4):1.
[3] 人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中课程标准实验教科书化学1 必修[M].北京:人民教育出版社,2007:46-63.
[4] 人民教育出版社,课程教材研究所,化学课程教材研究开发中心.普通高中教科书化学必修第一册[M].北京:人民教育出版社.2019:32-40.
[5] 中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:15,17,72.
[6] 叶兰峰,孔琴飞,张礼聪.高三专题复习走出“老套路”,迈向“新情境”——以“钠及其重要化合物”为例[J].中學化学教学参考,2014(21):36-39.
[7] 郑雅兰,刘丽君.改进钠及其重要化合物的实验 提升元素化合物复习效率[J].化学教学,2017(3):75-77.
[8] 单旭峰,宋修明.真实情境的高考化学命题理论与实践[J].中学化学教学参考,2019(9):1-5.
[9] 王磊.基于学生核心素养的化学学科能力研究[M].北京:人民教育出版社,2017.12:207.
[10]教育部考试中心.2018年普通高等学校招生全国统一考试系列用书·高考理科试题分析(理科综合分册)[M].北 京:高等教育出版社,2018:8.
3370500338296