基于全内反射显微镜的荧光漂白后恢复实验方法建立*
2022-03-15曹慧珍王瑾瑜王文娟
曹慧珍,王瑾瑜,王文娟
(清华大学生物医学测试中心尼康生物影像中心,北京100084)
全内反射荧光显微镜(Total Internal Reflection Fluorescence Microscopy,TIRFM)特异性地照亮盖玻片/样品界面附近的荧光团,抑制来自细胞更深层的背景[1-2],广泛应用于质膜附近的生物过程研究中,例如细胞粘附位点、囊泡胞吐和内吞作用或内质网/质膜接触位点等[3-4]。荧光漂白后恢复(Fluorescence Recovery After Photobleaching,FRAP)技术是研究分子迁移特性的技术。基于全内反射显微镜的荧光漂白后恢复实验(Total Internal Reflection/Fluorescence Recovery After Photobleaching,IR/FRAP)将TIRFM和FRAP技术相结合,测量盖玻片/样品界面分子的动力学数据,是研究质膜附近分子动力学的有力工具[5]。
但是目前商品化设备的TIRFM标准配置不能很好地进行TIR/FRAP实验。在TIRF显微镜上进行FRAP实验的通用方案是TIRF状态下使用强光对整个成像区域进行光漂白,使用低强度的光照采集漂白前后的TIRF图像[4,6-11]。这种实验方法对于研究体外蛋白质分子或人工膜的动力学是可行的,漂白视野即成像视野仅占整个体系的极少的一部分[8],符合通用FRAP结果拟合分析中漂白区域是整个体系一部分的假设[12]。但是对于细胞来说,每个细胞是相对独立的,即每个细胞可以成为独立的体系,漂白整个细胞后,无法观察到二维平面的分子运动情况;另外,细胞的被漂白区域太大也很可能会对细胞造成光损伤,影响细胞状态,获取错误的实验结果。此外FRAP实验中,图像采集过程也存在光漂白,在成像视野中需选择未漂白的区域作为参考区域分析,可以很容易地校正这种成像中光漂白对FRAP结果的干扰,更方便快捷地获取准确的样品动力学数据。因此,发展能够进行感兴趣区域特异性漂白的基于全内反射成像的荧光漂白后恢复技术对于研究细胞质膜的分子动力过程有着非常重要的作用。
基于本平台的成像设备提出了一种TIR/FRAP技术的实验方法,可以仅漂白多个任意位置的感兴趣区域(ROI),并采集漂白前后TIRF图像。
1 实验方法
采用一台搭载了TIRF照明系统和sCMOS相机(Humamatsu Flash 4.0)的NikonA1R激光扫描共聚焦显微镜分别进行共聚焦和TIRF实验,实验流程如图1所示(通过分析虚线框中荧光漂白前后的成像数据就可以得到FRAP曲线)。首先在全内反射成像(TIRF)模式下进行全内反射成像,再切换到共聚焦模式对ROI进行局部光漂白,然后切换到TIRF模式式采集漂白前后全内反射图像。通过分析荧光漂白前后的TIRF图像就可以得到FRAP曲线。通过编辑NIS-Elements软件程序实现TIRF和共聚焦(Confocal)模式间的快速稳定切换,完成TIR/FRAP实验,获得质膜附近分子动力学数据。
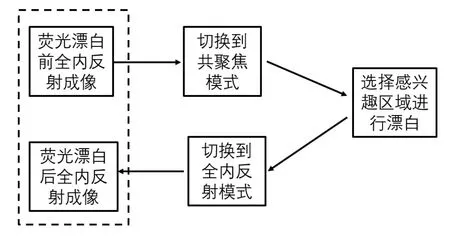
图1 基于全内反射成像的荧光漂白后恢复技术的实现路径
为了满足TIR/FRAP的实验需求,对仪器的成像程序进行了一系列的调整,具体实验流程如下:①打开NIS-Elements成像软件时,选择双驱动模式,同时打开Nikon confocal和Hamamatsu相机的驱动。②确认软件和硬件的关联,建立共聚焦和TIRF成像的OC(Optical Configurations,光学配置)。可以一键式地切换光学配置,节约实验时间,减少人工操作错误率,简化并优化成像操作。以TIRF488 OC为例,该光学配置能快速切换仪器状态到488 nm激光激发下采用相机成像的TIRF成像模式。③根据样品荧光信号的强弱和稳定性,优化OC中的成像参数,如共聚焦模式中的漂白激光强度和漂白时间,TIRF模式中的激光强度和曝光时间等。④搭建可以实现驱动自动切换的软件程序,完成TIR/FRAP实验。
2 自动切换程序
为了寻找合适的快速稳定切换程序,使用NIS-Elements软件编辑了3种不同类型的软件程序。它们分别基于ND Sequence Acquisition、Macro和JOBs程序,均可以实现共聚焦模式和TIRF模式间的自动往复切换。
2.1 基于ND Sequence Acquisition的程序
ND Sequence Acquisition是NIS-Elements软件的一个控制窗口,它可以定义任意多维图像序列的获取,还可以选择在实验期间运行宏或命令。利用ND Sequence Acquisition将TIRF图像采集、ROI区域漂白、Laser interlock解锁、开启激光等步骤按照一定顺序连接起来,即可完成TIR/FRAP实验。具体程序如图2所示,即:①切换OC至TIRF488。②执行命令,Stg_RemoveInterlock(),解除激光锁。③执行命令、Stg_SetShutterStateEx(“488 nm”,1),打开488 nm的激光光闸。①~③步即可成功切换至TIRF OC,并保证出光可以正常进行图像采集,随后即可进行TIRF模式的图像采集,时间序列、多点序列或多色图像采集。④ND Acquisition,采集TIRF时间序列图像,获取漂白前的TIRF图像。⑤切换OC至A1,此光学配置快速将仪器切换到共聚焦成像模式。⑥执行命令,Stg_RemoveInterlock(),解除激光锁。⑦Action选择Seg.Stimulation,执行共聚焦模式下光刺激实验。④~⑤步即可成功切换至A1 OC,并保证出光可以正常进行图像采集,随后除执行光刺激程序,还可以采集共聚焦图像,时间序列、多点序列、三维序列等多维图像,获取目的蛋白在细胞中其他位置的定位信息。⑧⑦~⑧步重复①~③步的程序,成功切换至TIRF OC。⑨NDAcquisition,采集TIRF时间序列图像,获取漂白后的TIRF图像。

图2 基于ND Sequence Acquisition的TIR/FRAP程序
2.2 基于Macro的程序
Macro(宏)是计算机语言的一种指令形式,可以组合多个命令,使一系列复杂任务可以自动执行。在Macro中编辑命令,可以实现TIRF和Confocal的自动切换,完成TIR/FRAP实验。
详细代码如下:
SelectOptConf("TIRF488");
Stg_RemoveInterlock();
Stg_SetShutterStateEx("488nm",1);
ND_RunExperiment(1);
SelectOptConf("CONFOCAL-FRAP");
Stg_RemoveInterlock();
ND_RunSequentialStimulationExp();
SelectOptConf("TIRF488");
Stg_RemoveInterlock();
Stg_SetShutterStateEx("488nm",1);
ND_AppendTimePhase(5000,300000,"");
ND_RunExperiment(1);
2.3 基于JOBs的程序
在NIS-Elements 4.60以上的软件版本中提供了JOBs插件。JOBs为用户提供了轻松创建复杂的、完全定制实验模板的功能,支持智能工作流程,将不同类型的图像拍摄自动结合。JOBs用于TIR/FRAP程序,如图3所示。

图3 基于JOBs的TIR/FRAP程序
3 系统测试结果
使用细胞进行测试,上述程序或手动切换均可以完成TIR/FRAP实验,如图4所示,获取任意ROI漂白前后的全内反射图像。从测试结果中可以看出,手动进行TIRF和Confocal模式的切换时,漂白后恢复TIRF图像(D4)的采集时间比漂白后Confocal图像(D3)滞后20 s,漂白区域内的荧光信号强度相对图D/H/L有明显的恢复。因此,手动切换可能会获取不准确的光漂白数据,在样品的恢复速度较快的情况下,还可能会错失关键数据。3种自动切换程序均可以在比较快的时间(15 s)内实现Confocal和TIRF模式的切换。测试细胞由清华大学俞立课题组提供,是表达TSPAN4-GFP的NRK细胞系[13]。
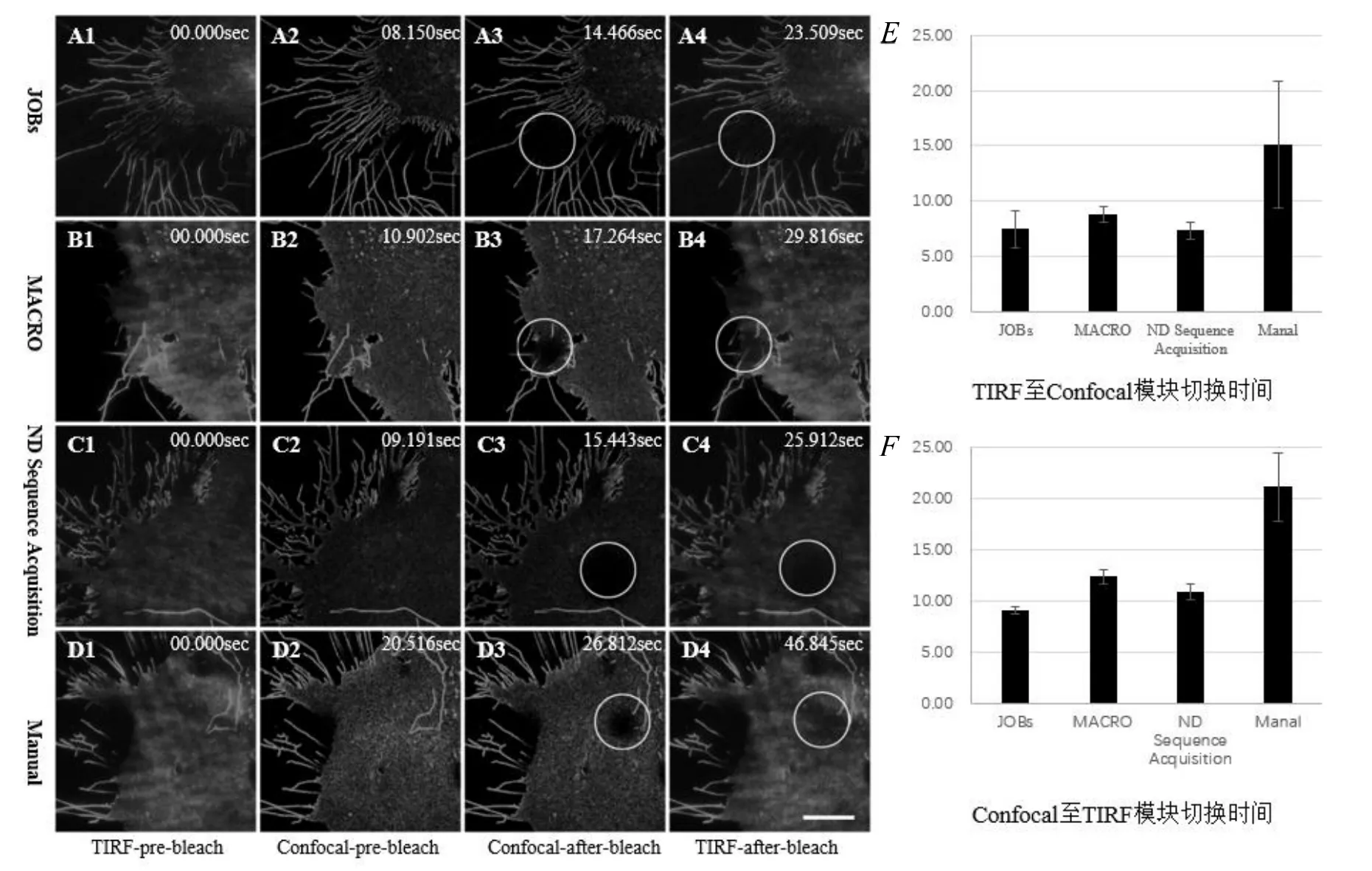
图4 TIR/FRAP实验结果
多次测试后统计发现,手动由TIRF模式切换至共聚焦模式需要(15.11±5.69)s(n>6),JOBS程序需要(7.49±1.66)s(n>6),Macro需要(8.76±0.71)s(n>6),NDSequenceAcquisition程序需要(7.33±0.78)s(n>10);手动由共聚焦模式切换至TIRF模式需要(21.07±3.36)s(n>6),JOBS程序需要(9.02±0.37)s(n>6),Macro需要(12.33±0.70)s(n>6),NDSequence Acquisition程序需要(10.84±0.81)s(n>10)。
从图4可以看出,A1~A4基于JOBs程序,B1~B4基于Macro程序,C1~C4基于ND sequence Acquisition程序,D1~D4手动切换TIRF和Confocal模式进行TIR/FRAP实验。第一列是漂白前的TIRF图像;第二列是漂白前的共聚焦图像,已完成TIRF至Confocal的切换;第三列是漂白后的共聚焦图像;第四列是漂白后的TIRF图像,已完成Confocal至TIRF的切换。标尺,10μm;图中圆形区域指示漂白区域。E表示TIRF切换至Confocal所需要的时间,F表示Confocal切换至TIRF所需要的时间。
与手动进行模式间的切换相比,自动切换在速度和稳定性方面都具有明显的优势。整个TIR/FRAP实验中存在2次模式间的切换,第一次将TIRF模式切换至Confocal模式,第二次将Confocal切换至TIRF,后者较复杂,需要更长的切换时间,基于JOBs的切换程序可以提供更快且稳定的切换速度,是TIR/FRAP实验的较优选择,但这一功能并非NIS-Elements软件的基础功能,需要额外购买,且软件版本需要高于4.60。从模式间切换的速度和稳定性上来看,ND Sequence Acquisition程序也是不错的选择,而且ND Sequence Acquisition程序可以自动完成3段数据的拼接,操作简单。Macro程序虽然速度和稳定性略差于前者,但其对软件配置和版本没有要求,是通用型的程序。
4 讨论
TIR/FRAP技术在20世纪80年代开始于科学研究中,早期使用光电倍增管而非相机采集漂白前后的荧光数据,仅获取交界面表面蛋白的动力学数据,没有空间分辨率数据[8,14]。2000年,桑德将TIR/FRAP技术用于成像领域,既采集空间分辨率的图像也获取动力学数据,而且相互印证,动力学数据更加准确[5],但漂白区域为整个视野,不适用精细定位的蛋白质信号。近些年,有一些实验室会搭建TIRF-近场显微镜,可以在TIRF和近场显微镜间自由切换,使用分光器或多型聚光镜实现ROI区域内的TIR/FRAP实验[15-17],但这个ROI只能设定一个且位置大多局限在视野中间[18]。仪器的搭建需要专业的光学工程师,不适用于大多数的实验室。随着商品化技术的发展,有一些厂家可以提供独立的FRAP模块安装在TIRF显微镜上[19],可以实现任意ROI区域的光漂白,但这些模块通常只包含一根激光器,不能满足使用最佳激发激光进行光漂白实验的需求,另外一方面也需要额外的经济和时间成本,以满足实验需求。
作为仪器平台的工作人员,希望及时高效地满足用户的实验需求。本文中TIR/FRAP程序很好地解决了用户在全内反射成像条件下实现特异性光漂白的荧光漂白后恢复实验的需求。当然本方法也有一定的局限性,例如不适用于快速恢复的样品(荧光漂白后恢复时间小于40 s),但是无需购置新的设备和等待漫长的订货周期,可以轻松实现漂白多个任意位置ROI,并采集漂白前后全内反射图像,直接满足大多数的TIR/FRAP实验需求,操作也比较简单。
TIR/FRAP实验的成功进行,也为TIRF和共聚焦显微镜联合使用提供了基础。激光共聚焦和全内反射显微镜联合使用可以发挥各自设备的特点,并兼取二者之长,使其相辅相成,更好地应用于科学研究中。
