中枢神经系统与周围神经系统发育和损伤过程中微管动态性的差异比较*
2022-03-13柏为娟马超巫荣华刘炎刘梅
柏为娟,马超,巫荣华,刘炎,刘梅***
(1江苏省盐城市中心血站血液检测中心,盐城 224005;2南通大学教育部/江苏省神经再生重点实验室,神经再生协同创新中心)
中枢神经损伤修复是长期未能解决的医学难题,如何提高损伤后神经再生能力一直是神经再生研究领域中最受关注的热点。一般来说哺乳动物成体中枢神经系统的神经元损伤后轴突不能再生,但发育中的神经元,或某些成体的周围神经的损伤轴突却是可再生的。这种再生能力的差异被认为与内在再生能力和外部抑制因素有关[1]。
神经元是一个极性细胞,细胞突起结构维持和远距离轴浆运输都依赖于微管骨架网络。当神经损伤轴突断裂后,轴突顺行、逆行运输中断,远端轴突溃变,近端轴突回缩。当中枢神经轴突损伤后,由于微管网络排列紊乱,近端轴突往往形成一个回缩球;而周围神经轴突损伤后,轴膜封闭顶端的细胞骨架却可以动态重构为一个活跃的生长锥[2]。生长锥的形成是受精细调控的微丝和微管有序重构的过程,发育过程中主要包括微丝介导的突起起始、膨大及随后微管介导的突起固化和延伸。但对于损伤后的轴突而言,该过程更加复杂,生长锥重构的前提是要阻止损伤后微管的逆行坍塌,随后还需要微管骨架的重新活化,才能实现突起的重新形成和延伸。因此对于损伤轴突而言,微管的动态重构能力显得尤为重要。研究[3]表明,周围神经损伤后的轴突内存在组蛋白脱乙酰酶5,可调节损伤轴突顶端的微管动态变化,使稳定的乙酰化微管去乙酰化,增加不稳定性,促进轴突再生。然而在脊髓损伤后,有研究[4-5]采用微管稳定剂Taxol 或Epothilone B 稳定了逆行塌陷的微管,在损伤轴突顶端发现生长锥样的结构,再生能力得到改善。这些结果提示在中枢和周围神经、以及不同发育阶段的神经元中微管骨架的动态调控可能存在差异,且这种调控对损伤轴突再生能力有重要影响。
目前认为影响微管骨架稳定性和动态改变的因素主要包括:微管相关蛋白(microtubule associated proteins,MAPs),如tau、MAP2 等,可结合在微管网格上抑制微管解聚[6-7];微管的翻译后修饰,常见使微管稳定的乙酰化、去酪氨酸化、多聚谷氨酰化等,还有使微管动态不稳定的酪氨酸化等[8];微管切割蛋白,是一类以AAA 为特征的酶,可切断长微管产生短微管,增加动态性;马达蛋白Kinesin 和Dynein 等,它们以微管为轨道进行轴浆运输或通过在滑行的微管间产生力的作用,对微管骨架的组织起调节作用[9-10]。这些对微管骨架动态性产生调控作用的微管调控蛋白在神经元独特的细胞骨架系统稳定性和动态调节中发挥重要作用[11]。
因此,本研究旨在检测周围神经和中枢神经发育和损伤后酪氨酸化、去酪氨酸修饰的微管蛋白表达水平是否存在差异,为理解微管骨架动态重构能力与神经再生之间可能存在的关系提供实验依据。
1 材料与方法
1.1 动物 SPF 级Sprague-Dawley(SD)大鼠,由南通大学实验动物中心提供,本研究方案经南通大学实验动物伦理委员会审查批准(S20200330-005)。
1.2 海马神经元和背根神经节(dorsal root ganglion,DRG)神经元培养 孕18 d SD 大鼠常规麻醉消毒处理。超净台里取出胎鼠,在体视显微镜下,解剖取出海马区和DRG 备用。按照课题组之前的研究方法[12]分离、纯化神经元。过400 目筛网后,计数按照操作研究植入经Poly-L-Lysin 包被的皿中,4~6 h 后换Neurobasal 神经元培养基,16~18 h 后加入阿糖胞苷抑制胶质细胞增殖。
1.3 模型建立
1.3.1 大鼠脊髓挫伤模型的制备 动物随机分组,行大鼠脊髓挫伤。用复合麻醉剂(3 mg/kg)腹腔注射麻醉,在背侧后部作正中纵行切口,钝性分离至胸椎T9~T11椎骨棘突,剥离周围肌肉、筋膜,清洁手术视野。用眼科剪打开T9~T11中的一节椎板,使用脊髓损伤仪,用160 N 力打击脊髓,形成中等脊髓损伤模型。局部使用青霉素后逐层关闭切口。术后腹腔注射青霉素3 d,4 万U/(d·只-1),由南通大学实验动物中心代养。假手术组,直接暴露T9段脊髓后缝合皮肤。
1.3.2 大鼠坐骨神经夹伤模型的制备 动物随机分组,行大鼠坐骨神经夹伤术。使用复合麻醉剂腹腔注射麻醉,暴露左侧坐骨神经,在平行股骨处夹伤坐骨神经10 s×3 次,然后缝合皮肤。假手术组,直接暴露右侧坐骨神经后缝合皮肤。
1.4 Western Blot 分别取脊髓T9段上下1 cm 组织和坐骨神经中间段约1 cm 组织。加蛋白裂解液和蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(1∶100)混合液,冰上裂解5~10 min,匀浆。4 ℃条件,13 000 g 离心15 min。小心吸取上清液置于另一离心管中,并测定蛋白浓度,样品加6×上样缓冲液煮沸5 min,分装,-80 ℃保存备用。取等量蛋白进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),经转膜,5%脱脂牛奶封闭。一抗(α-tubulin 1∶1 000 Abcam 公司,ab18251;tyr-tubulin 1∶1 000 Abcam 公司,ab6160;detyr-tubulin 1∶1 000 Abcam 公司,ab24622)4 ℃过夜;二抗孵育;电化学发光(electrochemiluminescence,ECL)显色,X-光片压膜,扫描,ImageJ 分析。
1.5 活细胞摄像 原代培养海马神经元和DRG 神经元至第2 天,加入阿糖胞苷抑制胶质细胞,纯化神经元;待皿底长满后消化重新接种细胞至活细胞专用培养皿中,贴壁培养2 h 后,活细胞工作站连续拍摄10 h,5 min 记录1 次。实验重复3 次,统计神经元n=5,计算轴突生长速率。采用ImageJ Manual Tracking插件对细胞胞体的运动速率进行测量。
1.6 免疫细胞荧光 移除细胞培养基,每孔加入200 μL 固定液室温固定30 min,经磷酸缓冲盐溶液(phosphate buffer saline,PBS)室温洗涤,封闭,一抗(α-tubulin 1∶1 000 Abcam 公司,ab18251;tyr-tubulin 1∶1 000 Abcam 公司,ab6160;detyr-tubulin 1∶1 000 Abcam 公司,ab24622) 4 ℃过夜。次日,室温复温20 min,PBS 轻轻洗涤,二抗避光条件下室温孵育后,加入Hoechst 33342(5 μg/mL),室温孵育15 min,PBS 轻轻洗涤,荧光封片剂封片保存于暗盒内。Leica和蔡司荧光显微镜拍摄。使用Image Pro Plus 软件分析并进行统计。
1.7 统计学方法 应用GraphPad Prism5 对实验数据进行单因素方差分析,Student's t 检验和Pearson相关系数分析统计分析定位,P<0.05 表示差异有统计学意义。
2 结果
2.1 海马神经元和DRG 神经元体外培养过程中酪氨酸化、去酪氨酸化微管蛋白表达和定位 细胞免疫荧光结果显示,酪氨酸化修饰微管在DRG 神经元种植后1、3 d 的平均荧光强度分别为1.79±0.18、2.14±0.07。在海马神经元中分别为1.16±0.044,0.88±0.03。酪氨酸化修饰微管在DRG 神经元种植后1、3 d比海马神经元分别升高50%、120%(图1A~B)。去酪氨酸化修饰微管在DRG 神经元种植后1、3 d 的平均荧光强度分别为1.49±0.07、1.69±0.08。在海马神经元中分别为1.07±0.05、1.78±0.20。去酪氨酸化修饰微管在DRG 神经元种植后1 d 比海马神经元升高40%,3 d 时差异无统计学意义(图1C~D)。上述结果显示在神经元体外发育中,DRG 神经元中酪氨酸化和去酪氨酸化微管蛋白均维持较高水平,而海马神经元中去酪氨酸化微管蛋白表达有升高,但酪氨酸化微管蛋白表达较低。

图1 海马神经元和DRG 神经元体外发育中酪氨酸化、去酪氨酸化微管蛋白表达和定位
在海马神经元轴突顶端有典型的生长锥形态,酪氨酸化和去酪氨酸化微管蛋白增强较为明显;而DRG 神经元的生长锥较小,在胞体和突起均有较高表达,表明周围系统神经元中微管蛋白的酪氨酸化水平较高。
2.2 DRG 神经元和海马神经元划伤后细胞胞体及轴突生长情况比较 海马神经元和DRG 神经元贴壁培养,采用玻璃电极针进行神经元划伤(图2A),结果显示,神经元轴突划伤后,在0~20 h 期间,海马神经元和DRG 神经元轴突生长速率分别为(3.77±0.47) μm/h 和(2.99±0.20) μm/h,差异无统计学意义(P>0.05)(图2B);同时采用ImageJ Manual Tracking 插件测量细胞的运动速率,结果表明:在0~20 h 期间,DRG 神经元胞体运动速率为(5.72±0.54) μm/h,显著高于海马神经元(2.00±0.28) μm/h(P<0.05)(图2C~E)。

图2 DRG 神经元和海马神经元划伤后细胞胞体及轴突生长情况比较
2.3 脊髓和DRG 在发育过程中酪氨酸化、去酪氨酸化微管蛋白表达 Western Blot 结果显示,与出生后1 d(标化为1)相比,3、7、14 d 坐骨神经组织中酪氨酸化微管蛋白的表达水平较高,分别为1.36±0.08、1.75±0.01、1.60±0.06;而脊髓组织发育过程中,1、3、7、14 d 酪氨酸化微管蛋白的表达水平分别为2.07±0.07、1.52±0.09、1.20±0.08、0.91±0.04,呈明显下降的趋势(图3A~B)。与出生后1 d(标化为1)相比,3、7、14 d 坐骨神经组织中去酪氨酸化微管蛋白的表达水平分别为0.71±0.12、0.79±0.13、0.87±0.08;而脊髓组织发育过程中,1、3、7、14 d 去酪氨酸化微管蛋白的表达水平分别为0.68±0.08、0.66±0.05、0.71±0.08、0.77±0.09;差异无统计学意义(图3A、C)。
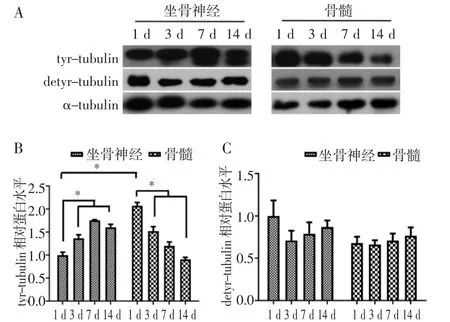
图3 坐骨神经和脊髓发育过程中酪氨酸化、去酪氨酸化修饰微管蛋白的表达比较
2.4 脊髓和坐骨神经损伤过程中酪氨酸化、去酪氨酸化微管蛋白表达 由于在发育过程中酪氨酸化、去酪氨酸化修饰微管蛋白差异表达,考虑在损伤后是否也存在着差异。对成年SD 大鼠进行坐骨神经夹伤及脊髓挫伤手术,提取坐骨神经和脊髓蛋白进行Western Blot 检测,结果发现坐骨神经夹伤和脊髓损伤后去酪氨酸化微管蛋白均有显著升高(图4A)。将Normal 标化为1,在坐骨神经夹伤后3、7 d 表达水平分别为1.48±0.08、1.60±0.13;而在脊髓挫伤后3、7 d表达水平分别为0.59±0.04、0.63±0.09(图4B~C)。以上结果显示,与脊髓在损伤后酪氨酸化微管蛋白表达相比,周围神经在损伤后酪氨酸化微管蛋白表达显著上调。

图4 坐骨神经夹伤和脊髓损伤后酪氨酸化、去酪氨酸化修饰微管蛋白的表达情况
3 讨 论
微管是细胞骨架中的一种重要组成成分,微管是由α/β-tubulin 亚基组成,微管发挥功能往往要经过翻译后修饰,因此微管蛋白的翻译后修饰是微管动态性调节的重要环节。其中酪氨酸化、去酪氨酸修饰是迄今研究最多的微管蛋白翻译后修饰形式[13]。细胞中绝大多数的α-tubulin 末端有一个酪氨酸化修饰残基,所以在细胞中游离的微管蛋白及新添加到微管正端的微管蛋白多是酪氨酸化修饰的。去酪氨酸化修饰则是对α-tubulin 蛋白发生的第1 个特异性修饰,甚至可以发生在α/β-tubulin 异二聚体形成之前。有报道[14]去酪氨酸化是由一类胞质羧肽酶负责完成的,不仅可以稳定微管蛋白,而且还能抵抗低温解聚和Nocodazole 的解聚作用,而微管蛋白酪氨酸连接酶在去酪氨酸化修饰后可以迅速添加1 个酪氨酸残基修饰,完成去酪氨酸化/酪氨酸化循环。因此酪氨酸化修饰的tubulin 则很不稳定,常被作为动态不稳定微管的标志物[15]。如果在去酪氨酸化后,αtubulin 的倒数第2 个C-末端尾上谷氨酸残基也被移走(Δ2-tubulin 修饰),就会阻止C 末端重新加上酪氨酸,这种修饰的微管非常稳定,且富集于中枢神经轴突微管[16]。所以推测中枢神经系统神经元中稳定微管含量较多,不能通过动态重构完成稳定/不稳定的转换,但目前文献中尚缺少直接的研究数据。
本研究发现无论是周围神经系统还是中枢神经系统的神经元在轴突生长过程中,去酪氨酸化修饰的微管蛋白都具有较高水平表达,且轴突损伤后再生速率差异也无统计学意义,表明在胚胎期的中枢和周围神经系统神经元都具有较强的轴突再生能力。然而周围神经系统神经元具有较强的动态调整微管骨架能力,不仅表现为其有高水平的不稳定微管修饰,还表现为DRG 神经元胞体有较强的运动性,可以观察到明显的胞体迁移,这与海马神经元胞体基本不发生位移有显著不同。文献[17]报道大部分微管在中心体处成核之后释放出胞体,但仍然有部分微管连接中心体,这在细胞的迁移过程中发挥很重要的作用。本研究结果发现DRG 神经元中高水平的酪氨酸化修饰微管,也支持其在胞体位移中发挥重要作用。因此,本研究较为系统地分析了周围神经系统和中枢神经系统发育和损伤再生过程中微管骨架动态重构能力的差异,从一个新的角度阐明了周围神经具有较强再生能力,同时也为促进轴突再生提供了新的靶点。
