双重吸附结合HPLC-MS/MS法测定生物基质中内源性组胺及组氨酸
2022-03-13黄浩然沈佳佳胡康睿李昌键王广基
黄浩然,沈佳佳,胡康睿,李昌键,谢 林,王广基,梁 艳
(中国药科大学江苏省药物代谢动力学重点实验室,南京 210009)
组胺是一种活性生物胺,其在外周组织中主要由肥大细胞和附近结缔组织中的嗜碱性粒细胞产生,参与过敏和炎症反应。而在大脑中组胺主要来源于组胺能神经元,可与G 蛋白偶联受体结合,介导多种生理功能[1]。组氨酸是组胺在体内的主要来源,在组氨酸脱羧酶(HDC)的作用下氧化脱羧生成组胺。
在神经科学领域,组胺作为一种神经递质受到日益关注。近年来,越来越多的研究发现组胺参与多种神经生理功能、神经免疫调节和中枢神经系统的发生发展[2-5]。Cacabelos 等[5]提出组胺的异常表达会导致神经炎症,且是神经变性和神经元过早死亡的加重因素。也有一些研究表明,组胺对脑缺血损伤有神经保护作用。Adachi 等[6]发现,在大鼠大脑中动脉闭塞(MCAO)模型中,缺血后给药组胺前体组氨酸可通过刺激中枢组胺H2受体而防止脑梗死的发生。此外,在脑缺血造模后2 个月中,组氨酸能在神经系统评分、认知能力评估和梗死区域面积方面体现出长期的脑保护作用[7]。为进一步探究组胺在中枢神经系统疾病中的作用,需要一种快速简便的方法同时测定脑组织以及血浆中组胺及其前体组氨酸的含量变化。
目前,组胺的检测方法有酶免疫分析法[8]、放射免疫分析法[9]、气质联用色谱法[10]、电化学检测[11]、荧光分析法[12]等。基于抗原抗体特异性结合的酶免疫分析法、放射免疫分析法,需要制备特异性的抗体,且不能同时对组氨酸进行检测;气相色谱法基质效应复杂,吸附导致峰拖尾和记忆效应,通常需要进行衍生化,操作复杂;电化学检测法受内源性物质干扰较大,灵敏度降低;荧光分析法需要进行荧光标记,且干扰因素多;而紫外检测器则灵敏度低。因此,本研究中,采用高效液相色谱与质谱联用的方法,首次用氨基柱对大鼠血浆以及脑组织中组胺及其前体组氨酸的含量进行测定。并且,为了降低测定过程中的基质干扰,首次对生物基质进行双重吸附,吸附后的基质能够用于标准曲线的配制,解决了内源性物质只能用人工血浆或者纯水作为空白基质,所得结果与真实情况存在一定差异的问题,为其他内源性物质提供了共性的检测技术。
1 材 料
1. 1 仪 器
LCMS-8050高效液相色谱-质谱联用仪、CBM-20A 系统控制器、LC-30AD 双泵、SIL-30AC 自动进样器、CTO-30A 柱温箱、电喷雾离子化接口的四极杆质谱检测器、LabSolutions LCMS Ver. 5. 6 色谱工作站、AUM120D 电子天平(日本Shimadzu 公司);Milli-Q Gradient A10 超纯水器(美国Millipore 公司);SorvallBiofuge Stratos 台式高速冷冻离心机(美国Thermo Fisher Scientific 公司)。
1. 2 试 剂
组氨酸(histidine,HIS)、组胺(histamine,HA)(合肥博美生物科技有限公司);活性炭(上海麦克林生化科技有限公司);2,5-二羟基苯甲酸(2,5-dihydroxybenzoic acid,DHB)、方解石(CaCO3)、甲醇(色谱纯)、乙腈(色谱纯)、甲酸(色谱纯)(美国Sigma-Aldrich公司);甲酸铵(上海易恩化学技术有限公司)。其他试剂均为市售分析纯。
1. 3 动 物
SD大鼠,雄性,体重(210±10)g,由浙江维通利华实验动物技术公司提供,合格证号:SCXK(浙)2019-0001。所有动物实验均符合动物伦理委员会标准。
2 方 法
2. 1 色谱条件
色谱柱为ODS-SPXBridge®Amide 柱(100 mm×4. 6 mm,3. 5 μm);流动A 为0. 1% 甲酸-1 mmol/L甲酸铵水,流动相B为乙腈;流速为0. 4 mL/min;柱温为40 ℃;进样室温度为4 ℃;线性梯度程序(A∶B):0 min(90∶10),0. 02 min(65∶35),3. 5 min(65∶35),4. 0 min(50∶50),4. 2 min(10∶90),4. 4 min(10∶90),4. 6 min(90∶10),6. 5 min(90∶10)。
2. 2 质谱条件
电喷雾离子源(ESI源);组胺和组氨酸的检测均采用正离子、多反应监测(MRM)模式:组氨酸监测离子质荷比为156. 0→110. 1,碰撞电压为-21. 0 eV,Q1偏差为-15. 0 V,Q3偏差为-21. 0 V;组胺监测离子质荷比为112. 1→95. 1,碰撞电压为-25. 0 eV,Q1偏差为-16. 0 V,Q3偏差为-17. 0 V;内标监测离子质荷比为153. 1→108. 2,碰撞电压为26. 0 eV,Q1 偏差为23. 0 V,Q3 偏差为19. 0 V。脱溶剂装置温度为250 ℃;加热块(block)温度为400 ℃;雾化气流速为3 L/min;干燥气流速为10 L/min。
2. 3 溶液配制
标准品储备液:精密称取组氨酸及组胺标准品5. 00 mg,于10 mL 量瓶中,以甲醇溶解定容,配制成相当于0. 5 mg/mL 的组氨酸及组胺储备液,置4 ℃冰箱中保存。
内标储备液:精密称取DHB 标准品5. 00 mg,置10 mL 量瓶中,以甲醇溶解定容,配制成相当于0. 5 mg/mL 储备液,置4 ℃冰箱中保存。
内标溶液:取内标溶液1 mL,置于10 mL 量瓶中,用甲醇溶解定容,配制成相当于50 μg/mL 的内标溶液。
2. 4 空白生物基质的配制
取大鼠血浆1 mL,加入活性炭30 mg 和方解石30 mg,2 000 r/min 振荡2 h,18 000 r/min 离心10 min,取上清液振荡5 min 后,18 000 r/min 离心10 min。取上清液,用于标准曲线的配制。脑组织匀浆同法。
2. 5 样品前处理
血浆样本的处理:取大鼠血浆50 μL,加入50 μg/mL 的内标溶液5 μL 及冰乙腈150 μL,振荡5 min,静置10 min,18 000 r/min 离心10 min 两次,取上清液5 μL进样并进行定量分析。
脑组织样本的处理:取大鼠脑组织0. 030 g,加入超纯水150 μL,在冰水浴中匀浆。取匀浆50 μL,加入50 μg/mL的内标溶液5 μL及冰乙腈150 μL,振荡5 min,静置10 min,18 000 r/min 离心10 min两次,取上清液5 μL进样并进行定量分析。
3 方法验证
3. 1 特异性
在本研究方法下组胺出峰时间为2. 8 min,组氨酸出峰时间约为3. 0 min,内标DHB 出峰时间约为3. 4 min。本研究考察了血浆和脑匀浆两种基质吸附后的空白以及不同浓度点样品色谱图,结果表明方法特异性好,待测物及内标不受其他物质干扰,结果见图1。
3. 2 标准曲线及定量下限
配制组氨酸浓度为200 μg/mL 及组胺浓度为10 μg/mL 的混合标准品溶液,用甲醇逐级稀释为系列对照品工作液。分别吸取上述系列对照品工作液5 μL于1. 5 mL洁净的Eppendorf管中,加入吸附后的大鼠空白血浆45 μL,混匀后即可得到为组氨酸质量浓度分别为20 000,10 000,2 000,1 000,200,100,20 ng/mL,组胺质量浓度分别为1 000,500,100,50,10,5,1 ng/mL的系列标准血浆样本。
配制组氨酸浓度为200 μg/mL 及组胺浓度为1 μg/mL 的混合标准品溶液,用甲醇逐级稀释为系列对照品工作液。分别吸取上述系列对照品工作液5 μL于1. 5 mL洁净的Eppendorf管中,加入吸附后的大鼠空白脑匀浆45 μL,混匀后即可得到为组氨酸浓度分别为20 000,10 000,2 000,1 000,200,100,20 ng/mL,组胺质量浓度分别为100,50,10,5,1,0. 5,0. 1 ng/mL的系列标准脑组织样本。
将得到的系列标准血浆样本及系列标准脑组织样本,分别按照“2. 5”项进行处理,用标准品和内标峰面积比(R)对标准品浓度c作线性回归(权重系数W = 1/c)。结果表明,血浆中组氨酸在20 ~20 000 ng/mL 范围内线性良好(r= 0. 999 0),定量下限为20 ng/mL,组胺在1 ~ 1 000 ng/mL 范围内线性良好(r= 0. 999 0),定量下限为1 ng/mL;脑匀浆中组氨酸在20 ~ 20 000 ng/mL 范围内线性良好(r= 0. 999 4),定量下限为20 ng/mL,组胺在0. 1 ~100 ng/mL 范围内线性良好(r= 0. 999 2),定量下限为0. 1 ng/mL。
3. 3 准确度和精密度
分别按“2. 5”项下方法配制含50 ng/mL组氨酸和5 ng/mL 组胺的标准血浆样本1、含500 ng/mL 组氨酸和50 ng/mL 组胺的标准血浆样本2、含1 000 ng/mL组氨酸和5 000 ng/mL组胺的标准血浆样本3。为考察批内和批间差异,3 个浓度均平行制备6 份,并连续测定3 个分析批以计算各血浆样品中组氨酸及组胺浓度。血浆的批内及3 日内批间差在85% ~ 115% 之间。脑组织的准确度和精密度实验参照血浆。脑组织的批内及3 日内批间差在85% ~ 115%之间。结果见表1。

Figure 1 Representative MRM chromatograms of a blank plasma sample after absorption (A); a blank plasma sample after absorption spiked with histidine (HIS) and histamine (HA) (5. 0 ng/mL) (B); a blank plasma sample after absorption spiked with HIS and HA (50. 0 ng/mL) (C); a blank brain matrix sample after absorption (D); a blank brain matrix sample after absorption spiked with HIS and HA (5. 0 ng/mL) (E) and a blank brain matrix sample after absorption spiked with HIS and HA (50. 0 ng/mL) (F)

Table 1 Precision and accuracy of HIS and HA in plasma and brain matrix (n = 6)
3. 4 基质效应和回收率
取吸附后大鼠空白血浆45 μL,并加入3 个不同浓度的组氨酸及组胺标准品溶液5 μL,3 个浓度均平行制备6 份,进样后得峰面积A;另取吸附后大鼠空白血浆45 μL,根据“2. 5”项用冰乙腈预先处理,向其中加入3 个浓度的组氨酸及组胺标准品溶液5 μL,3 个浓度均平行制备6 份,进样后得峰面积B;使用超纯水45 μL 代替空白血浆,根据“2. 5”项用冰乙腈预先处理,向其中加入3 个浓度的组氨酸及组胺标准品溶液5 μL,3 个浓度均平行制备6 份,进样得到峰面积C。提取回收率=A/B × 100%,基质效应= B/C× 100%。血浆经该方法处理后基质效应不明显,回收率在可接受范围内(>75%)。脑组织的基质效应实验过程参照血浆。脑组织经该方法处理后基质效应不明显,回收率在可接受范围内(>75%)。结果见表2。
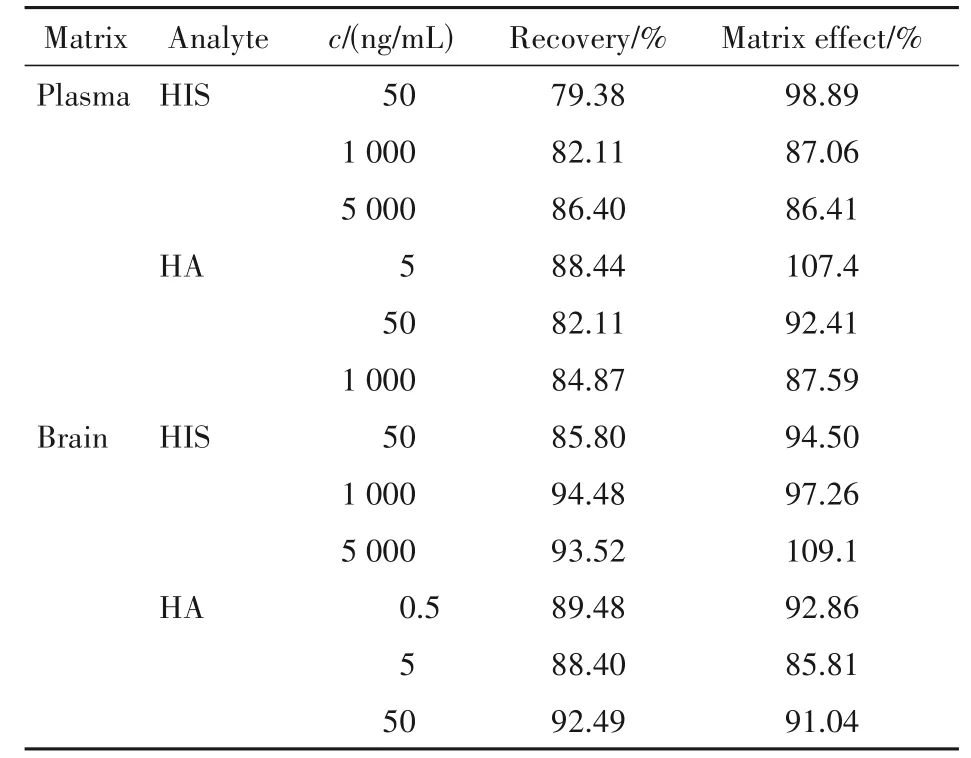
Table 2 Matrix effect and recovery rate of HIS and HA in plasma and brain matrix (n = 6)
3. 5 稳定性
血浆样本室温放置稳定性考察:分别取空白血浆45 μL,加入不同浓度组氨酸及组胺标准品5 μL,混匀后在室温条件下放置12 h,根据“2. 5”项进行操作,检测大鼠血浆中组氨酸及组胺浓度。
血浆样本自动进样器中稳定性考察:组氨酸及组胺血浆样本处理后,放置在自动进样器中(4 ℃)达24 h后检测组氨酸及组胺浓度。
血浆样本反复冻融稳定性考察:分别取空白血浆45 μL,加入不同浓度组氨酸及组胺标准品5 μL,混匀后反复冻融3 次,根据“2. 5”项进行操作,检测组氨酸及组胺浓度。
血浆样本长期冷冻稳定性考察:分别取空白血浆样本45 μL,加入不同浓度组氨酸及组胺标准品5 μL,混匀后置于-70 ℃冰箱冷冻14 d,根据“2. 5”项进行操作,检测组氨酸及组胺浓度。
脑样本稳定性考察同血浆样品。
结果如表3 所示,组氨酸及组胺在血浆和脑组织匀浆液中室温放置12 h,超低温冷冻(-60 ~-80 ℃)~解冻(37 ℃)3 次循环,超低温(-60 ~-80 ℃)冻存14 d,样品处理后进样盘放置24 h 均稳定(相对偏差RE小于± 15%)。
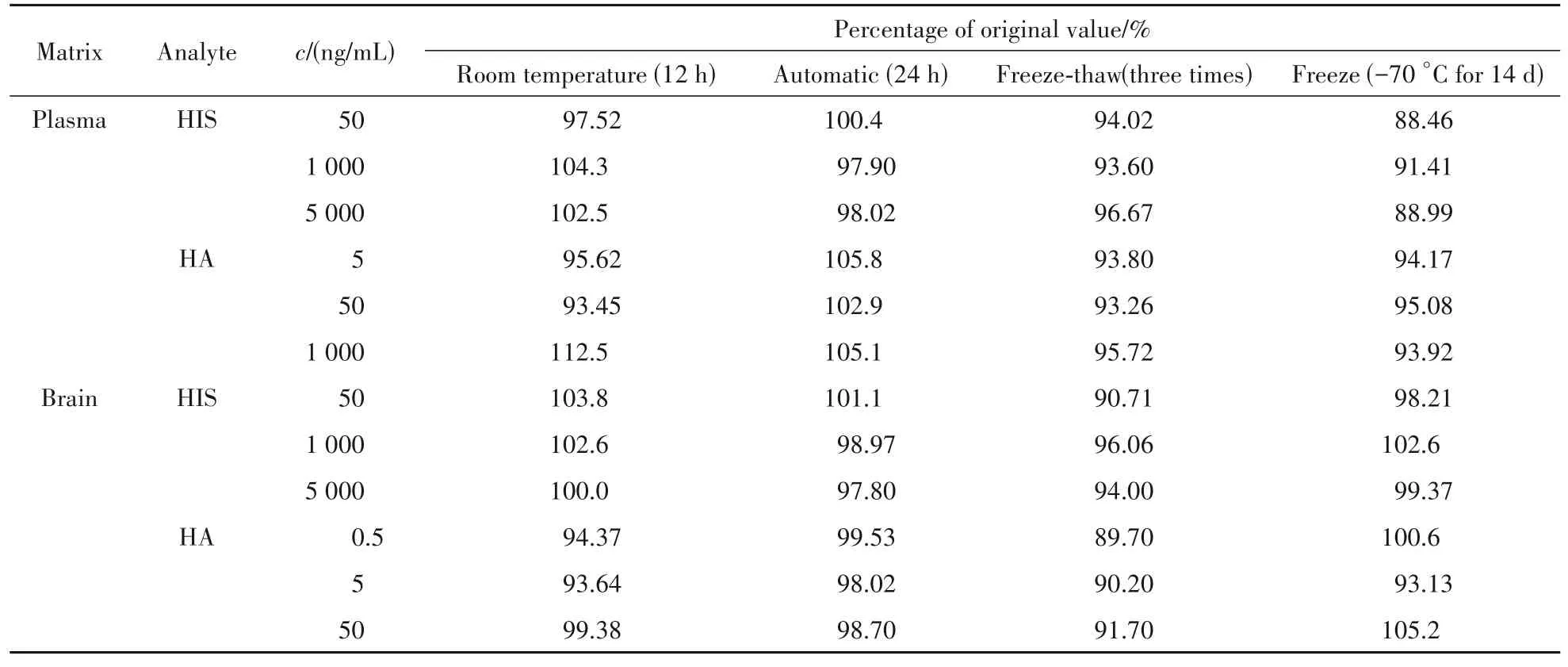
Table 3 Stability of HIS and HA in plasma and brain matrix (n = 6)
3. 6 方法应用
本研究通过脑中动脉闭塞(MCAO)建立大鼠缺血性脑卒中模型,验证所建立方法在检测组胺及组氨酸变化方面的可行性,并初步阐明与脑损伤相关的靶点。分布选取MCAO 术后24 h 大鼠及假手术大鼠各6 只,取血浆和大脑,对脑组织进行分区,取皮质、海马和纹状体3 个区域,按照“2. 5”项进行处理,取上清液5 μL 进样分析。如图2 所示,与假手术组相比,MCAO 模型大鼠血浆、皮质、海马和纹状体中组胺浓度均明显升高,而组氨酸水平在血浆、皮质、纹状体中显著升高。
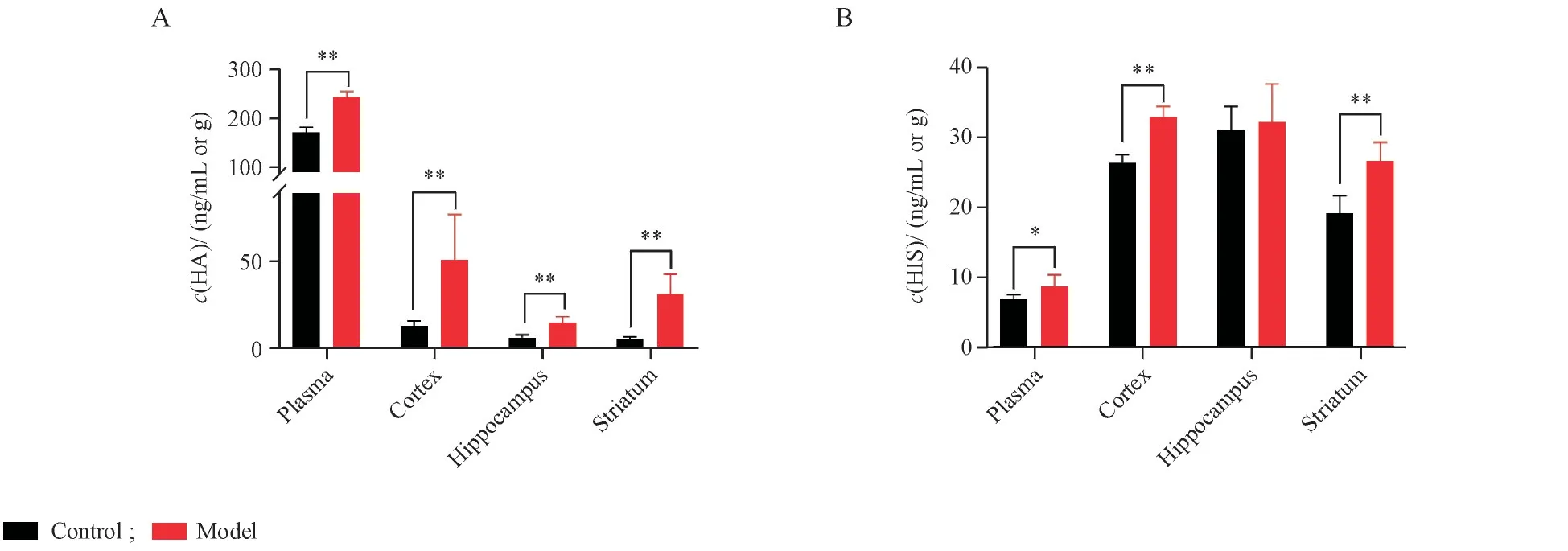
Figure 2 Concentrations of HIS and HA in plasma, cortex, hippocampus and striatum in sham-operated and middle cerebral artery occlusion(MCAO) model rats(±s, n = 6)
4 讨 论
4. 1 空白生物基质的制备
组胺和组氨酸都是维持人体健康的重要生物活性分子。由于其具有内源性的特点,所以缺乏真实的空白基质来制备标准曲线。在一些报道中,将含5% 牛血清白蛋白的磷酸盐缓冲盐水溶液作为模拟空白血浆基质[13]。然而,配方基质与真实基质还是具有一定差异,真实基质中存在的各种盐、蛋白质、脂类和微量元素,可能导致定量结果存在较大偏差。因此,考虑对空白组织中组胺及组氨酸进行吸附。
活性炭具有较高的热稳定性和化学稳定性,并能与多种化合物形成表面官能团,是最常见、应用最广泛的吸附剂之一[14]。方解石是一种碳酸钙矿物,有报道称氨基酸与矿物质表面存在相互作用,可以通过静电引力、疏水作用、共价键和氢键等方式相互吸收[15]。故以峰面积为标准,考察了分别添加活性炭、方解石以及活性炭和方解石对基质中组胺和组氨酸吸附的效果,结果表明同时添加活性炭30 mg 和方解石30 mg 吸附效果最好。吸附后的生物基质能够用于标准曲线的制备及真实样品分析。
4. 2 色谱柱的选择
氨基柱以氨丙基键合硅胶为填料,可用于正相色谱,也可用于反相色谱分析,在高有机相比例下可作为亲水相互作用色谱柱进行分析,应用广泛。其与ODS 色谱柱相比更适用于极性大的小分子物质,并广泛应用于糖类的分析。本研究首次选用ODS-SPXBridge®氨基色谱柱对组胺和组氨酸进行分析,待测物峰型良好,灵敏度高。
4. 3 方法应用
组胺无法通过血-脑脊液屏障,脑内组氨酸脱羧是组胺的唯一来源。在探究组胺在一些中枢神经系统疾病中的作用时,研究人员通常经口给予动物组氨酸,以增加脑内组胺含量。然而,组氨酸本身为必需氨基酸,在体内含量很高,额外补充组氨酸能否提高脑内组氨酸水平,进而增加组胺生成,有待考察。本研究首次建立一种能够同时测定大鼠体内组胺及其前体组氨酸含量的方法,方法的应用将有助于进一步探究组胺以及组氨酸在中枢性疾病中的作用。
在各种中枢神经系统疾病中,缺血性脑卒中是导致死亡的主要原因,也是导致长期残疾的主要原因,其症状主要涉及运动功能障碍和记忆衰退。大脑皮质上分布着数百亿个神经元,是调节躯体运动的最高级中枢;纹状体是控制运动的关键区域,纹状体功能障碍会导致严重的运动障碍[16];而海马体是人体的记忆系统。因此,本研究重点测定了这3 个脑区及血浆中组胺及组氨酸水平。结果表明,与假手术组相比,MCAO 模型大鼠血浆、皮质、海马和纹状体中组胺浓度均明显升高,而组氨酸水平在血浆、皮质、纹状体中显著升高。组胺在脑中作为一种神经递质可以调控4 种组胺受体,其上调的具体病理意义将有待进一步研究。此外,脑内组氨酸含量是血浆组氨酸含量的3倍左右,而脑组胺仅不到血浆中组胺水平的十分之一。因此,推测急性缺血性脑卒中导致血-脑脊液屏障受损,血浆中组胺大量进入脑内可能为脑组胺水平暂时升高的原因之一。
5 总 结
运用氨基柱和生物基质吸附的方式,建立一种高效液相色谱-串联质谱方法,能够同时定量大鼠血浆和脑组织匀浆两种生物基质中组胺及其前体组氨酸。该方法前处理方式简单,无需衍生化,符合生物样本分析要求,已用于实际样本分析。
