高血压性脑出血病人同型半胱氨酸与微出血的相关性
2022-03-13初敏刘丽君李宏高迪杨艳红滕继军
初敏 刘丽君 李宏 高迪 杨艳红 滕继军

[摘要] 目的 探讨血清同型半胱氨酸(Hcy)与高血压性脑出血(HICH)病人脑微出血(CMBs)的相关性。方法 选取2017年10月—2019年6月在我科住院HICH病人168例,根据磁敏感加权成像将病人分为CMBs阳性组和CMBs阴性组,比较两组病人入院时一般临床资料、实验室指标及影像学指标,利用Logistic回归模型分析HICH病人发生CMBs的相关危险因素。根据CMBs病灶个数、部位不同进行严重程度及部位分组,分析Hcy与CMBs的相关性。进一步分析H型HICH病人(血清Hcy≥10 μmol/L)CMBs的发病特点。结果 168例HICH病人中,CMBs阳性组102例(60.7%),CMBs阴性组66例(39.3%)。CMBs阳性组共发现823个CMBs病灶,位于深部467个(56.7%),脑叶195个(23.7%),幕下161个(19.6%)。CMBs阳性组病人吸烟史构成比、脑白质病变(WML)构成比、收缩压、舒张压、血清Hcy水平均高于CMBs阴性组,而低密度脂蛋白水平低于CMBs阴性组,差异有统计学意义(χ2=4.694、5.381,t=-4.327~2.500,P<0.05)。Logistic回歸分析显示,收缩压(OR=1.036,95%CI=1.004~1.068,P=0.026)、WML(OR=2.791,95%CI=1.068~7.290,P=0.036)、Hcy水平(OR=1.089,95%CI=1.014~1.170,P=0.019)是CMBs的独立危险因素。血清Hcy水平与CMBs严重程度呈正相关(r=0.278,P<0.01),不同部位CMBs各组血清Hcy水平比较差异无统计学意义(P>0.05)。H型HICH病人总的及深部CMBs的发生率明显高于非H型HICH病人(χ2=5.085、4.992,P<0.05),而两组间脑叶及混合CMBs发生率比较差异无显著性(P>0.05)。结论 在HICH病人中,CMBs于深部分布的频率最高。血清Hcy水平是HICH病人发生CMBs的独立危险因素,且与HICH病人CMBs的严重程度呈正相关。H型HICH病人CMBs发生率较高,且以发生在深部更常见。Hcy可能是缓解CMBs不良临床结局的潜在治疗靶点。
[关键词] 高半胱氨酸;微出血;颅内出血,高血压性;数据相关性
[中图分类号] R743.34
[文献标志码] A
[文章编号] 2096-5532(2022)01-0089-06
doi:10.11712/jms.2096-5532.2022.58.012
脑微出血(CMBs)是由于脑小血管壁损害,血管内红细胞等成分渗出至周围血管间隙而导致的含铁血黄素等物质沉积于脑实质内的一种亚临床病变,在磁敏感加权成像(SWI)中表现为直径为2~10 mm的低信号圆形或椭圆形病变[1]。随着影像学技术的发展,CMBs检出率越来越高,该病与痴呆、卒中的发病密切相关,造成了极大的社会负担。目前对于CMBs危险因素的研究涉及血压、吸烟史、年龄、卒中史、生化指标等方面,近年来发现同型半胱氨酸(Hcy)是CMBs的重要危险因素[2]。Hcy可能通过直接毒性作用、炎症和氧化应激作用造成血管内皮功能障碍,促进CMBs发生。多发CMBs提示微血管损伤达到一定程度,出血风险明显增高,CMBs在脑出血中的发生率高达20%~70%[3]。脑出血占所有类型卒中的10%~30%,发病1个月内其病死率高达30%~55%,而高血压性脑出血(HICH)占脑出血的70%~80%[4]。在部分脑出血病人的治疗中,单纯降压治疗并未取得理想的效果,且目前尚缺乏针对这类病人行之有效的治疗措施,而警惕Hcy水平的升高可能成为治疗此类病人的关键。迄今为止,Hcy与CMBs相关性的研究主要集中在脑梗死病人,均为小样本研究,且存在争议。本研究旨在通过研究HICH病人血清Hcy水平与CMBs的关系,进一步探讨CMBs可能的危险因素,以及在H型HICH病人中CMBs与Hcy的关系及其分布特点。
1 资料与方法
1.1 研究对象选择
连续选取2017年10月—2019年6月于我科住院的符合纳入排除标准的HICH病人168例。纳入标准:年龄≥18岁;符合脑出血的临床诊断标准[5],发病1周内经颅脑CT检查证实为急性脑出血;有高血压病史或在住院期间非同日连续测量血压3次均为高血压(收缩压(SBP)≥18.62 kPa或舒张压(DBP)≥11.97 kPa);入院24 h内完善Hcy及常规血液实验室检查。排除标准:严重的心、肝、肾、甲状腺功能障碍以及恶性肿瘤病人;正在服用叶酸、B族维生素和抗凝药物的病人;既往有免疫系统疾病、血液系统疾病者;不能配合实验室或MRI检查者;其余原因所致出血,如外伤、动脉瘤、烟雾病及淀粉样血管病等;有肺结核、梅毒、结缔组织病等引起血管损害的明确病史。
1.2 基线资料收集
详细记录病人入院时的一般临床资料、实验室指标及影像学指标。一般临床资料包括年龄、性别、SBP、DBP、卒中危险因素(糖尿病、高脂血症、吸烟史、饮酒史)、疾病前用药(抗栓药物及他汀类药物应用史);实验室指标包括入院24 h内采集空腹静脉血测定的三酰甘油(TG)、总胆固醇(TC)、肌酐(Cr)、尿素氮(BUN)、纤维蛋白原(Fbg)、活化部分凝血活酶时间(APTT)、空腹血糖(FBG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)和Hcy;影像学指标包括CMBs和脑白质病变(WML)。
1.3 影像学诊断标准
CMBs影像学诊断标准:CMBs在磁共振梯度回波T2*加权成像(GRE-T2*WI)或SWI中表现为小圆形或卵圆形、边界清楚、均质性低信号病灶(一般2~5 mm大小,最大不超过10 mm),而且在T1、T2像的相应部位未显示高信号,同时注意鉴别钙铁沉积、骨头及血管流空和外伤弥漫性轴索损伤等与微出血有相似影像学特点的结构[6]。根据CMBs病灶数量分为3级:1级,病灶数量为1~2个;2级,病灶数量为3~10个;3级,病灶数量≥10个。按照MARS量表[7]将CMBs的位置分为脑叶(皮质和皮质下区域)、深部(基底核、丘脑、内囊、外囊、深部及室周脑白质)和幕下(小脑、脑干)。
WML影像学诊断标准:是指脑室周围或皮质下深部白质的病变,在T2WI和FLAIR中表现为高强度,可根据Fazekas量表评估其严重程度[8]。
以上影像学诊断由两名不知晓研究目的的影像学医师阅片,意见不同时,由第三位影像学专家决定。
1.4 研究方法
根据SWI将病人分为CMBs阳性组和CMBs阴性组,比较两组病人入院时的一般临床资料、实验室指标以及影像学指标,利用Logistic回归模型分析HICH病人發生CMBs的相关危险因素。根据CMBs病灶数量、位置不同进行严重程度及部位分组,分析Hcy与CMBs的相关性。进一步分析H型HICH病人(血清Hcy≥10 μmol/L)CMBs的发病特点。
1.5 统计学分析
采用SPSS 25.0软件进行统计学分析。计量资料先行Shapiro-Wilk正态性检验,若符合正态分布,则以[AKx-D]±s形式表示,两组间比较采用t检验;若不符合正态分布,则以中位数(四分位数)表示,两组间比较采用Mann-Witney U检验。计数资料以例数和百分比表示,组间比较采用卡方检验。采用Logistic回归模型分析CMBs的独立危险因素。血清Hcy水平与CMBs严重程度的相关性检验采用Spearman相关性分析,不同部位CMBs各组血清Hcy水平比较采用KW检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组基线资料比较
纳入的168例病人,男性99例(58.9%),女性69例(41.1%);平均年龄61岁;均有高血压病史;病程0.1~25.0年;60例(35.7%)病人有规律吸烟史,60例(35.7%)病人有规律饮酒史,21例(12.5%)病人有糖尿病史,52例(31.0%)病人有高脂血症史。CMBs阳性组102例(60.7%),CMBs阴性组66例(39.3%)。CMBs阳性组病人吸烟史构成比、WML构成比、SBP、DBP、血清Hcy水平均高于CMBs阴性组,而LDL水平低于CMBs阴性组,差异有统计学意义(χ2=4.694、5.381,t=-4.327~2.500,P<0.05)。两组其他指标比较差异无显著性(P>0.05)。见表1。
2.2 CMBs危险因素的回归分析
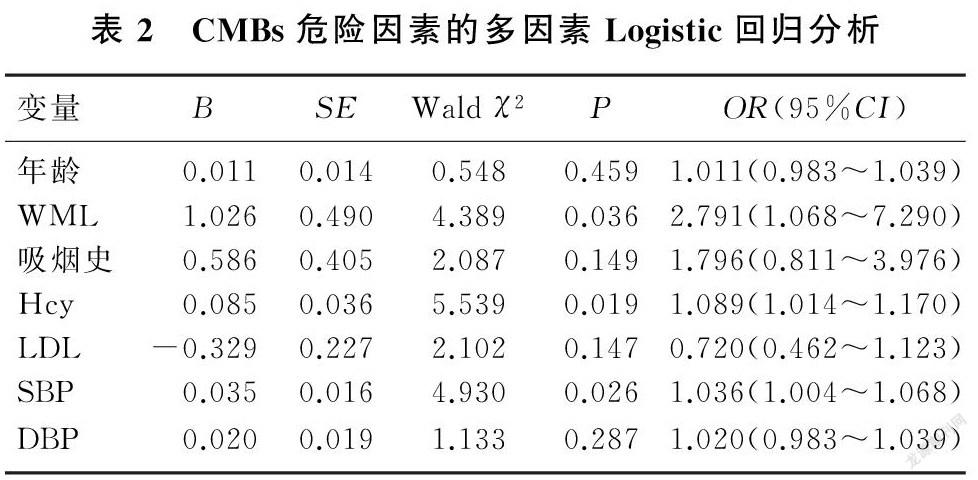
以CMBs为因变量,将单因素分析中P<0.1的变量(包括年龄、WML、吸烟史、血清Hcy、LDL、SBP及DBP)纳入多因素Logistic回归分析显示,血清Hcy水平(OR=1.089,95%CI=1.014~1.170,P=0.019)、SBP(OR=1.036,95%CI=1.004~1.068,P=0.026)和WML(OR=2.791,95%CI=1.068~7.290,P=0.036)是HICH病人发生CMBs的独立危险因素。见表2。
2.3 CMBs区域分布特点
CMBs阳性组共发现823个CMBs病灶,每例病人CMBs病灶数量1~30个。以病例数计算,CMBs好发部位依次为深部81例(79.4%),脑叶57例(55.9%),幕下47例(46.1%);以病灶数量计算,CMBs好发部位依次为深部467个(56.7%),脑叶195个(23.7%),幕下161个(19.6%)。
2.4 CMBs分级和血清Hcy水平的关系
根据严重程度将CMBs分为1~3级,其血清Hcy水平分别为(12.44±3.73)、(17.56±11.81)和(21.43±13.78)μmol/L。Spearman相关分析显示,血清Hcy水平与CMBs严重程度呈正相关(r=0.278,P<0.01)。
2.5 CMBs位置和血清Hcy水平的关系
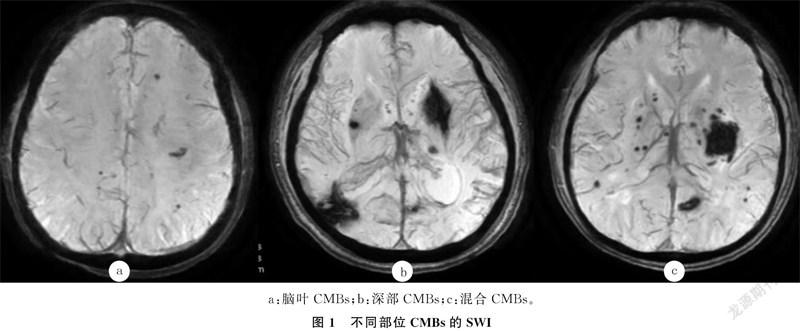
根据病灶位置将CMBs分为脑叶组(10例)、深部组(52例)以及混合组(40例,在收集的资料中没有单纯位于幕下的CMBs),3组的血清Hcy水平分别为(12.70±3.51)、(19.44±14.07)和(17.34±10.57)μmol/L。KW检验(数据方差不齐)显示,不同部位CMBs各组血清Hcy水平比较差异无统计学意义(P>0.05)。见图1。
2.6 H型HICH病人CMBs分布特点
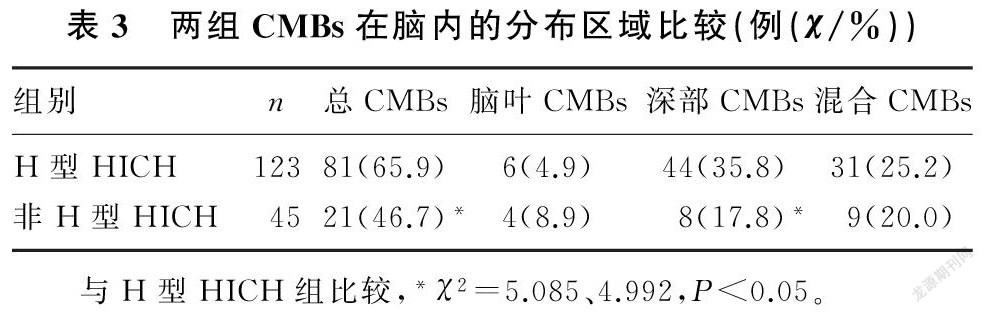
将HICH病人按照血清Hcy水平分为H型HICH组(Hcy≥10 μmol/L)和非H型HICH组(Hcy<10 μmol/L)。H型HICH组总的及深部CMBs的发生率明显高于非H型HICH组(χ2=5.085、4.992,P<0.05),而两组间脑叶以及混合CMBs的发生率比较差异无显著性(χ2=0.947、0.492,P>0.05)。见表3。
3 讨 论
3.1 HICH病人CMBs的分布及发生率
本研究中CMBs在丘脑及基底核(56.7%)出现的频率最高,而HICH也好发于丘脑和基底核,提示两者可能有共同的病理生理学基础,在CMBs发生的相同位置可能会诱发脑出血。既往的研究也表明,脑出血的发病部位和CMBs分布部位相似[9]。一般认为,基底核-丘脑区的供血动脉为深穿支动脉,在高血压作用下,深穿支动脉易弯曲、螺旋化,同时豆纹动脉等于大动脉近端呈近乎直角分出,长期受高血压作用易发生动脉粥样硬化及动脉瘤,更易发生血液外漏形成CMBs病灶[10]。CMBs不仅会在脑出血病人中检测到,还可以在缺血性卒中病人中检测到,甚至存在于一部分健康的老年人中[11]。本研究中HICH病人CMBs的检出率为60.7%,而既往研究结果显示脑出血病人CMBs的检出率为20%~70%[3],造成差异的原因可能是由于纳入人群的年龄、疾病严重程度不同所致。
3.2 血清Hcy水平与HICH病人CMBs的关系
在心脑血管疾病中,高Hcy血症是一个重要的危险因素,多数研究认为Hcy与脑小血管病独立相关[12-14]。CMBs作为脑小血管病的一种,其与Hcy的关系越来越受到关注,但研究结果仍存在争议,部分研究结果支持Hcy与CMBs相关[2,15]。本研究在除外潜在的影响因素后Logistic回归分析结果显示,高血清Hcy水平是CMBs的独立危险因素。高Hcy血症在健康人群中患病率为5%~7%,在血管相关疾病病人中患病率可达25%[16]。本研究中,73.2%的HICH病人存在高Hcy血症,其比例低于有关文献报道[17],这可能与研究的样本量较小有关。本研究结果显示,血清Hcy水平与CMBs严重程度呈正相关,即Hcy水平越高,发生CMBs的风险越大;不同部位CMBs病人血清Hcy水平比较差异无显著性。这与WANG等[2]的研究结果相似。
日本的一項研究结果显示,血清Hcy水平升高和WML程度相关,但与CMBs无关[18]。多项针对缺血性卒中的研究结果表明,Hcy是CMBs的独立危险因素,Hcy致CMBs的主要机制可能为直接毒性作用、氧化应激作用、促进血管平滑肌增殖导致血管内皮功能失调等[19]。目前针对HICH人群Hcy和CMBs关系的研究较少,且研究未得到一致结论,仍需进一步的动物实验研究及大规模前瞻性研究。
3.3 其他因素与HICH病人CMBs的关系
目前对于CMBs和高血压相关性的结论较为一致,IGASE等[20]报道CMBs与SBP呈正相关,FAN等[21]报道CMBs与DBP呈正相关,STAALS等[22]报道CMBs在高血压病人中的发生率高于血压正常的病人。本研究结果也显示,SBP是CMBs的独立危险因素。高血压导致CMBs的病理学改变主要为小血管脂质样变和微动脉瘤的形成,而高血压作为脑出血的高危因素,引起脑出血的相关病理改变也与此有关。长期高血压的影响,会使毛细血管稀疏扭曲,导致静脉顺应性降低,小动脉和毛细血管长期处于高压状态,血管壁的平滑肌易被纤维组织和坏死组织代替,管壁弹性减弱,引起脑小血管壁破坏或者微动脉瘤形成,从而造成血液屏障破坏及血液外渗,最终形成以CMBs为特征的脑小血管病变,故CMBs可以被解释为慢性高血压引起的一种靶器官损伤。
脑白质疏松(LA)是一种慢性退行性脑小血管病。相关研究表明,LA和CMBs的发生及严重程度呈正相关[23]。本文研究结果也显示,WML是CMBs的独立危险因素。韩国的一项针对自发性脑出血的研究结果表明,LA与脑出血密切相关[24],而CMBs也被认为是脑出血病人的独立危险因素。LA和CMBs有着诸多相同的危险因素,发病机制均与脑部血流动力学改变相关,两者可能是相同因素作用下不同的病理结果。但两者之间的关系仍需大规模前瞻性研究来证实。虽然本研究中两组间年龄比较差异无统计学意义,但CMBs阳性组平均年龄高于CMBs阴性组,在一定程度上说明随着年龄的增长,CMBs发生率呈上升趋势,这与国外有关研究结果一致[25]。
3.4 H型HICH病人CMBs分布特点
研究证实,我国高血压病人普遍存在高Hcy血症,为强调其危害性,胡大一等[26]首次提出H型高血压的概念,即高血压合并Hcy≥10 μmol/L。一项多中心研究显示,我国成年高血压病人中伴有高Hcy血症者约占75%(男性91%,女性60%)[27],本研究中H型高血压与非H型高血压例数之比为123∶45,比例与之接近。目前尚无研究探讨H型HICH这一特定人群与CMBs的关系。在何鸣皓等[17]对于H型高血压合并不同类型脑卒中人群的研究中,H型高血压病人CMBs发生率为55.86%。在本研究中,H型HICH病人CMBs的发生率为69.1%,相较于上述研究CMBs检出率高的原因,一方面是目前SWI检出CMBs的敏感性提高,另一方面是脑出血病人CMBs发生率高于脑梗死病人,且高血压促进了CMBs的发生。
本研究结果显示,相较于非H型HICH病人,H型HICH病人深部CMBs的发生率远高于脑叶及混合部位。MIWA等[28]研究指出,不同部位的CMBs发病机制可能不同,深部CMBs可能与高血压所致血管壁透明脂样变有关,脑叶CMBs可能与β淀粉样物质沉积损害相关。本研究中H型HICH病人深部CMBs的发生率远高于皮质-皮质下及幕下,出现这一结果的原因可能为:高血清Hcy水平可以抑制内源性硫化氢活化血管紧张素转化酶,从而使血管紧张素生成增多,导致血压更高,高Hcy血症和高血压的协同作用促使了CMBs在深部发生率更高[29]。
本研究存在以下不足:①本研究为单中心研究,样本量较少;②根据波士顿诊断标准尽可能排除脑淀粉样变性相关脑出血病人,纳入了有高血压病史的脑出血病人,但没有进行脑组织病理学检查,纳入病人可能极少数合并脑淀粉样变性;③未对病人的预后进行长期随访观察。故本文结论仍需要大规模前瞻性研究来证实。
综上所述,HICH病人CMBs主要分布在深部,与其脑出血好发位置一致;SBP、WML、Hcy水平是HICH病人发生CMBs的独立危险因素;H型HICH病人CMBs发生率较高,且以发生在深部更常见。为防止CMBs不良结局的发生及改善预后,临床工作中要控制血压,注意WML的发生,更要将血清Hcy水平监测纳入日常工作中,Hcy可能成为CMBs和HICH病人有力的治疗靶点。
[参考文献]
[1]LI Q, YANG Y, REIS C, et al. Cerebral small vessel disease[J]. Cell Transplantation, 2018,27(12):1711-1722.
[2]WANG B R, OU Z, JIANG T, et al. Independent correlation of serum homocysteine with cerebral microbleeds in patients with acute ischemic stroke due to large-artery atherosclerosis[J]. Journal of Stroke and Cerebrovascular Diseases, 2016,25(11):2746-2751.
[3]LEE J, SOHN E H, OH E, et al. Characteristics of cerebral microbleeds[J]. Dementia and Neurocognitive Disorders, 2018,17(3):73-82.
[4]GREENBERG S M, ENG J A, NING M M, et al. Hemorrhage burden predicts recurrent intracerebral hemorrhage after lobar hemorrhage[J]. Stroke, 2004,35(6):1415-1420.
[5]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国脑出血诊治指南(2014)[J]. 中华神经科杂志, 2015,48(6):435-444.
[6]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国脑小血管病诊治共识[J]. 中华神经科杂志, 2015,48(10):838-844.
[7]GREGOIRE S M, CHAUDHARY U J, BROWN M M, et al. The Microbleed Anatomical Rating Scale (MARS): reliability of a tool to map brain microbleeds[J]. Neurology, 2009,73(21):1759-1766.
[8]FAZEKAS F, KLEINERT R, OFFENBACHER H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities[J]. Neurology, 1993,43(9):1683-1689.
[9]LEE S H, BAE H J, KWON S J, et al. Cerebral microbleeds are regionally associated with intracerebral hemorrhage[J]. Neurology, 2004,62(1):72-76.
[10]LIU W H, LIU R, SUN W, et al. Different impacts of blood pressure variability on the progression of cerebral microbleeds and white matter lesions[J]. Stroke, 2012,43(11):2916-2922.
[11]BRIEGER D, AMERENA J, ATTIA J R, et al. National Heart foundation of australia and cardiac society of australia and New Zealand: Australian clinical guidelines for the diagnosis and management of atrial fibrillation 2018[J]. The Medical Journal of Australia, 2018,209(8):356-362.
[12]LOW A, MAK E, ROWE J B, et al. Inflammation and cerebral small vessel disease: a systematic review[J]. Ageing Research Reviews, 2019,53:100916.
[13]NAM K W, KWON H M, JEONG H Y, et al. Serum homocysteine level is related to cerebral small vessel disease in a healthy population[J]. Neurology, 2019,92(4):e317-e325.
[14]唐榮盛,邹宏丽,欧爱春,等. 脑小血管病轻度认知损害与血清炎性因子的相关性[J]. 青岛大学学报(医学版), 2019,55(4):415-418.
[15]OVBIAGELE B, LIEBESKIND D S, PINEDA S, et al. Strong independent correlation of proteinuria with cerebral microbleeds in patients with stroke and transient ischemic attack[J]. Archives of Neurology, 2010,67(1):45-50.
[16]YE Z C, ZHANG Q Z, LI Y, et al. High prevalence of hyperhomocysteinemia and its association with target organ damage in Chinese patients with chronic kidney disease[J]. Nutrients, 2016,8(10):E645.
[17]何鸣皓,韦铁民,傅慎文,等. H型高血压与脑微出血的相关性研究[J]. 中国现代医生, 2020,58(26):41-45.
[18]NAKA H, NOMURA E, TAKAHASHI T, et al. Plasma total homocysteine levels are associated with advanced leukoa-raiosis but not with asymptomatic microbleeds on T2*-weighted MRI in patients with stroke[J]. European Journal of Neurology, 2006,13(3):261-265.
[19]SHOAMANESH A, PREIS S R, BEISER A S, et al. Inflammatory biomarkers, cerebral microbleeds, and small vessel disease: framingham heart study[J]. Neurology, 2015,84(8):825-832.
[20]IGASE M, TABARA Y, IGASE K, et al. Asymptomatic ce-rebral microbleeds seen in healthy subjects have a strong association with asymptomatic lacunar infarction[J]. Circulation Journal: Official Journal of the Japanese Circulation Society, 2009,73(3):530-533.
[21]FAN Y H, ZHANG L, LAM W W, et al. Cerebral microbleeds as a risk factor for subsequent intracerebral hemorrhages among patients with acute ischemic stroke[J]. Stroke, 2003,34(10):2459-2462.
[22]STAALS J, VAN OOSTENBRUGGE R J, KNOTTNERUS I L H, et al. Brain microbleeds relate to higher ambulatory blood pressure levels in first-ever lacunar stroke patients[J]. Stroke, 2009,40(10):3264-3268.
[23]YANG Q, YANG Y, LI C Y, et al. Quantitative assessment and correlation analysis of cerebral microbleed distribution and leukoaraiosis in stroke outpatients[J]. Neurological Research, 2015,37(5):403-409.
[24]KIM B J, LEE S H, RYU W S, et al. Extents of white matter lesions and increased intraventricular extension of intracerebral hemorrhage[J]. Critical Care Medicine, 2013,41(5):1325-1331.
[25]KLOPPENBORG R P, NEDERKOORN P J, VAN DER GRAAF Y, et al. Homocysteine and cerebral small vessel di-sease in patients with symptomatic atherosclerotic disease: the SMART-MR study[J]. Atherosclerosis, 2011,216(2):461-466.
[26]胡大一,徐希平. 有效控制“H型”高血壓——预防卒中的新思路[J]. 中华内科杂志, 2008,47(12):976-977.
[27]李建平,霍勇,刘平,等. 马来酸依那普利叶酸片降压、降同型半胱氨酸的疗效和安全性[J]. 北京大学学报(医学版), 2007,39(6):614-618.
[28]MIWA K R, TANAKA M, OKAZAKI S, et al. Increased total homocysteine levels predict the risk of incident dementia independent of cerebral small-vessel diseases and vascular risk factors[J]. Journal of Alzheimer’s Disease, 2016,49(2):503-513.
[29]BETOWSKI J. Synthesis, metabolism, and signaling mechanisms of hydrogen sulfide: an overview[J].Methods in Mole-cular Biology (Clifton, NJ), 2019,20(7):1-8.
(本文编辑 马伟平)
3545500338226
