不同种植系统在牙周炎患者修复中的应用效果分析
2022-03-12王世振
王世振
牙周炎是牙周组织慢性炎症疾病,常由牙菌斑始动因子与多种刺激因素联合作用形成,若未及时接受有效治疗,炎症可迅速蔓延,严重者致牙齿松动甚至脱落[1]。研究指出,牙周炎与成年牙齿缺失密切相关,对日常进食带来不利影响[2]。目前,牙体种植修复成为牙周炎患者的牙列缺损修复方案。但近期有文献报道牙周炎患者的致病菌与种植术后种植体临近区域的炎症反应紧密关联,认为慢性牙周炎可能是种植体修复失败的一个重要影响因素之一[3,4]。种植体边缘骨水平的变化可在种植前期评估种植体稳定程度、成活几率,后期也可作为种植体修复效果的直观监测指标。越来越多研究发现,种植体临近区域龈沟液中的炎症因子可能是种植体周围炎症反应发生的始动因子之一,可介导异常免疫应答,龈沟液中酶类水平异常也可导致种植体周围的边缘骨的吸收[5-7]。因此,积极检测种植体骨吸收量和龈沟液中因子表达水平,对种植体炎症反应的早期诊治有一定临床指导意义。目前临床常见的种植系统包括士卓曼种植体、奥齿泰种植体、威高种植体三种。本次选取采用上述三种种植系统修复的牙周炎患者为研究对象,通过对比种植体边缘骨吸收量与龈沟液成分等指标,旨在为牙周炎患者有效治疗选择提供依据。
1.资料与方法
1.1 一般资料 以2019年4月~2020年4月在德州市人民医院口腔科接受牙体种植术的66例牙周炎患者为对象。纳入标准:①符合慢性牙周炎诊断标准[8];②无种植修复相关禁忌症;③患者知情且自愿参与研究,签署书面知情同意书。排除标准:①急性牙周炎;②全身系统性疾病;③妊娠期妇女;④近10 天使用抗生素治疗。依据治疗方法不同分为士卓曼组(31例,46 颗患牙)、奥齿泰组(16例,27颗患牙)、威高组(19例,21 颗患牙)。三组患者年龄、性别等基础资料对比差异无统计学意义(P>0.05),见表1。本研究已成功获取医院医学伦理委员会审核同意,同时符合赫尔辛基宣言。
表1 三组一般资料比较[例数(n),(±s)]
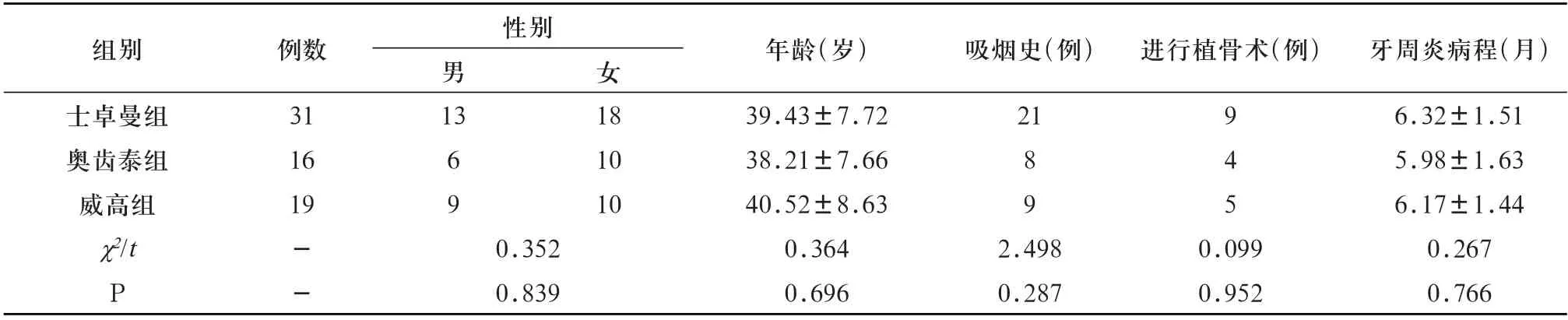
表1 三组一般资料比较[例数(n),(±s)]
组别士卓曼组奥齿泰组威高组χ2/t P例数31 16 19性别男13女进行植骨术(例)年龄(岁)39.43±7.72 38.21±7.66 40.52±8.63 0.364 0.696 18 10 10吸烟史(例)21 69 89 945--0.352 0.839 2.498 0.287 0.099 0.952牙周炎病程(月)6.32±1.51 5.98±1.63 6.17±1.44 0.267 0.766
1.2 方法 术前采用曲面拍摄牙齿断层片,制取下颌石膏模型,根据口内牙齿的余留情况与颌骨生理特点确定不同的牙体种植方案。①仪器和材料,士卓曼种植体[Straumann 种植系统,骨水平种植体RC,亲水性大颗粒喷砂酸蚀(SLActive)表面,瑞士];奥齿泰种植体[OSSTEM 种植系统,TSI 型,骨水平种植体,疏水性大颗粒喷砂酸蚀(SLA),韩国];威高种植体(WEGO种植系统,骨水平种植体,SLA 表面,中国)。②种植方法:士卓曼组、奥齿泰组、威高组,分别植入士卓曼种植体、奥齿泰种植体、威高种植体。在种植前指导患者采用氯己定含漱液漱口,常规消毒,铺巾,对患者术区消毒后采用1.2 mL 阿替卡因肾上腺素注射液对患者进行局麻,牙槽嵴切口,将翻瓣切开后,将肉芽组织切除后进行骨修整,球钻定位后采用生理盐水冲洗待冷却后,按照种植系统中的有关规定逐步备洞,依次将种植体植入,植入扭力应保证不低于35 N,放置愈合基台后严密缝合,种植术结束后使用抗菌药物,氯己定含漱液漱口,叮嘱患者保持良好口腔卫生,术后1~2 周拆线,术后3~6个月行上部结构固定烤瓷冠修复。两组所有操作均由本院同一团队医护人员完成。
1.3 观测指标①种植前、种植后1、3、6个月,测量种植体改良菌斑指数(modified plaque index, mPLI)、龈沟出血指数(sulcus bleeding index, SBI)、探 诊 深 度(probing depth, PD)。mPLI 评分[9]表共分4个等级,0 级表示无菌斑,1 级表示肉眼不可见但探针可挂出的薄层菌斑,2 级表示中等菌量的菌斑。3 级为大量软垢存在牙龈沟内。SBI评分表[10]共分0~5个等级对应0~5分,无炎症和出血=0分,龈沟有轻度炎症,但不出血=1分,龈沟有轻度炎症,出血=2分。龈沟有中度炎症,轻度水肿并出血=3分,龈沟有重度炎症,牙龈颜色改变,明显肿胀出血=4分;牙龈有色的改变,明显肿胀,有时有溃疡,探诊后出血或自动出血=5分。PD检测采用种植体专用塑料探针,选择种植体颊/舌侧近中、正中及远中等6个位点为起点,沿牙长轴方向,测量牙周袋底至牙龈边缘的距离,取6个位点测量值的平均值为最终值。
②种植体边缘骨吸收量的检测:应用平行投照方法对根尖片进行拍摄定位,对近、中、远牙槽嵴顶直至种植体与基台结合处的距离,计算三处平均值,整个过程由同一医生测量,共进行3次检测,并取平均值;术后即刻测量数据为准,在患者种植后3、6、9、12个月对种植体周边缘骨吸收量进行评估比较。
③种植体周围龈沟液炎症因子:牙体种植前、种植后1、3、6个月对患者种植体周围龈沟液进行采集,风干并采用无菌棉球对牙龈、种植体基台与义齿齿冠行擦拭、隔湿处理,将滤纸纸条插人义齿边缘的龈沟内,阻力较小时停止,30 s后取出,避免血液污染,若有污染则1 min 后重复收集操作。将滤纸条条置于1.5 mL 无菌EP 管中,标记并保存于-80℃冰箱中。检测时,向EP 管中加人100 μl磷酸盐缓冲液,室温条件下震荡10 min,高速离心取上清液,酶联免疫吸附试验对龈沟液中白介素-1β(interleukin-1β, IL-1β)、白 介 素-6(interleukin-6, IL-6)、白 介 素-8(interleukin-8, IL-8)的表达水平进行检测。
1.4 统计学处理 采用SPSS 23.0 统计学软件进行数据分析,计数资料用例(%)表示,组间比较行χ2检验,计量资料采用(±s)表示,采用单因素方差分析多组间的计量资料差异,采用LSD-t检验组间两两比较的差异,采用重复测量方差分析多时点组间计量资料的差异。以P<0.05有统计学意义。
2.结果
2.1 种植系统种植体留存率66例患者共植入94枚种植体,术后12个月的种植体留存率为100%(94/94),未发生种植体松动。
2.2 3种种植系统修复后不同时间点牙周评估分析 重复测量方差分析结果示:时间效应差异有统计学意义(P<0.05),即三组患者在不同时间点mPLI、SBI、PD 随着时间的变化而明显改变;组间效应差异具有统计学意义(P<0.05),即三组患者mPLI、SBI、PD 比较差异有统计学意义(P<0.05);mPLI、SBI、PD 的时间效应和组间效应有交互效应,三组患者mPLI、SBI、PD 随时间变化而升高,且种植后3、6个月士卓曼组mPLI、SBI、PD 较另两组明显低(P<0.05),见表2~4。
表2 3种不同种植系统修复后各时间点mPLI比较(± s)
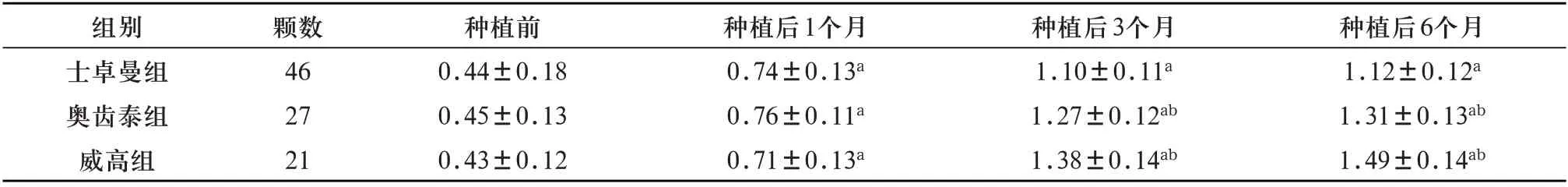
表2 3种不同种植系统修复后各时间点mPLI比较(± s)
注:a表示与种植前比较,P<0.05;b表示与士卓曼组比较,P<0.05
种植后6个月1.12±0.12a 1.31±0.13ab 1.49±0.14ab组别士卓曼组奥齿泰组威高组颗数46 27 21种植前0.44±0.18 0.45±0.13 0.43±0.12种植后1个月0.74±0.13a 0.76±0.11a 0.71±0.13a种植后3个月1.10±0.11a 1.27±0.12ab 1.38±0.14ab
表3 3种不同种植系统修复后各时间点SBI比较(± s,分)
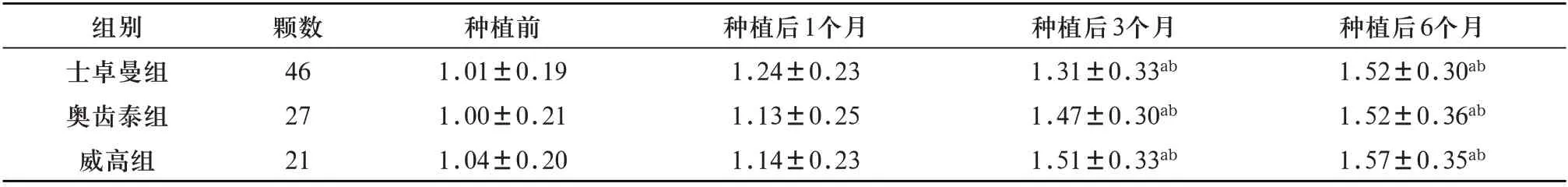
表3 3种不同种植系统修复后各时间点SBI比较(± s,分)
注:a表示与种植前比较,P<0.05;b表示与士卓曼组比较,P<0.05
种植后6个月1.52±0.30ab 1.52±0.36ab 1.57±0.35ab组别士卓曼组奥齿泰组威高组颗数46 27 21种植前1.01±0.19 1.00±0.21 1.04±0.20种植后1个月1.24±0.23 1.13±0.25 1.14±0.23种植后3个月1.31±0.33ab 1.47±0.30ab 1.51±0.33ab
表4 3种不同种植系统修复后各时间点PD比较(±s,mm)
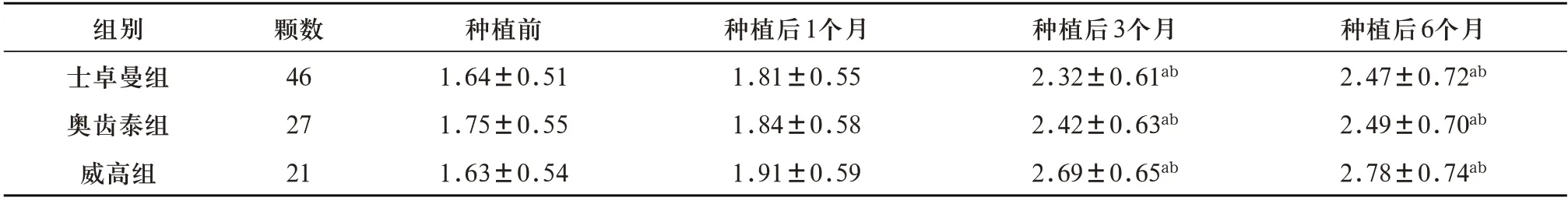
表4 3种不同种植系统修复后各时间点PD比较(±s,mm)
注:a表示与种植前比较,P<0.05;b表示与士卓曼组比较,P<0.05
种植后6个月2.47±0.72ab 2.49±0.70ab 2.78±0.74ab组别士卓曼组奥齿泰组威高组颗数46 27 21种植前1.64±0.51 1.75±0.55 1.63±0.54种植后1个月1.81±0.55 1.84±0.58 1.91±0.59种植后3个月2.32±0.61ab 2.42±0.63ab 2.69±0.65ab
2.3 3种种植系统修复后不同时间点边缘骨吸收情况 重复测量方差分析结果示:时间效应差异有统计学意义(P<0.05),即三组患者在不同时间点边缘骨吸收随着时间的变化而明显改变;组间效应差异具有统计学意义(P<0.05),即三组患者边缘骨吸收比较差异有统计学意义(P<0.05);边缘骨吸收的时间效应和组间效应有交互效应,三组患者边缘骨吸收随时间变化而升高,但种植后6、9、12个月士卓曼组边缘骨吸收较另两组明显低(P<0.05),见表5。
表5 3种种植系统修复后不同时间点边缘骨吸收情况比较(±s,mm)

表5 3种种植系统修复后不同时间点边缘骨吸收情况比较(±s,mm)
注:a表示与士卓曼组比较,P<0.05
种植后12个月1.01±0.12 1.34±0.13a 1.59±0.15a组别士卓曼组奥齿泰组威高组颗数46 27 21种植后3个月0.48±0.10 0.49±0.12 0.48±0.11种植后6个月0.66±0.11 0.91±0.13a 1.13±0.14a种植后9个月0.81±0.12 1.12±0.15a 1.44±0.17a
2.4 3种种植系统修复后患者种植体周围龈沟液成分比较 重复测量方差分析结果示:时间效应差异有统计学意义(P<0.05),即三组患者在不同时间点IL-lβ、IL-6、IL-8随着时间的变化而明显改变;组间效应差异具有统计学意义(P<0.05),即三组患者IL-lβ、IL-6、IL-8比较差异有统计学意义(P<0.05);IL-lβ、IL-6、IL-8的时间效应和组间效应有交互效应,三组患者IL-lβ、IL-6、IL-8随时间变化而升高,但种植后6、9、12个月士卓曼组IL-lβ、IL-6、IL-8较另两组明显低(P<0.05),见表6~8。
表6 3种不同种植系统修复后各时间点种植体周围龈沟液IL-lβ水平比较(±s,ng/ml)
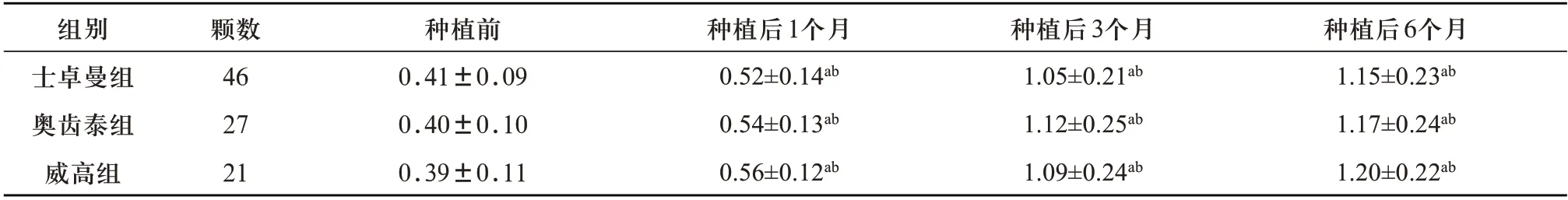
表6 3种不同种植系统修复后各时间点种植体周围龈沟液IL-lβ水平比较(±s,ng/ml)
注:a表示与种植前比较,P<0.05;b表示与士卓曼组比较,P<0.05
组别士卓曼组奥齿泰组威高组种植后6个月1.15±0.23ab 1.17±0.24ab 1.20±0.22ab颗数46 27 21种植前0.41±0.09 0.40±0.10 0.39±0.11种植后1个月0.52±0.14ab 0.54±0.13ab 0.56±0.12ab种植后3个月1.05±0.21ab 1.12±0.25ab 1.09±0.24ab
表7 3种不同种植系统修复后各时间点种植体周围龈沟液IL-6水平比较(±s,ng/ml)

表7 3种不同种植系统修复后各时间点种植体周围龈沟液IL-6水平比较(±s,ng/ml)
注:a表示与种植前比较,P<0.05;b表示与士卓曼组比较,P<0.05
种植后6个月4.03±1.12a 6.97±1.18ab 7.53±1.22ab组别士卓曼组奥齿泰组威高组颗数46 27 21种植前1.69±0.51 1.71±0.48 1.70±0.50种植后1个月1.99±0.76a 2.91±0.73ab 3.03±0.76ab种植后3个月3.31±1.01a 5.86±1.12ab 6.21±1.19ab
表8 3种不同种植系统修复后各时间点种植体周围龈沟液IL-8水平比较(±s,ng/ml)
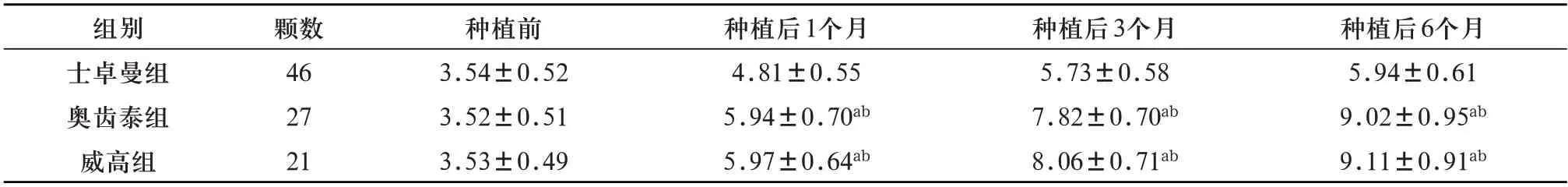
表8 3种不同种植系统修复后各时间点种植体周围龈沟液IL-8水平比较(±s,ng/ml)
注:a表示与种植前比较,P<0.05;b表示与士卓曼组比较,P<0.05
种植后6个月5.94±0.61 9.02±0.95ab 9.11±0.91ab组别士卓曼组奥齿泰组威高组颗数46 27 21种植前3.54±0.52 3.52±0.51 3.53±0.49种植后1个月4.81±0.55 5.94±0.70ab 5.97±0.64ab种植后3个月5.73±0.58 7.82±0.70ab 8.06±0.71ab
3.讨论
种植体周围骨组织、软组织的稳定性对种植修复的疗效具有重要意义。牙周炎患者由于牙周组织存在异常,牙体种植近远期疗效仍存在争议。谢也斯[11]通过对103例行牙体种植治疗患者的跟踪随访发现,牙周炎患者经规范治疗后行牙体种植,种植体短期留存率和修复体机械并发症发生率与健康人群对比差异不明显。张芫[12]的观察表明,牙周炎患者1年内的种植义齿成功率与健康人群的比较差异不明显,3年后成功率远低于牙周健康人群。本研究对纳入的66例牙周炎患者行三种不同牙体种植,发现94枚种植体术后12个月均未见松动,修复效果良好,说明牙周炎患者种植修复的短期疗效明确。
牙菌斑为牙周炎的始动因子,菌斑聚集意味着牙周支持组织周围聚集大量的致病菌及代谢物,致牙周软组织出现异常炎症反应,刺激牙周软组织的毛细血管充血,引发不同程度毛细血管破裂出血[13]。致病菌进一步向根端入侵,不仅对种植体-骨界面造成破坏,且可引发周围骨组织丧失。mPLI 与SBI 是反映牙周炎症严重程度的重要临床指标[14]。牙周正常者种植义齿PD值较天然牙增加约0.5 mm,但差值受个体差异、不同种植系统的影响[15]。金晓华[16]研究指出,慢性牙周炎合并后牙局部种植修复患者牙槽骨吸收状态、mPLI、SBI 与单纯牙周炎患者比差异无统计学意义。本观察通过对3种种植系统患者的牙周检测,结果发现三组患者在不同时间点mPLI、SBI、PD、边缘骨吸收随时间变化明显改变,三组患者mPLI、SBI、PD、边缘骨吸收的时间效应和组间效应有交互效应,三组患者mPLI、SBI、PD、边缘骨吸收随时间变化而升高,且种植后3、6个月士卓曼组mPLI、SBI、PD、边缘骨吸收较另两组明显低,种植体周围软组织封闭状态良好,3种种植系统均未影响种植体周的牙龈形态与稳固程度。术后6个月时,3种种植系统出现种植体周围炎症早期症状,但SBI 指数小于2,PD 值小于3,种植体周围软组织封闭状态良好,3种种植系统均未影响种植体周的牙龈形态与稳固程度。
骨吸收量属于牙体种植成功的一个重要评估指标[17]。种植体周围炎症反应是引发种植体周边缘骨吸收的重要影响因素。由于种植体与牙槽骨间缺乏健全的牙周膜结构,种植体周围牙槽骨易受炎症反应影响而出现骨组织被吸收情况[18]。祝岩[19]通过3种种植系统术后的对比研究发现,威高组术后12个月的边缘骨吸收量显著高于士卓曼组和奥齿泰组。本研究结果显示,3种种植系统修复患者种植后6、9、12个月种植体周围边缘骨吸收量较3个月时有所增加,且士卓曼组边缘骨吸收量低于威高组、奥齿泰组,提示士卓曼种植系统术后短期骨组织稳定性相对更好。士卓曼种植体为当前应用较为广泛且稳定的种植系统,其精确的骨预备方式与SLActive 表面处理,与威高、奥齿泰种植体表面相比较,有更强的骨结合能力,可明显提高初期稳定性及骨种植的成功率[20-22]。
种植体龈沟液中炎性因子水平是种植体炎症与边缘骨吸收早期监测指标。黄林[23]通过大鼠牙根吸收试验提出,大鼠龈沟液中IL-lβ 水平随着牙根吸收程度增加呈上升趋势,二者有显著相关性。IL-lβ 主要由巨噬细胞、T 细胞等免疫细胞合成和分泌,不仅可强化巨噬细胞吞噬功能,还可诱导破骨细胞活化,促进种植体边缘骨吸收[24]。另外,IL-lβ 还可与IL-6 相互作用,产生炎症级联反应,加重牙周组织损伤。动物实验表明,IL-6 抑制剂使用可降低种植体愈合期炎症造成的骨吸收,增加种植体周围骨体积率[25]。成纤维细胞、巨噬细胞等多种细胞在IL-lβ 的诱导下可大量合成IL-8。IL-8 对中性粒细胞具有募集作用,大量聚集的中性粒细胞可释放超氧化物,损伤牙周组织,还能刺激破骨细胞导致骨吸收[26]。孙菲[27]的研究显示,种植体周围龈沟液内IL-6、IL-8 水平与种植体周围炎的发生呈正相关。本研究结果显示,三组患者IL-lβ、IL-lβ、IL-6、IL-8 的时间效应和组间效应有交互效应,三组患者IL-lβ、IL-lβ、IL-6、IL-8 随时间变化而升高,且种植后3、6个月士卓曼组IL-lβ、IL-6、IL-8较另两组明显低,提示3种种植系统牙周炎种植患者可能存在种植体周围炎症发生风险,与既往研究[28]存在出入,分析原因可能如下:虽然牙体种植术后会对患者进行口腔卫生宣教,但个体口腔卫生水平仍存在较大差异,而种植体周围局部卫生情况对于龈沟液炎性因子水平存在显著影响。由本结果证实士卓曼种植体相对威高、奥齿泰种植体引发的炎症反应更轻,可能原因与士卓曼种植体中的骨水平种植体有十字锁合内连接设计,可确保修复基台与种植体精密连接成为一体的功能,减少骨吸收的同时,可设计出现类似天然牙的穿龈轮廓,有效防御病原微生物侵入,降低患牙种植体周围炎的风险,且对机体创伤应激相对更轻,由其引发的炎症反应也轻于另两种种植体轻。
综上所述,3种种植系统对牙周炎患者的近期修复效果较理想,与威高、奥齿泰种植体比较,士卓曼种植体种植后边缘骨吸收、龈沟液成分更低,或更有临床应用优势。
