K和Cs碱金属助剂对CuZnO催化剂CO加氢合成乙醇性能的影响
2022-03-11杨登辉樊金串
刘 晶, 杨登辉, 弓 洁, 樊金串, 黄 伟
(1.太原理工大学 省部共建煤基能源清洁高效利用国家重点实验室,山西 太原 030024;2.太原理工大学 化学化工学院,山西 太原 030024)
乙醇是一种重要的化工原料,可以用于制取乙醚、乙酸乙酯等化工产品,同时也可以作为汽油的改善剂,提高汽油的燃烧效率和辛烷值。目前,乙醇主要是通过石油衍生的烯烃水合法和生物发酵法生产,受限于国内石油资源和粮食短缺等问题,这2种方法受到了成本与市场价格的挑战。合成气(CO+H2)直接合成法因其原料来源广泛,工艺简单和环境友好而具有诱人的前景[1-5]。合成气直接转化为乙醇常用的催化剂可分为3类:Rh基催化剂[6-7]、Mo基催化剂[8-10]和Cu基催化剂[11-12]。贵金属Rh基催化剂在CO加氢反应中对乙醇有较高的选择性,但价格昂贵阻碍了其工业应用。Mo基催化剂(MoS2、Mo2C)具有抗硫中毒性的优点,但用于合成气转化反应需要在高温高压下进行,且需要较长的反应时间才能达到稳定状态。Cu基催化剂由于其在温和环境下具有高活性被广泛应用于甲醇合成中,当添加助剂改性时,CO加氢反应液相产品中异丁醇的收率大幅提高,但乙醇的收率非常低[13]。笔者所在课题组前期研究[14]表明,当不存在费-托合成或碱金属元素时,采用完全液相法制备的CuZnAl催化剂具有催化CO加氢合成乙醇的能力,但高乙醇选择性总伴随着副产物低碳烷烃的生成,因此,如何降低低碳烷烃的选择性具有重要研究意义。
Sun等[15]通过理论和实验探究碱金属助剂对铜/锌/铝催化剂催化合成气转化为甲醇和C2+醇的影响,其认为Cs2O助剂可以小幅降低HCO与CH之间偶联反应的活化能垒及反应热,因此可以在一定程度上促进HCO与CH之间的偶联,由于HCO与CH之间的偶联在一定程度上消耗了表面的CH中间产物,而CH是生成副产物烷烃的关键中间产物,因此,该偶联反应可以在一定程度上抑制副产物烷烃的生成。Nunan等[16]还证实,副产物烷烃的选择性与催化剂表面酸量呈线性正相关,添加碱金属助剂可以减少催化剂表面酸量,从而降低副产物烷烃的选择性。
鉴于此,笔者采用完全液相法制备了铜/锌催化剂,并添加碱金属K和Cs助剂于铜/锌催化剂中进行改性,探究铜/锌基催化剂的结构和其CO加氢合成乙醇的催化性能,以期降低低碳烷烃的生成,同时进一步提高乙醇的选择性。
1 实验部分
1.1 原料和试剂
硝酸铜(Cu(NO3)2·3H2O)、硝酸锌(Zn(NO3)2·6H2O)、乙二醇((CH2OH)2)、柠檬酸(C6H8O7·H2O)、碳酸钾(K2CO3)、碳酸铯(Cs2CO3)、液体石蜡,均为分析纯,天津市科密欧化学试剂有限公司产品;失水山梨醇单油酸脂(span80),化学纯,天津市天达净化材料精细化工厂产品;去离子水,太原理工大学中试基地产品;氢气、一氧化碳、氮气、氨气、氩气、氦气,体积分数均不小于99.99%,太原市安旭鸿云科技发展有限公司产品。
1.2 催化剂制备
催化剂前驱体以笔者所在课题组自主研发的完全液相法制备,其中n(Cu)∶n(Zn)=2∶1,碱金属助剂分别以Cs2CO3、K2CO3为Cs源和K源,Cs助剂添加摩尔分数为1.64%,K助剂添加摩尔分数分别为1%、1.64%、2.5%。将48.32 g硝酸铜及一定量的碱金属助剂溶解于55.64 mL乙二醇中,将29.75 g硝酸锌溶解于5 mL去离子水中,隔夜搅拌12 h备用;含5.12 g柠檬酸的86.4 mL水溶液在50 ℃下搅拌3 h,升温至95 ℃,搅拌1 h,将溶解好的乙二醇溶液逐滴加入上述水溶液中,30 min后,加入硝酸锌溶液,搅拌直至形成均匀的溶胶。将所得胶体在室温下老化10 d,均匀分散在含有0.5 mL span80的液体石蜡中,在常压环境中,氮气保护的条件下,以5 ℃/min的升温速率由室温升温至300 ℃,保持7 h后得到浆状催化剂。将未添加碱金属助剂的催化剂命名为CAT-TX, Cs助剂摩尔分数为1.64%,K助剂摩尔分数分别为1%、1.64%、2.5%的催化剂分别命名为CAT-TXS1.64、CAT-TXJ1、CAT-TXJ1.64、CAT-TXJ2.5。
1.3 表征测试仪器
XRD分析测试在丹东方圆仪器有限公司生产的DX-2700 型X射线衍射仪上测定,辐射源为CuKα(λ=0.15418 nm),管电流30 mA,管电压40 kV,扫描方式为步进扫描,扫描范围2θ为5°~85°,扫描速率为8°/min,步长为0.03°;采用谢乐(Scherer)公式计算Cu和ZnO的晶粒尺寸。
NH3-TPD-MS表征采用天津原位红外TP-5080型吸附装置,催化剂用量100 mg,50 ℃条件下吸附NH3至饱和,用氦气吹扫30 min,升温速率为10 ℃/min,从50 ℃升温至810 ℃脱附NH3,通过英国Hiden公司生产的QIC-20质谱检测器对尾气NH3进行信号检测。
H2-TPR表征采用天津原位红外公司生产的化学吸附装置测定,催化剂用量为50 mg,5%H2-95%N2混合气为还原气,以10 ℃/min从50 ℃升温至510 ℃,热导检测耗氢量。
N2吸附采用美国康塔公司Quantachrome QDS-30型物理吸附仪,样品比表面积采用BET方程计算,平均孔径和孔体积采用BJH方法计算。
XPS表征采用ThermoFisher公司生产的Escalab 250型X光电子能谱图仪,激发光源为AlKα,光子能量为1486.6 eV,精确度为±0.05 eV,以C 1s标准峰位的结合能值(284.8 eV)为标准校正其他元素的结合能。
1.4 催化剂活性评价实验
向0.5 L的高压反应釜中装入300 mL按1.2节中方法制备的新鲜催化剂浆液,其中固体催化剂(以金属氧化物计)装填量约为21.0 g,通入合成气,n(H2)/n(CO)=2,总进料体积流量为9000 mL/h,在恒定压力为4 MPa、温度为280 ℃、转速为750 r/min的条件下评价催化剂的CO加氢催化性能。用上海华爱GC-9560气相色谱在线分析反应尾气,Ar为载气,柱炉温度为60~180 ℃,H2、CO等无机物由热导检测器(TCD)检测,其中TDX-01为色谱柱,检测器温度150 ℃;C1~C5烃类(CHx)、二甲醚(DME)及未冷凝的甲醇(MeOH)、乙醇(EtOH)组成由氢火焰检测器(FID)检测分析,其中色谱柱类型为HP-Plot/Q,检测器温度220 ℃;每24 h收集1次液体样品。利用外标法(标准曲线法)定量计算气相(DME、MeOH、EtOH、CO2及C1~C5烃类)和液相(MeOH、EtOH、PrOH(丙醇)、BuOH(丁醇))中各组分的含量,液相产物计算结果是产物的质量分数,气相产物计算结果是产物的摩尔分数,经过碳质量守恒计算CO转化率和各产物的选择性,计算公式如式(1)、式(2)所示。
(1)
(2)
式中:x(CO)为CO的转化率,%;si为i组分的选择性,%;i为除CO外其他所有含C化合物;ni(g)和ni(l)为单位时间(h)内i组分在气相和液相产物中的物质的量。
2 结果与讨论
2.1 XRD表征
图1是不同碱金属助剂改性的铜/锌催化剂在CO加氢催化反应前后的XRD谱图。由图1可以看到,碱金属助剂的引入对铜/锌基催化剂物相的影响不甚明显,反应前后均不存在与碱金属氧化物相关的特征峰,这与碱金属助剂的添加量较少(摩尔分数为1%~2.5%)有关。由图1(a)可知:反应前,各催化剂中铜物种以Cu0为主,低价态Cu的存在是由于惰性介质液体石蜡在高温条件下具有还原性能所致[17];所有催化剂XRD谱图中未出现ZnO的特征衍射峰,可能ZnO以无定形或高度分散状态形式存在,这是因为完全液相法的特殊制备工艺所致。由图1(b)可知,反应后,所有催化剂均出现了ZnO的特征衍射峰,这是因为ZnO的表面能较高,反应过程中为降低其能量自身会发生团聚而形成微晶[5]。
用谢乐公式计算图1中所有催化剂反应前后Cu(111)和ZnO(101)的晶粒尺寸,如表1所示。由表1可知:反应前,Cu(111)晶粒尺寸由小到大的顺序为K改性催化剂、未改性催化剂、Cs改性催化剂;反应后,除了CAT-TXJ2.5,催化剂中Cu晶粒尺寸都有不同程度的增大,但整体来看,相较于未改性催化剂,加入Cs助剂后,催化剂中Cu(111)晶粒尺寸略微减小,而加入K助剂后催化剂 中Cu(111)晶粒尺寸明显减小,且随K助剂添加量的增加,Cu(111)晶粒尺寸不断减小,说明加入K助剂后催化剂中的Cu物种分散性更好,由此得出K助剂能够增加Cu物种的分散性,降低Cu晶粒尺寸[18],而Cs助剂对Cu晶粒尺寸影响不大。

图1 不同碱金属助剂改性的铜/锌催化剂在CO加氢催化反应前后的XRD谱图Fig.1 XRD patterns of Cu-Zn catalysts modified with different alkali metal promotersbefore and after CO hydrogenation reaction(a) Before reaction; (b) After reaction

表1 CO加氢催化反应前后不同碱金属助剂改性的铜/锌催化剂中Cu(111)和ZnO(101)的粒径Table 1 Grain sizes of Cu(111) and ZnO(101) in theCu-Zn catalysts modified with different alkali metalpromoters before and after CO hydrogenation reaction D/nm
2.2 H2-TPR表征
图2为不同碱金属助剂改性的铜/锌催化剂的H2-TPR谱图。由图2可知:XRD表征中均没有检测到氧化态Cu+或Cu2+物种,但各催化剂样品在220~250 ℃之间存在还原峰,归属于Cu+→Cu0的还原反应[19],这说明各催化剂样品中氧化态Cu+物种高度分散或其量少至低于XRD的检测下限。CAT-TX催化剂还原峰顶温度为241 ℃,加入不同的碱金属助剂后,还原峰顶温度降低至220 ℃左右,碱金属的加入使Cu+物种的还原峰温向低温方向移动,这可能是由于添加碱金属助剂使得Cu+与ZnO的结合力减弱,即氧化态Cu物种的还原变得容易。

图2 不同碱金属助剂改性的铜/锌催化剂样品的H2-TPR谱图Fig.2 H2-TPR profiles of Cu-Zn catalysts modifiedwith different alkali metal promoters
2.3 NH3-TPD表征
图3为不同碱金属助剂改性的铜/锌催化剂的NH3-TPD谱图。由图3可知,各催化剂样品均在175 ℃左右存在脱附峰,对应于弱酸位[20]。添加碱金属助剂后,催化剂上吸附的氨脱附峰峰面积减小,即催化剂表面的酸量减少。其中,添加Cs助剂后,催化剂表面的弱酸酸量最少,这可能是由于Cs助剂相较于K助剂来说具有更强的碱性所致[21];而随着K助剂量的增加,氨气脱附峰的峰面积减小,即催化剂表面弱酸酸量减少。

图3 不同碱金属助剂改性的铜/锌催化剂的NH3-TPD谱图Fig.3 NH3-TPD profiles of Cu-Zn catalysts modifiedwith different alkali metal promoters
2.4 BET表征
图4为不同碱金属助剂改性的铜/锌催化剂的吸-脱附等温线和孔径分布图。由图4(a)可以看出,各催化剂均具有Ⅳ型等温线,伴有H3型滞后环[22],这表明催化剂孔结构为平行板聚集的狭缝孔。图4(b)显示所有催化剂的孔径明显在3.8 nm左右出现集中,CAT-TX中较大的孔径约为7.8 nm,加入碱金属助剂后,各催化剂较大孔的尺寸略有减小。表2为不同催化剂反应前后织构参数。由表2可以看出,催化剂的孔体积和比表面积在加入碱金属助剂后均减小[23],减小程度不同,但趋势相同。

图4 不同碱金属助剂改性的铜/锌催化剂的孔径分布和N2吸附/脱附等温线图Fig.4 Pore size distribution and N2 adsorption and desorption isotherm diagram ofCu-Zn catalysts modified with different alkali metal promoters(a) Pore size distribution; (b) N2 Adsorption and desorption isotherm diagram

表2 不同碱金属助剂改性的铜/锌催化剂在CO加氢催化反应前后的织构参数Table 2 Texture parameters of Cu-Zn catalysts modified with different alkali metalpromoters before and after CO hydrogenation reaction
2.5 XPS表征
为了考察不同碱金属助剂改性的铜/锌催化剂表面物种组成及元素价态变化,对催化剂进行了XPS分析,图5(a)、(b)、(c)分别为不同碱金属助剂改性的铜/锌催化剂的Cu 2p-XPS、Zn LMM-XAES和O 1s-XPS谱图。由图5(a)可知:未添加碱金属助剂的催化剂在932.44 eV附近出现锐峰,在940.00~945.00 eV之间没有明显的卫星峰,表明未添加碱金属助剂催化剂表面的Cu物种主要为低价态Cu[24];随着碱金属助剂的加入,Cu 2p结合能移向较低能级,位于932.14 eV。Sun等[25]认为结合能的偏移是由于催化剂所处的化学环境发生改变,电子密度减小使结合能向高的方向偏移,反之向低的方向偏移。Asano等[26]认为碱性阳离子是路易斯酸,没有供电子作用,但是阳离子配位域中的氧阴离子具有高度碱性。据此可认为,改性的铜锌催化剂中碱金属阳离子周围的高碱性氧阴离子会对铜离子产生供电子作用,从而增加其电子密度,导致加入碱金属后催化剂Cu 2p结合能向较低能级偏移。
不同价态的Zn可能处于同一结合能处,因此不能只通过Zn 2p的XPS能谱区分,常用Zn LMM-XAES动能谱图来观察Zn状态的细微差异。由图5(b)各催化剂的Zn LMM-XAES动能谱图可知,所有催化剂均在499.73 eV处存在ZnO的特征衍射峰,496.00 eV处的肩峰表明少量的Zn2+具有氧缺陷,根据笔者之前工作得出的结论,Zn(2-δ)的存在与碳链增长的能力有关[27]。
由图5(c)各催化剂的O 1s光谱可知,通过添加碱金属助剂,O 1s峰向较高的结合能侧稍微移动,这种变化可能是由于碱金属阳离子与氧阴离子结合形成表面羟基所致[26]。

图5 不同碱金属助剂改性的铜/锌催化剂的Cu 2p-XPS、Zn LMM-XAES和O 1s-XPS谱图Fig.5 Cu 2p-XPS, Zn LMM-XAES and O 1s-XPS spectra of Cu-Zn catalysts modified with different alkali metal promoters(a) Cu 2p-XPS; (b) Zn LMM; (c) O 1s-XPS
表3为碱金属助剂改性的铜/锌催化剂的表面元素组成以及金属原子比。由表3可以看出:加入碱金属助剂后催化剂表面碳摩尔分数升高,Cs助剂与Cu的摩尔比(0.39)大于投料时的摩尔比(0.164),这意味着在催化剂的表面区域中存在大量铯离子[26];而当K助剂的摩尔分数为1%及1.64%时,未检测出其含量,随着理论投料量的增加,K助剂与Cu的摩尔比(0.10)也低于投料比(0.25);催化剂表面Cu、Zn元素摩尔比远低于投料比[n(Cu)∶n(Zn)=2∶1],表明相对于Cu物种而言,Zn物种更容易在催化剂表面富集[28]。催化剂CAT-TXJ1.64 表面的Cu/Zn摩尔比最小,说明其表面富集的Zn组分最多。

表3 不同碱金属助剂改性的铜/锌催化剂的XPS数据Table 3 XPS data of Cu-Zn catalysts modified with different alkali metal promoters
2.6 催化剂活性评价
图6为碱金属助剂改性的铜/锌催化剂催化CO加氢反应的活性评价结果。由图6可知,在压力为4 MPa、温度为280 ℃,反应时间长达144 h的活性评价过程中,催化剂均较为稳定。添加Cs助剂的铜锌催化剂对应的CO转化率降低较为明显;添加K助剂的铜锌催化剂对应的CO转化率略微降低,但随着K助剂的摩尔分数增加至2.5%,CO转化率也明显提高至8%左右。CAT-TX催化剂中总醇选择性仅为20%左右,烷烃的选择性达到了70%以上;加入摩尔分数1.64%的Cs助剂及摩尔分数1%的K助剂后,烷烃的选择性降低至62%左右,随着K助剂添加量的增加,烃的选择性先降低后增加,即K助剂摩尔分数为1.64%时,烷烃的选择性最低,为55%左右。根据NH3-TPD表征显示,加入碱金属后催化剂弱酸量减少,Cs助剂提供碱性的能力强于K助剂,而对于K助剂来说,随着添加量的增加,弱酸量逐步减少,由此可见,适宜的弱酸量即中等强度的碱金属助剂添加更有利于副产物烷烃的减少。根据XRD表征可知,加入K助剂的催化剂Cu(111)晶粒尺寸明显减小,K助剂摩尔分数为1.64%时,Cu(111)晶粒尺寸最小,为35.4 nm,说明K助剂能够增加Cu0的分散性,降低Cu(111)晶粒尺寸,较小的Cu晶粒尺寸一定程度上抑制了烷烃的生成,这与前人的研究结果[28]一致。
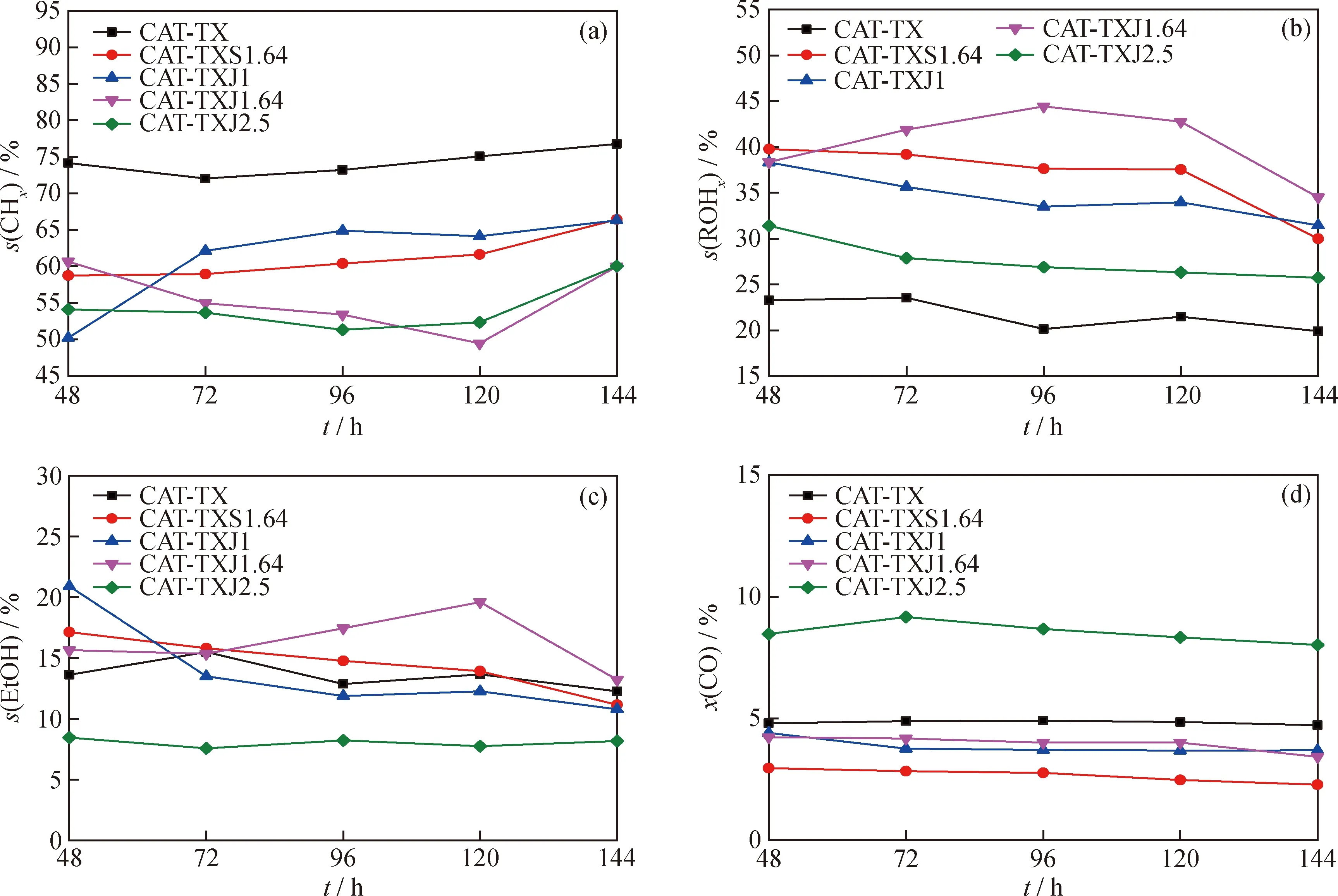
ROH including methanol, ethanol, propanol and butanol.图6 不同碱金属助剂改性的铜/锌催化剂上CO加氢反应性能随反应时间的变化Fig.6 Performance of CO hydrogenation reaction on Cu-Zn catalysts modified withdifferent alkali metal promoters changing with the reaction time(a) s(CHx); (b) s(ROH); (c) s(EtOH); (d) x(CO)Reaction conditions: T=280 ℃; p=4.0 MPa; GHSV=9000 h-1; V(H2)/V(CO)=2
不同催化剂催化CO加氢产物醇分布如表4所示。由表4可以看出,CAT-TX催化剂中乙醇在总醇中的质量分数达66%以上,加入碱金属助剂后,甲醇及丁醇在总醇中的占比提高。XPS表征结果显示,加入碱金属助剂后,O 1s峰向较高的结合能处偏移,这是由于催化剂中碱金属阳离子与氧阴离子结合形成了表面氢氧基团。Edward等[29]在研究ZnO和Cu/ZnO表面的原位红外图谱时,推测甲醇的合成机理如下:CO插入表面氢氧基团能够生成表面甲酸基团,表面甲酸基团通过加氢生成甲氧基,最后进行进一步加氢或水解形成甲醇。Vedag等[30]认为Cs2O助剂可以通过促进β亲核进攻反应来提高支链低碳醇的生成。因此,结合表征结果及文献研究,笔者添加碱金属助剂于铜/锌基催化剂中可能促进了催化剂表面氢氧基团的生成及β亲核进攻反应,从而提高了甲醇及丁醇在总醇中的占比。
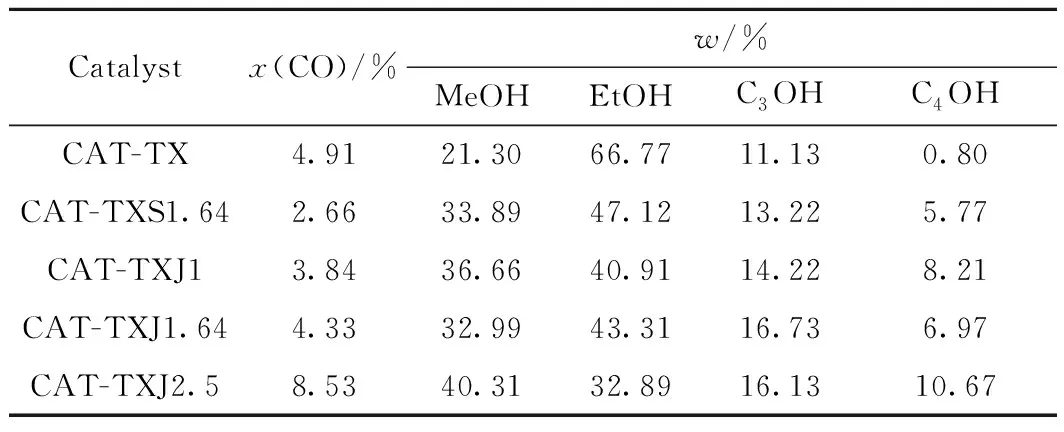
表4 不同催化剂催化CO加氢反应产物中的醇分布Table 4 Distribution of alcohol in CO hydrogenation reactionproduct after being catalyzed by different catalysts
综合考虑,CAT-TXJ1.64催化CO加氢反应的性能最佳,低碳烷烃选择性下降最为明显,CO转化率基本维持不变,乙醇选择性也较高。结合活性评价数据和表征结果可以发现,碱金属助剂使铜/锌催化剂中Cu0晶粒尺寸、织构性质以及催化剂表面酸性产生差异,从而导致有不同的催化性能。
3 结 论
在浆态床CO加氢反应中,完全液相法制备的铜/锌催化剂具有较好的乙醇生成能力,但对低碳烷烃的选择性较高,碱金属助剂K和Cs的引入均能降低副产物烃的生成能力,其中,K助剂的效果优于Cs。
(1)K助剂改性的铜/锌催化剂,随着K添加量的增多,烷烃选择性先降低后增加,乙醇在总醇中的占比先增加后降低,说明K助剂的添加量存在一个最佳值。K助剂摩尔分数为1.64%时,催化性能最好,在4 MPa、280 ℃的反应条件下,其总醇选择性达40%,乙醇在总醇中的质量分数达40%以上。
(2)当Cs助剂改性的铜/锌催化剂添加摩尔分数为1.64%时,副产物烷烃的选择性较高,且CO转化率也较低,催化性能不佳。
(3)K助剂能明显降低催化剂中Cu晶粒尺寸,且能较好地调节催化剂表面的弱酸酸量,有利于降低副产物低碳烷烃的生成能力。
(4)添加碱金属助剂K和Cs于铜/锌基催化剂中,可能促进了催化剂表面氢氧基团的生成及β亲核进攻反应,从而提高了甲醇及丁醇在总醇中的占比。
