黄酒中降生物胺糖多孢菌的筛选及评价
2022-03-11孙梦菲刘双平应维茂
孙梦菲, 刘双平, 应维茂, 韩 笑, 毛 健,*
(1.江南大学 食品学院/粮食发酵工艺与技术国家工程实验室, 江苏 无锡 214122;2.浙江古越龙山绍兴酒股份有限公司 国家黄酒工程技术研究中心, 浙江 绍兴 312000;3.江南大学(绍兴)产业技术研究院, 浙江 绍兴 312000)
生物胺是一种低分子质量的含氮有机碱,主要由微生物产生的氨基酸脱羧酶作用于氨基酸脱羧而生成[1],生物胺普遍存在于发酵食品中,适量生物胺有助于人体的正常生理活动,过量生物胺的摄入则会引起动脉血管和微血管的扩张,导致腹泻、头痛、腹部痉挛、呕吐等不良生理反应,甚至会导致死亡[2-3],德国、比利时、法国、瑞士设定葡萄酒中组胺的最高限值分别为2、5、8、10 mg/L[4],斯洛伐克设定啤酒中组胺的最高限值为20 mg/kg[5]。
黄酒作为我国具有民族特色的传统酒精饮料,富含多种氨基酸和功效成分,深受消费者的青睐。黄酒开放式的酿造环境使得黄酒中的生物胺含量要比其他酿造酒(啤酒和葡萄酒等)高很多,黄酒中的生物胺平均含量高达115 mg/L[6-7],研究表明:组胺、酪胺、苯乙胺等生物胺能显著抑制乙醇的代谢速率,加速黄酒饮后醉酒速度,进而影响黄酒的饮用舒适度[8]。目前控制食品发酵过程中生物胺含量的方法有很多,主要包括优化生产工艺和储藏条件[9]、减少发酵体系中产生物胺的微生物或控制产胺微生物产胺[10]等,这些方法存在一定的局限性,均不能降解已经产生的生物胺。研究发现,存在一些微生物可通过分泌生物胺氧化酶降解已存在的生物胺,因此,利用生物强化技术将具有生物胺降解功能的菌株控制食品中的生物胺含量的方法越来越受到关注,但大多数研究中的生物胺降解菌种属于乳酸菌、葡萄球菌等[11-13],关于其他种类微生物降解生物胺的能力及应用的研究较少。黄酒酿造过程中微生物种类丰富,是良好的微生物菌种资源库,有待进一步开发。
大量研究表明放线菌门中的微生物作用是许多生物活性物质的重要来源,放线菌的代谢产物如氨基酸、各种酶制剂、有机酸等在农业、工业、科学、医药等多个领域发挥着巨大的作用[14]。同时,全基因组功能注释结果表明放线菌门的披发糖多孢菌中存在生物胺氧化酶,有学者发现从放线菌门的红球菌中分离纯化得到的生物胺氧化酶对腐胺具有较强的降解能力[15]。同时,研究发现放线菌是黄酒酿造过程中的优势微生物之一,其中放线菌门的糖多孢菌属参与了黄酒发酵过程中的葡萄糖利用、氮利用、氨基酸合成、脂肪酸合成和甘油三酯水解等大量物质代谢过程,对黄酒发酵具有重要影响[16]。因此,从黄酒酿造过程中筛选具有降解生物胺功能的糖多孢菌,在控制黄酒的生物胺含量方面具有一定的潜力。
1 材料与方法
1.1 材料与试剂
黄酒麦曲、发酵醪样品来自浙江某黄酒厂。
菌株F1902~F1910为实验室保藏菌株,菌株F2001~F2037为本研究筛选获得的菌株。
细菌生化微量鉴定管,青岛海博生物有限公司;色胺、β-苯乙胺、尸胺、腐胺、组胺、酪胺、亚精胺、精胺、L-酪氨酸、L-组氨酸、L-赖氨酸、L-鸟氨酸盐、L-色氨酸、L-精氨酸、L-苯丙氨酸、5′-磷酸吡哆醛、丹磺酰氯、乙腈、乙醇、丙酮(分析纯),均来自国药集团化学试剂有限公司。
放线菌液体培养基:硝酸钾1.0 g/L,磷酸二氢钾0.5 g/L,硫酸镁0.5 g/L,硫酸亚铁0.01 g/L,氯化钠0.5 g/L,可溶性淀粉20.0 g/L,pH值7.2~7.4(25 ℃),固体培养基在此基础上添加琼脂15.0 g/L。
放线菌氨基酸培养基:放线菌液体培养基中添加L-酪氨酸0.4 g/L,L-组氨酸1 g/L,L-赖氨酸1 g/L,L-鸟氨酸1 g/L,色氨酸1 g/L,精氨酸1 g/L,L-苯丙氨酸1 g/L,5′-磷酸吡哆醛0.05 g/L。
放线菌生物胺培养基:放线菌液体培养基中添加生物胺(包括组胺、酪胺、尸胺、腐胺、精胺、亚精胺、色胺、β-苯乙胺各50 mg/L)。
1.2 仪器与设备
Agilent 1100型高效液相色谱仪,美国Agilent公司;C18色谱柱(4.6 mm×250 mm×5 μm),美国Agilent公司;Legend Micro 17R型冷冻高速离心机,赛默飞世尔科技(中国)有限公司;小型离心机,赛默飞世尔科技(中国)有限公司;PCR仪,赛默飞世尔科技(中国)有限公司;DYY-6C型电泳仪,北京六一仪器厂;Universal HoodⅡ型凝胶成像系统,伯乐生命医学产品(上海)有限公司。
1.3 实验方法
1.3.1黄酒中糖多孢菌的分离与纯化
1.3.1.1 样品预处理
麦曲样品:称取5 g麦曲于50 mL离心管中,添加30 mL蒸馏水后放入摇床培养箱中于30 ℃培养30 min。
发酵醪样品:称取30 mL发酵醪于50 mL离心管中,放入摇床培养箱中于30 ℃培养30 min。
1.3.1.2 分离纯化
取悬浮液梯度稀释至10-1至10-6的稀释匀液。分别吸取麦曲、发酵醪各稀释度菌液100 μL涂布于放线菌固体培养基,37 ℃培养4 ~ 7 d。在菌落密度适中的平板上挑取薄的、有凸面隆起的单菌落,分别划线接种到放线菌固体平板上。
1.3.2糖多孢菌产生物胺能力评价
将糖多孢菌在放线菌液体培养基中于37 ℃ 150 r/min条件下培养48 h后接种至放线菌氨基酸培养基中(菌液添加量为培养基体积分数的5%),于37 ℃ 150 r/min条件下培养5 d后测定其生物胺产量,未添加菌株的培养基为对照组。
1.3.3糖多孢菌降生物胺能力评价
将糖多孢菌在放线菌液体培养基中于37 ℃ 150 r/min条件下培养48 h后接种至放线菌生物胺培养基中(菌液添加量为培养基体积分数的5%),于37 ℃ 150 r/min条件下培养5 d后测定其生物胺含量,并与未添加菌株的培养基(对照组)相比计算筛选菌株的生物胺降解率。
1.3.4生物胺测定方法
生物胺含量使用高效液相色谱,丹磺酰氯柱前衍生法进行测定[17]。生物胺降解率按式(1)计算。
(1)
式(1)中,X为生物胺降解率,%;ρ1为未接种菌株样品的生物胺质量浓度,mg·L-1;ρ2为接种菌株样品的生物胺质量浓度,mg·L-1。
1.3.5菌株鉴定
1.3.5.1 分子生物学鉴定
提取菌株DNA,利用细菌通用引物:上引物为27F(5′-AGAGTTTGATCMTGGCTCAG-3′),下引物为1492R(5′-TACGGYTACCTTGTTACGACTT-3′),对菌株的16S rDNA进行扩增。PCR扩增体系(50 μL)为:2×Taq PCR Master Mix 25 μL,上下引物各1 μL,模板1 μL,加无菌水22 μL补充至50 μL。PCR扩增程序:94 ℃预变性3 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,35个循环。PCR扩增产物经纯化后送至上海生工生物技术有限公司测序,将所得序列提交到GenBank数据库中,利用BLAST进行序列同源性分析,比较供试菌株与已知糖多孢菌相应序列的相似性。
1.3.5.2 生理生化鉴定
用接种针从平板上挑取已纯化分离的糖多孢菌单菌落接种于细菌微量生化鉴定管中,在检测标准中所规定的条件下培养,结果对照《伯杰细菌鉴定手册》[18]进行综合评定。
1.3.6糖多孢菌降生物胺能力的影响因素研究
考察温度、pH值和乙醇浓度对糖多孢菌降解生物胺能力的影响。将糖多孢菌在放线菌培养基中37 ℃活化48 h,将其接种在不同条件下的降生物胺菌株筛选培养基中,培养5 d后测定菌株生物胺降解率。其中温度梯度设为25、30、35、40、45 ℃;pH值梯度设为4、5、6、7、8、9;乙醇体积分数梯度设为0%、1%、3%、5%、7%、10%。
1.3.7糖多孢菌生物量的测定
称取15 mL空离心管质量(记为m1),准确量取10 mL震荡均匀的菌液于15 mL离心管中,8 000 r/min离心15 min,弃上清,用去离子水洗涤沉淀2~3次,于80 ℃烘干至恒重,称重(记为m2)[19],生物量按公式(2)计算:
(2)
式(2)中,ρ为生物量,g·L-1;m1为空管质量,g;m2为菌液干质量与空管质量之和,g。
2 结果与分析
2.1 黄酒中糖多孢菌的分离鉴定结果
糖多孢菌属是黄酒麦曲、黄酒发酵醪中的优势菌属之一,且对黄酒发酵有重要影响。本研究通过分离、纯化,共筛选获得63株颜色、大小、突起、边缘等表观特征不同的纯培养物,通过制片、显微镜观察,这些菌株均符合放线菌的培养特征。对63株菌株进行16s RNA测序,结果表明:37株属于糖多孢菌,其中霍氏糖多孢菌(Saccharopolysporahordei)17株,玫瑰糖多孢菌(Saccharopolysporarosea)13株,江西糖多孢菌(Saccharopolysporajiangxiensis)2株,披发糖多孢菌(Saccharopolysporahirsuta)1株,红色糖多孢菌(Saccharopolysporaerythraea)4株,命名为F2001~F2037。其他的26株菌株分别为絮状链霉菌9株、可可链霉菌亚种8株、弗拉迪链霉菌2株、白色链霉菌7株。
2.2 糖多孢菌产生物胺能力评价结果
某些微生物可在特定条件下产生氨基酸脱羧酶作用于游离氨基酸而产成生物胺,因此,本研究分别将分离获得的37株糖多孢菌和实验室菌种库中的9株糖多孢菌接种至含有氨基酸的放线菌培养基中,研究其产生物胺能力,结果见图1。由图1可知,菌株F1904产生物胺能力最强,生物胺总产生量为20.13 mg/L。除菌株F2001、F2011、F2012、F2026、F1904外,其余菌株产生物胺能力极弱,生物胺产生量均低于5 mg/L,且几乎不产生腐胺、酪胺。为筛选低产生物胺且可降解生物胺的糖多孢菌,选择41株低产生物胺的糖多孢菌菌株进行进一步的研究。
2.2 可降解生物胺糖多孢菌的筛选结果
分别将筛选获得的41株低产生物胺的糖多孢菌接种到添加生物胺的放线菌培养基中测定其生物胺降解率,结果见表1。由表1可知,菌株F1902、F1909、F2002、F2004、F2014、F2017具有较强的生物胺降解能力,总生物胺降解率均大于50%,最高为76.41%±0.82%。佟婷婷[20]从泡菜中筛选出一株植物乳杆菌M6,此菌株总生物胺的降解率为67.33%;赵佳迪等[21]从酱油发酵醪中筛选出的菌株M-2,对组胺的降解率为52.88%,而本研究筛选出的菌株F1902、F2014总生物胺降解率均大于74%,对8种生物胺都具有较强的生物胺降解能力。菌株F1902和F2014的生物胺产生能力较弱,且它们的生物胺降解能力最强,因此选择此2株菌进行进一步的研究。
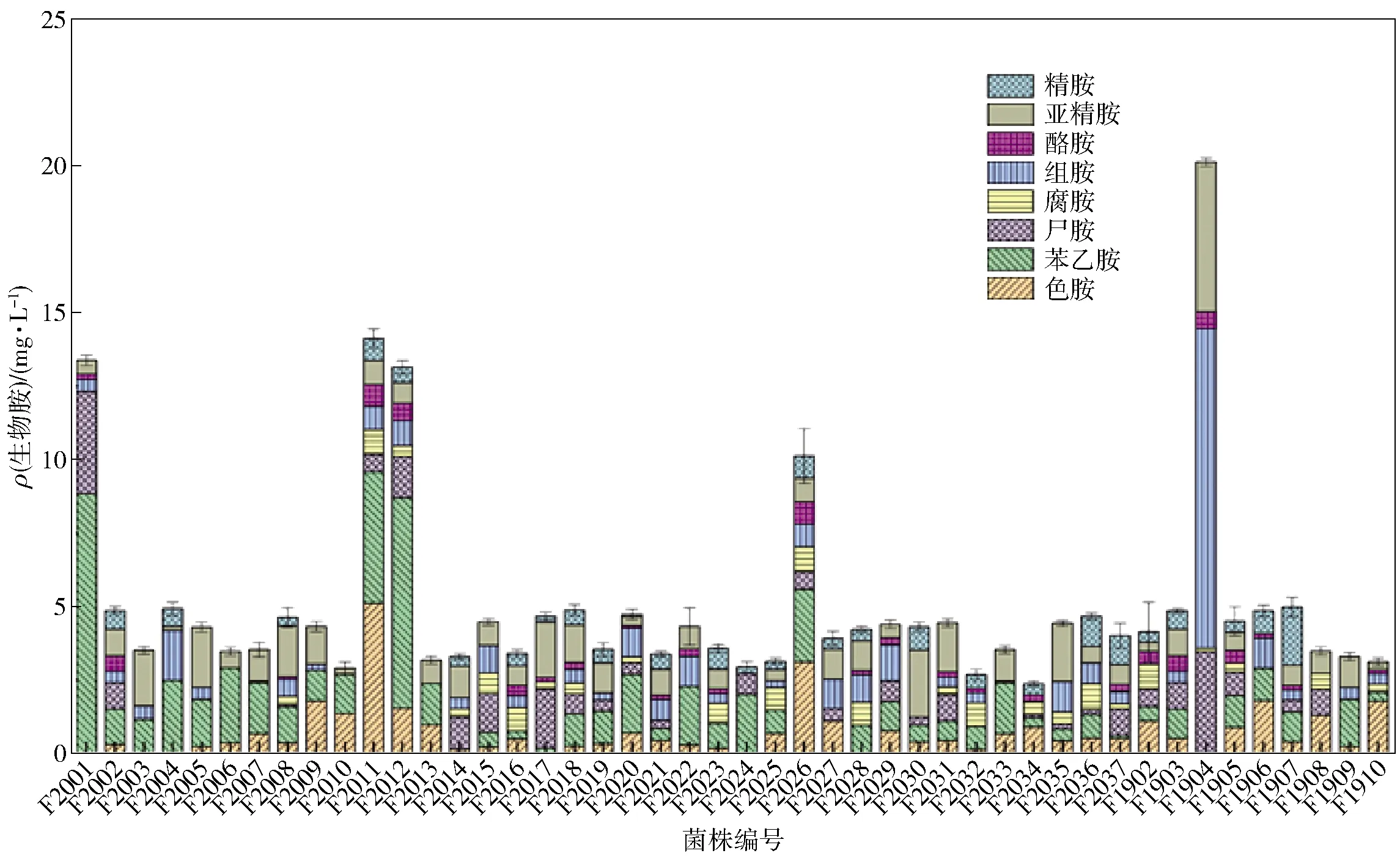
图1 不同菌株产生物胺能力的比较Fig.1 Biogenic amines producing ability of different strains
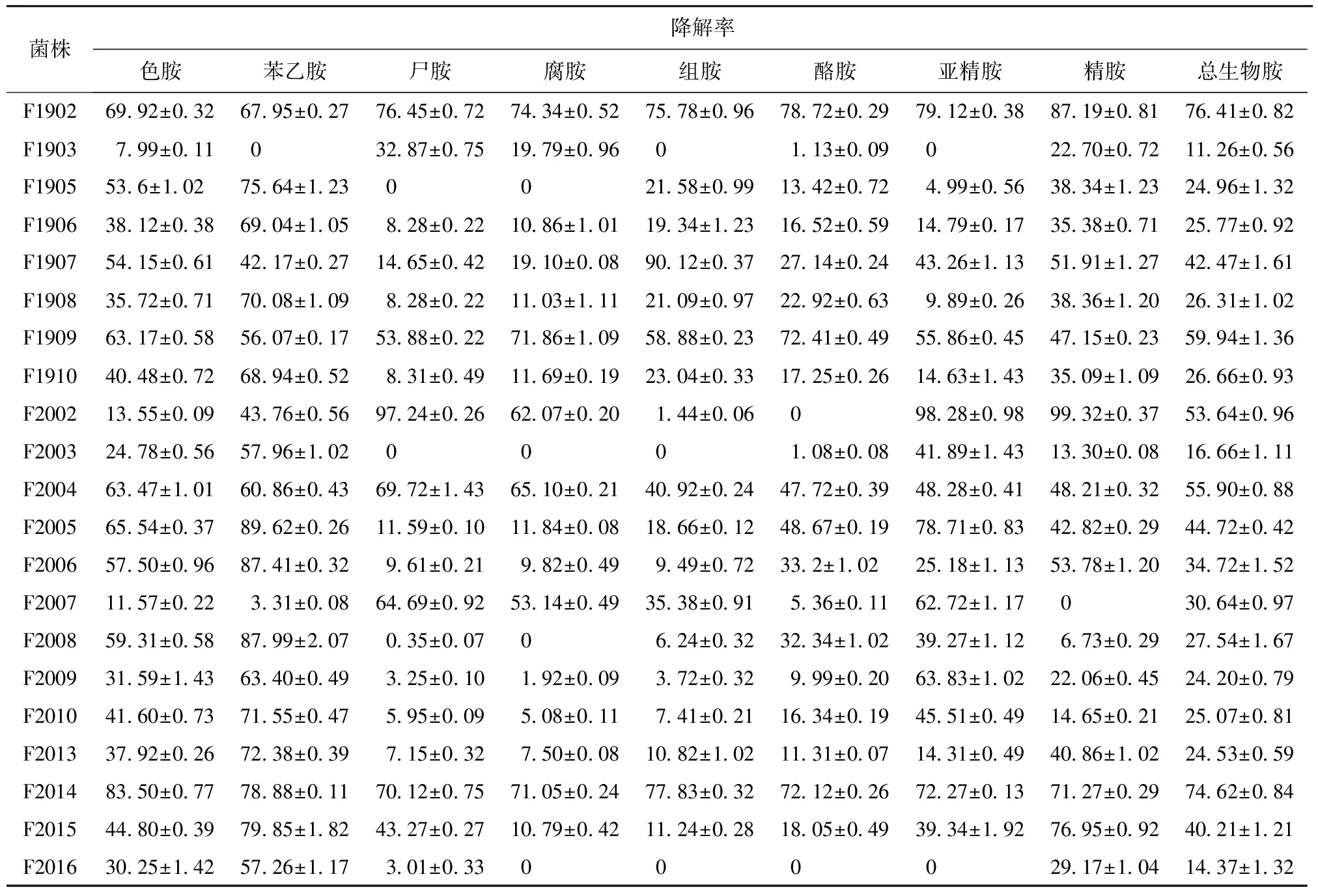
表1 放线菌生物胺培养基中不同糖多孢菌菌株的生物胺降解能力的比较Tab.1 Comparison of biogenic amines degrading ability of different Saccharopolyspora strains in actinomycetes bioamines medium %
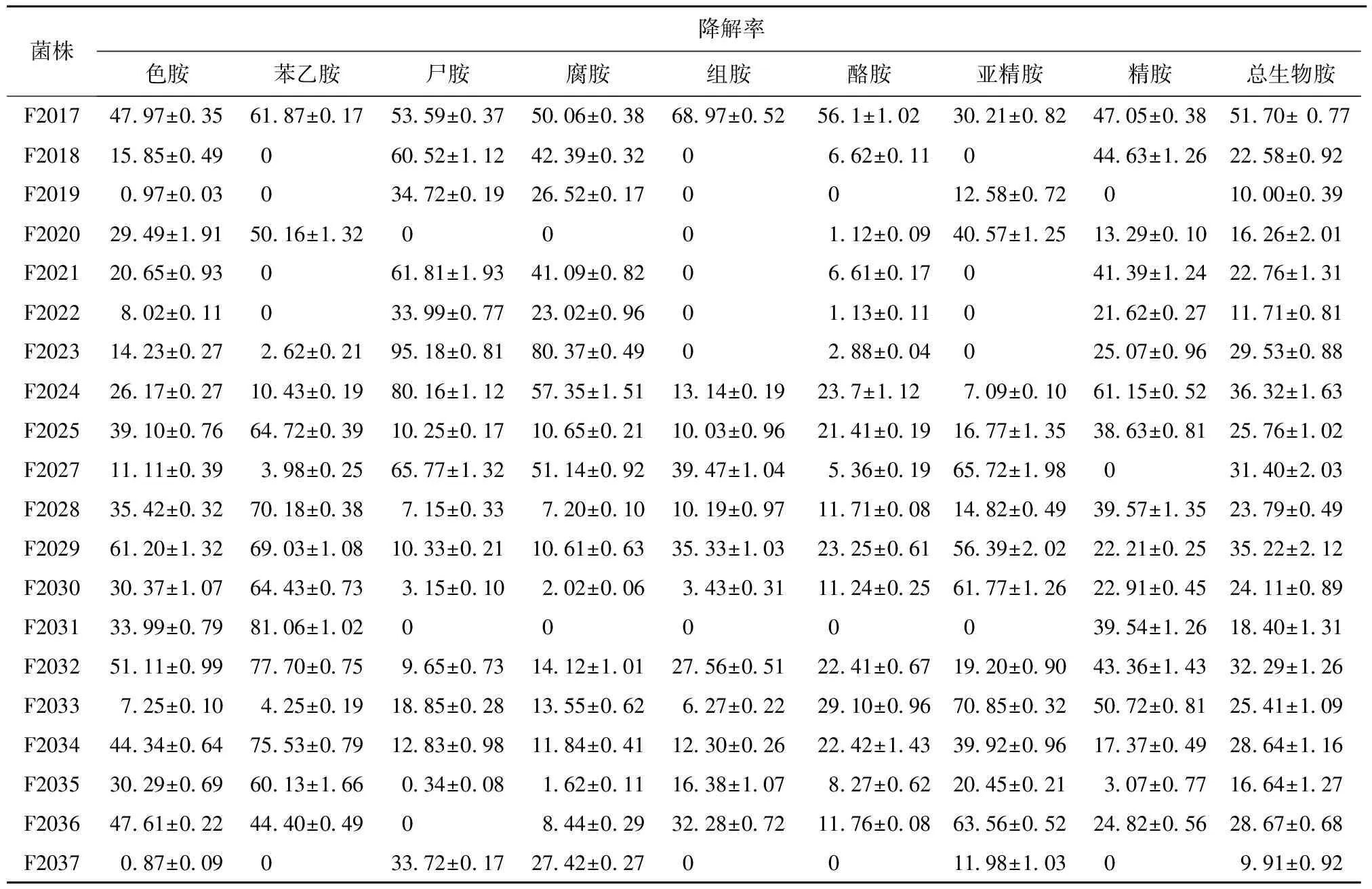
续表1 %
2.3 糖多孢菌F1902和F2014的菌株鉴定结果

图2 2株生物胺降解能力较强的糖多孢菌的菌落形态Fig.2 Colony morphology of two Saccharopolyspora strains with strong biogenic amine degrading ability
对选定的2株糖多孢菌进行观察,菌株F1902和F2014的单菌落特征见图2。由图2可知,菌株F1902菌落形态为圆形,基内菌丝为无色,为凝胶状,在放线菌培养基上不产色素,菌落凸起、难挑起;菌株F2014菌落形态为圆形,基内菌丝为棕黄色,气生菌丝为黄色,在放线菌培养基上可产生粉红色的可扩散色素,菌落凸起、难挑起。
将所得的2株糖多孢菌序列提交到GenBank数据库中,利用BLAST进行序列同源性分析,菌株F1902和F2014的系统发育分析结果见图3。由图3可知,菌株F1902与披发糖多孢菌亲缘关系最近,菌株F2014与玫瑰糖多孢菌亲缘关系最近。2株菌的生理生化特征结果见表2。由表2可知,菌株F1902可降解腺嘌呤、酪蛋白、七叶苷、弹性蛋白、淀粉、酪氨酸、尿素等物质,在25~50 ℃下可生长,与Saccharopolysporahirsuta特征一致;菌株F2014可降解腺嘌呤、酪蛋白、七叶苷、淀粉、酪氨酸、尿素等物质,在25~40 ℃下可生长,与Saccharopolysporarosea特征一致。
2.4 影响糖多孢菌降解生物胺能力的因素
环境对菌株的降解能力具有重要影响[22],为探究温度、pH值和乙醇浓度对糖多孢菌生物胺降解能力的影响,本研究将S.hirsutaF1902和S.roseaF2014添加至不同条件下的放线菌生物胺培养基中,探究菌株在不同环境条件下的生长情况及其生物胺降解能力,结果见图4。

图3 菌株F1902和F2014基于16S rRNA 基因序列的系统发育树Fig.3 Phylogenetic tree based on 16S rRNA gene sequence of F1902 and F2014
发酵温度会影响菌株生长和生物胺氧化酶活力,由图4(a)可知,当温度为35 ℃时,S.hirsutaF1902和S.roseaF2014的生长最好,总生物胺降解率也达到最高,分别为73.19%±1.83%和72.27%±1.81%。当温度超过35 ℃时,生物胺降解率随温度升高而降低,可能时由于当温度过高时,酶分子的空间结构会发生变化,胺氧化酶的活力有所下降导致的[23]。由图4(b)可知,不同pH值对2株菌的生长具有一定的影响,随着pH值的增加,菌株生长量以及总生物胺降解率均呈先增加后降低的趋势,当pH=7时,2株菌的生长最好,总生物胺降解率也达到最高,分别为73.78%±2.01%和72.89%±1.98%。由图4(c)可知,随着乙醇浓度的增加,糖多孢菌的生长量与总生物胺降解率随之降低,当乙醇体积分数为5%时,S.hirsutaF1902和S.roseaF2014的总生物胺降解率均低于30%,当乙醇体积分数为7%时,S.hirsutaF1902和S.roseaF2014的总生物胺降解率均低于20%,当乙醇体积分数大于7%时,2株糖多孢菌均不再生长。高浓度的乙醇会抑制糖多孢菌的生长,同时,乙醇会可抑制生物胺氧化酶活力[24]。

表2 菌株F1902和F2014的部分生理生化鉴定实验结果Tab.2 Partial physiological and biochemical identification results of F1902 and F2014
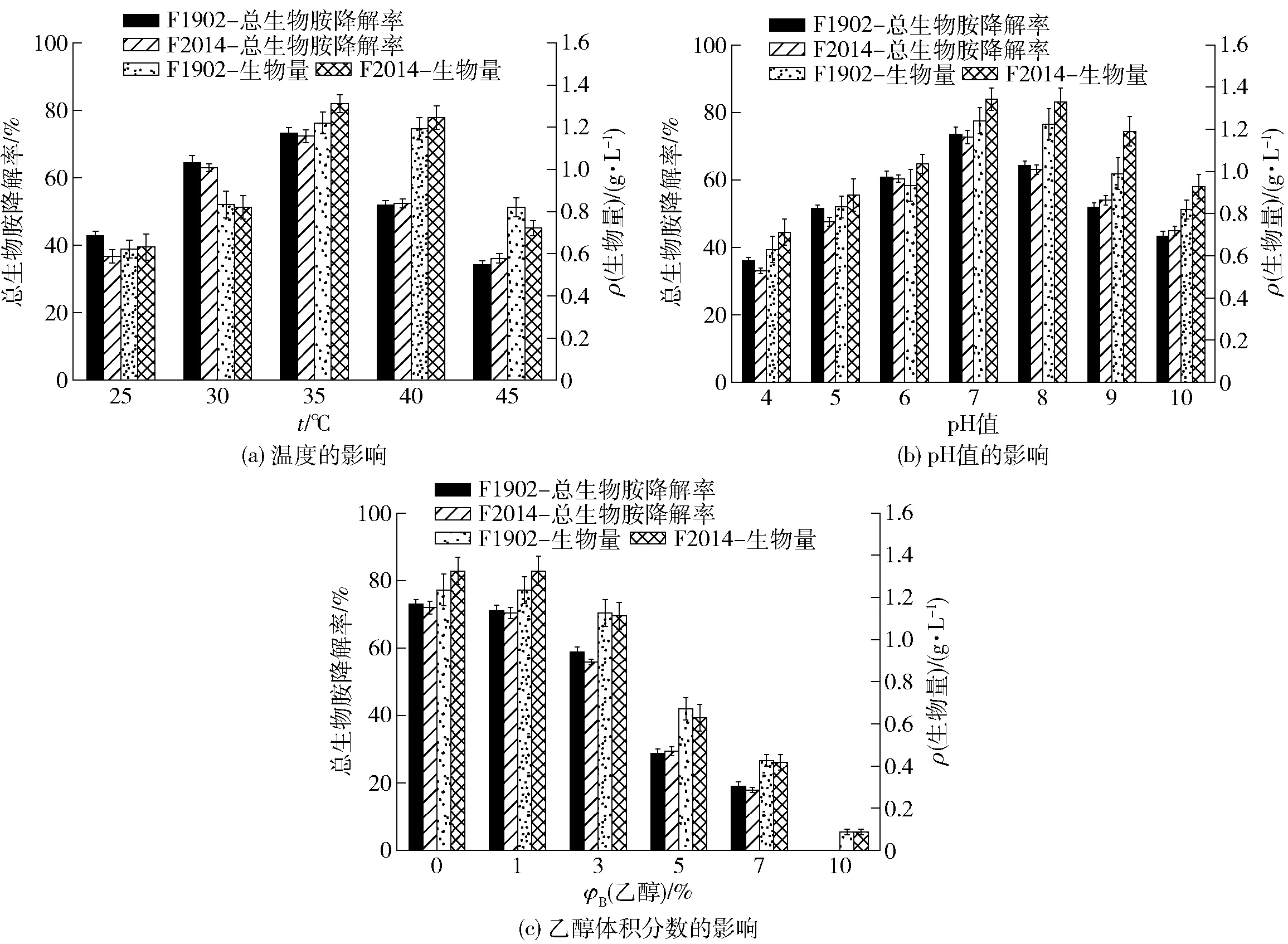
图4 环境条件对S.hirsuta F1902和S.rosea F2014降解生物胺的影响Fig.4 Effects of environmental conditions on degradation of biogenic amines by S.hirsuta F1902 and S.rosea F2014
3 结 论
利用具有降生物胺能力的微生物控制发酵食品的生物胺含量的研究越来越受到关注,尽管关于具有降解生物胺能力微生物的研究已有大量报道,但相关研究的降生物胺菌株主要属于乳酸菌、葡萄球菌等物种,关于其他微生物的降解生物胺能力的研究较少。为获得可降低黄酒中生物胺含量的菌株,本研究对黄酒发酵过程中的糖多孢菌进行了分离鉴定,并对其生物胺降解能力进行了探究。本研究从黄酒麦曲和发酵醪中共分离鉴定得37株糖多孢菌,以菌株产生物胺和降生物胺能力为评价指标,筛选获得2株低产生物胺且具有较强降生物胺能力的糖多孢菌(F1902和F2014)。经对菌株的分子生物学、生理生化指标进行鉴定,2株菌分别为披发糖多孢菌(Saccharopolysporahirsuta)和玫瑰糖多孢菌(Saccharopolysporarosea)。将分离得到的2株糖多孢菌在含有生物胺的培养基中于37 ℃发酵5 d,发现,两株糖多孢菌对总生物胺降解率分别高达76.41%±0.82%和74.62%±0.84%。进一步对2株菌在不同环境条件下的降生物胺能力进行研究,结果表明,温度、pH值和乙醇浓度均会影响糖多孢菌的生长及降生物胺能力。其中,S.hirsutaF1902和S.roseaF2014降解生物胺的较适温度为30 ℃,较适pH值为7,在添加体积分数7%乙醇的环境下仍能发挥一定的生物胺降解能力。
黄酒发酵过程包括前酵和后酵两个阶段,而生物胺的产生主要集中于前酵阶段,且黄酒发酵过程中的生物胺很大一部分来自浸米过程[25]。因此,利用生物强化技术将具有降解生物胺能力的糖多孢菌添加于黄酒发酵过程,降解发酵体系中已有的生物胺,或许是有效控制发酵过程中生物胺的含量的一种方式。本研究首次报道了黄酒酿造过程中糖多孢菌对生物胺的降解作用。
后续研究中我们将进一步将其应用于黄酒发酵过程中。尽管本研究仅初步探究了黄酒发酵过程中糖多孢菌的降生物胺能力,但由于其对生物胺良好的降解能力,其在控制黄酒发酵过程中生物胺含量的应用的潜力不容忽视。
