mTOR信号通路在调控猪繁殖与呼吸综合征病毒复制中的作用
2022-03-11李华玮赵绪永赵孟孟李新锋姬向波乔松林
李华玮,赵绪永,赵孟孟,李新锋,姬向波,乔松林
(1.河南牧业经济学院食品与生物工程学院,河南 郑州 450046;2.河南省非常规饲料资源创新利用重点实验室,河南 郑州 450046;3.佛山科学技术学院生命科学与工程学院,广东 佛山 528000;4.河南省农业科学院动物免疫学重点实验室,河南 郑州 450002)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的以各个阶段猪均可感染的高度接触性传染病[1],其临床症状基本表现为妊娠阶段母猪的早产、流产、死胎以及木乃伊胎等。1987年,PRRS首次在北美被发现,目前已经成为严重危害养猪业的病毒性疾病之一,给养猪业带来极为惨重的经济损失[2]。因此,探究PRRSV的复制机制及传播过程十分重要。哺乳动物雷帕霉素靶蛋白(mammalian target of Rapamycin,mTOR)是细胞生长和增殖的重要调节因子,mTOR信号通路是调控细胞代谢、发育、存活、衰老、肿瘤发生和炎症的重要途径[3-4]。mTOR是磷酸肌醇3激酶(phosphoric inositol 3 kinase,PI3K)相关家族的重要丝氨酸/苏氨酸蛋白激酶,包括复合物1(mTORC1)和复合物2(mTORC2),其中雷帕霉素(Rapamycin)是mTORC1的特异性抑制剂[5]。近年来研究证实,利用PI3K/蛋白激酶B(protein kinase B,AKT)/mTOR信号通路可以促进病毒蛋白的表达、复制和装配,以及抑制宿主的抗病毒活性[6]。WANG等[7]研究表明,mTOR信号通路的抑制以及腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)信号通路激活可促进甲型流感病毒的复制。PENG等[8]研究发现,丙型肝炎感染激活mTOR是细胞抗病毒的措施之一,其中mTORC1有抑制丙型肝炎RNA复制的功能,但却有利于病毒粒子的包装和释放。关于mTOR信号通路与PRRSV复制的相关性也有诸多报道。ZHANG等[9]研究发现,PRRSV感染Mo-DCs细胞能够激活PI3K/AKT/mTOR信号通路,用PI3K抑制剂LY294002处理细胞,PRRSV的复制显著受到抑制。WANG等[10]研究发现,AKT发生突变时PPRSV的复制受到抑制,而AKT过表达促进PRRSV复制。LIU等[11]研究发现,Rapamycin处理MARC-145细胞能够抑制PRRSV增殖,该抑制作用是通过mTOR抑制剂激活干扰素受体IFNAR1和IFNAR2导致的。而与此同时,PUJHARI等[12]发现在PRRSV感染后经Rapamycin处理的细胞病毒滴度显著增高,这与LIU等[11]的报道不一致。
为了进一步明确mTOR通路在调控PRRSV复制过程中的作用,本研究使用PRRSV感染的天然宿主原代猪肺泡巨噬细胞(porcine alveolar macrophage,PAMs)进一步进行试验,试验数据更接近于猪体内感染的真实情况。在感染复数(multiplicity of infection,MOI)=0.1的PRRSV感染PAMs 36 h,本课题组前期观察到部分细胞崩解死亡,于是选择感染24 h的样品进行试验,并使用蛋白质印迹(western blot,WB)技术检测mTOR信号通路下游信号分子的表达水平及磷酸化水平。同时,进一步验证了以Rapamycin处理细胞后对mTOR信号通路以及对PRRSV复制的影响,以期阐明mTOR信号通路在调控PRRSV复制中的作用。
1 试验材料
1.1 病毒和细胞
HN07-1病毒为河南农业科学动物免疫学重点实验室分离保存(GeneBank登陆号:KX766378.1)并惠赠。PAMs分离自无特定病原体猪[13]。其中,PRRSV、猪圆环病毒2型、伪狂犬病病毒、猪瘟病毒以及猪细小病毒的抗原和抗体检测均为阴性,冻存于-80 ℃。试验过程符合动物伦理要求及动物福利法相关规定。
1.2 抗体和主要试剂
EDTA-胰蛋白酶(EDTA-tripsin)、RPMI 1640培养基、二甲基亚砜(dimethyl sulfoxide,DMSO)、焦碳酸二乙酯水(diethyl pyrocarbonate,DEPC)购自索莱宝生物有限公司。PRRSV N蛋白单抗由本实验室保存。β-Actin、eIF4E结合蛋白1(eukaryotic initiation factor 4E binding protein 1,4EBP1)、P-4EBP1、mTOR、P-mTOR、PS6K和P-PS6K单抗购自美国CST公司。异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)及辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔及羊抗鼠的二抗购自美国Abbkine公司。Rapamycin购自美国MCE公司。RIPA细胞裂解液、5×蛋白上样缓冲液、化学发光液、聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)蛋白定量试剂盒购自上海碧云天生物技术有限公司。蛋白预染Marker购自美国Thermo公司。聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)购自美国Millipore公司。MTS检测试剂盒购自美国Promega公司。
1.3 主要仪器设备
HR40-IIB2生物安全柜购自中国海尔公司;SW-CJ-2FD超净工作台购自苏州AIRTECH(苏净安泰)公司;EPS-600电泳仪、Tanon 4200凝胶成像仪购自上海Tanon公司;Trans-Blot Turbo半干转膜仪购自美国Bio-Rad公司;IX53荧光倒置显微镜购自日本奥林巴斯公司;Nanodrop 1000蛋白核酸浓度测定仪、Multifuge X1R台式高速冷冻离心机购自美国Thermo公司;BWS-10恒温水浴锅购自上海蓝豹实验仪器有限公司。
2 试验方法
2.1 PRRSV感染对mTOR信号通路的影响
分别在HN07-1病毒感染后0、6、12、24 h收获PAMs,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤细胞后,用EDTA-Tripsin于37 ℃消化细胞3 min,用生长液中止胰蛋白酶的消化,反复吹打细胞使其完全脱壁,1 000 r·min-1离心10 min,弃上清液。收获的细胞样品做好标记冻存于-80 ℃。将每管细胞样品加入一定量的RIPA裂解液,冰上裂解30 min,12 000 r·min-1离心5 min,去除细胞碎片,上清液用BCA试剂盒和酶标仪测定蛋白含量。以相同蛋白上样量,采用SDS-PAGE和WB检测mTOR信号通路的信号分子4EBP1、P-4EBP1、mTOR、P-mTOR、PS6K以及P-PS6K表达量的变化。使用Image J软件计算各个蛋白的灰度值相对内参的表达趋势,以及磷酸化蛋白相对于总蛋白的比例。
2.2 PRRSV灭活效果的免疫荧光检测
将HN07-1病毒经紫外线(ultraviolet,UV)照射3、12 h后收获灭活病毒。用未灭活及2种灭活病毒分别处理PAMs,24 h后用PBS洗涤细胞,加入预冷甲醇固定细胞,用加入Tween 20的磷酸缓冲盐溶液(PBST)配制的脱脂奶封闭过夜,加入抗N蛋白单抗37 ℃孵育1 h,PBST充分洗涤细胞,再加入FITC标记的羊抗鼠的二抗,37 ℃孵育40 min。荧光图片用奥林巴斯倒置荧光显微镜进行拍摄。
2.3 灭活PRRSV对mTOR信号通路影响的验证
用灭活12 h的PRRSV作用于PAMs,分别在处理后0、6、12、24 h收获细胞,样品制备方法同2.1。使用4EBP1、P-4EBP1、mTOR、P-mTOR、PS6K和P-PS6K的单抗作为一抗,采用WB验证灭活PRRSV对mTOR信号通路的影响。
2.4 Rapamycin对细胞活性影响的验证
采用MTS法,分别将0.5、1、10、100 nmol的Rapamycin加入细胞培养板中,各做3个复孔,并以加入培养基的板孔(0 nmol的Rapamycin)作为对照,将细胞板放入CO2培养箱培养24 h,加入MTS检测试剂混匀,使用分光光度计测定490 nm处的吸光值;将10 nmol的Rapamycin加入细胞培养板中,以加入培养基的板孔作为对照,分别于0、12、24、36 h后取出加入MTS试剂,使用分光光度计测定490 nm处的吸光值。
2.5 Rapamycin对mTOR信号通路下游4EBP1的影响
将0.5、1、10、100 nmol的Rapamycin加入血清体积分数为3%的RPMI 1640培养基中,37 ℃、体积分数为5%CO2环境中培养细胞,接种MOI=0.1的HN07-1,24 h后收获细胞样品。WB检测4EBP1及P-4EBP1的表达情况;将10 nmol Rapamycin加入PAMs的生长液中,细胞培养及病毒接种的方法同上,分别在感染后0、12、24、36 h收获细胞。采用WB检测4EBP1及P-4EBP1的表达情况。
2.6 Rapamycin对PRRSV复制的影响
细胞培养以及试验方法同2.5,使用PRRSV N蛋白单抗作为一抗,采用WB检测Rapamycin对PRRSV复制的影响。
2.7 统计学分析
试验数据使用GraphPad Prism 8软件,采用双样本等方差t检验进行统计分析。
3 结果与分析
3.1 PRRSV感染对mTOR信号通路的影响
在PRRSV感染下,mTOR 信号通路信号分子的变化情况如图1-A所示。各个蛋白的灰度值相对内参的表达趋势,以及磷酸化蛋白相对于总蛋白的比例如图1-B所示。结果发现,PRRSV感染后24 h,P-PS6K表达趋势升高但差异不显著(P>0.05),P-mTOR相对于总蛋白表达趋势显著升高(P<0.05),P-4EBP1极显著提高(P<0.01),说明PRRSV感染激活mTOR信号通路。

3.2 免疫荧光验证PRRSV灭活效果
分别使用UV灭活3、12 h的HN07-1感染PAMs。免疫荧光(IFA)检测结果显示(图2),未加病毒的细胞孔中无荧光,HN07-1感染PAMs细胞24 h后细胞中呈现大量绿色荧光信号,而经过UV灭活3、12 h的PRRSV均无荧光信号呈现,同时白光下可以观察到这4组细胞生长状态良好。该结果说明UV照射3 h即可使PRRSV灭活,且灭活3、12 h的病毒均可用于后续研究。

图2 IFA验证UV照射灭活病毒的效果Fig.2 IFA was used to verify the effect of UV irradiation on inactivated virus
3.3 灭活PRRSV对mTOR信号通路的影响
灭活HN07-1分别处理PAMs 0、6、12、24 h后收获细胞,通过WB证实mTOR信号通路信号分子的变化情况(图3)。结果发现,mTOR信号通路中P-mTOR、P-PS6K、P-4EBP1、mTOR、PS6K和4EBP1在灭活病毒处理后各个时间点均无显著变化,表明灭活病毒不能激活mTOR信号通路。

图3 WB验证灭活PRRSV对mTOR信号通路的影响Fig.3 WB was used to verify the effect of inactivated PRRSV on mTOR signaling pathway
3.4 Rapamycin对细胞活性的影响
将0.5、1、10和100 nmol的Rapamycin作用细胞24 h,以培养基板孔为对照,同时将10 nmol的Rapamycin作用细胞0、12、24和36 h,最后与MTS检测试剂混合后,使用分光光度计测定490 nm处的吸光值(图4)。结果发现,不同物质的量的Rapamycin作用细胞24 h以及10 nmol的Rapamycin作用细胞不同时间均对细胞自身活性无显著影响。

注:(A)不同物质的量Rapamycin对细胞活性的影响;(B)不同处理时间Rapamycin对细胞活性的影响。Note:(A) The effect of Rapamycin at different concentrations on cell viability; (B) Effects of Rapamycin at different treatment times on cell viability.
3.5 Rapamycin对PRRSV感染引起的4EBP1磷酸化的影响
用0.5、1、10和100 nmol的Rapamycin分别作用于PAMs 1 h后接种MOI=0.1 HN07-1,在感染24 h收获细胞样品。结果表明,Rapamycin处理PAMs后能够抑制由PRRSV感染所引起的4EBP1磷酸化,这种抑制作用对Rapamycin有剂量依赖性,对4EBP1蛋白水平的影响不显著(图5-A)。用10 nmol的Rapamycin作用于PAMs 1 h后接种MOI=0.1 HN07-1,分别在感染0、6、12和24 h收获样品。结果表明,使用10 nmol Rapamycin处理PAMs后对4EBP1 蛋白水平的影响不显著,但能够抑制由PRRSV感染所引起的4EBP1磷酸化(图5-B)。

注:(A)不同物质的量Rapamycin对4EBP1磷酸化的影响;(B)不同处理时间Rapamycin对4EBP1磷酸化的影响。Note:(A) The effect of Rapamycin at different concentrations on the phosphorylation of 4EBP1; (B) The effect of Rapamycin at different treatment times on the phosphorylation of 4EBP1.
3.6 Rapamycin对PRRSV复制的影响
分别用0.5、1、10、100 nmol Rapamycin分别处理PAMs 1 h后接种MOI=0.1 的HN07-1,在感染24 h收获细胞样品。WB检测PRRSV N蛋白水平,结果表明Rapamycin处理PAMs对PRRSV的复制有促进作用,这种促进作用对Rapamycin有剂量依赖性(图6)。

注:(A)不同物质的量Rapamycin对PRRSV复制的作用;(B)添加不同物质的量Rapamycin后PRRSV N蛋白表达量的相对灰度值变化。Note:(A)The effect of Rapamycin of different concentrations on the replication of PRRSV.(B) Changes of relative gray value of PRRSV N protein expression after adding different concentrations of Rapamycin.
用10 nmol Rapamycin处理PAMs 1 h后接种MOI=0.1 HN07-1,分别在感染0、6、12和24 h收获细胞样品,检测PRRSV N蛋白的表达。结果表明,使用10 nmol Rapamycin处理PAMs后在PPRSV感染的不同时间都能够促进病毒复制(图7)。
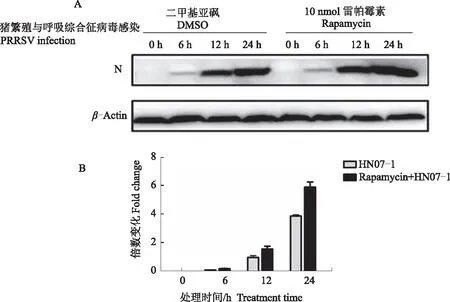
注:(A)10 nmol Rapamycin处理PAMs不同时间对PRRSV复制的影响;(B)10 nmol Rapamycin处理PAMs不同时间对PRRSV N蛋白表达相对灰度值的变化。
4 结论与讨论
mTOR信号通路通过上游的PI3K-AKT级联启动可调控蛋白质合成、细胞凋亡以及细胞自噬等生物学过程[14]。下游的靶蛋白核糖体蛋白S6K1(S6 kinase 1)和蛋白质翻译起始因子4EBP1调控蛋白质翻译以及细胞周期,参与调节细胞的生长和增殖[15]。本研究发现,PRRSV感染PAMs 24 h后,mTOR信号通路被激活,mTOR、PS6K和4EBP1的磷酸化水平都显著上调。用UV灭活的PRRSV作用于PAMs,不能引起mTOR、PS6K和4EBP1的磷酸化,这说明该信号通路的活化是由PRRSV复制所引起,该结果与前人在MARC-145细胞上的试验结果相一致[12]。本研究中Rapamycin处理PAMs后,PRRSV的复制被显著促进,这与PUJHARI等[12]的研究结果一致。大多数真核生物的mRNA都具有3’poly A尾巴和5’甲基化的帽子结构,并利用帽子结构依赖性翻译系统进行mRNA翻译。翻译起始过程的核心元件是翻译起始复合体eIF4F,该复合体由eIF4E、eIF4G和eIF4A共3个组分构成,由PI3K/Akt/mTOR信号通路相关信号分子的磷酸化级联反应所调控[16]。4EBP1是eIF4E的阻遏蛋白,当收到病毒入侵等外界信号刺激时,4EBP1发生磷酸化与eIF4E解离,eIF4E被释放到胞质中结合mRNA5′端的帽子结构,促使翻译的起始[17]。70 kD核糖体蛋白S6激酶(PS6K)是丝氨酸/苏氨酸激酶,该激酶能磷酸化核糖体40S亚基的S6蛋白促进mRNA 5′端核糖体蛋白质和延伸因子翻译的起始[18]。
此外,本研究中Rapamycin处理PAMs后,mTOR信号通路下游信号分子P-4EBP1的磷酸化水平显著下降,而PS6K的磷酸化水平则无显著变化,说明Rapamycin作用于mTOR下游的4EBP1信号通路。前人研究发现,一些病毒复制时不使用或减少eIF4F复合物的起始因子,且在大多数情况下这些病毒使这种蛋白复合物的1个或多个组分失活,其主要靶点之一是eIF4E[19-20]。汉坦病毒中核衣壳蛋白取代了翻译起始复合物eIF4F以及翻译起始蛋白eIF4E的功能[21]。肠病毒71型通过诱导miRNA(miR-141)的合成减少eIF4E表达,有利于非帽子(cap)依赖性翻译。如果降低miR-141的活性并且维持eIF4E水平会抑制病毒的复制[22],这表明eIF4E的缺失是产生新病毒的必要条件。脑心肌炎病毒(encephalomyocarditis virus,EMCV)感染的细胞中4EBP1蛋白去磷酸化,没有形成eIF4F复合物。EMCV的mRNAs具有IRES结构,能够独立于eIF4F复合物进行高效翻译[23]。本研究证实,Rapamycin处理PAMs后能导致PRRSV感染所引起的4EBP1磷酸化水平降低,这会导致eIF4E释放的减少。而作者前期研究证实,体外敲低eIF4E的表达不会影响PRRSV的复制(数据未发表)。由于eIF4E是帽子依赖性翻译机制的重要结构元件之一,这为后续进一步探索PRRSV复制的翻译起始机制奠定基础。
