miR-127-3p对口腔鳞状细胞癌细胞增殖、迁移及Zwint-1基因表达的影响
2022-03-11钱伟祥武艳飞杨卫平
钱伟祥,武艳飞,杨卫平,邵 莉
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部常见上皮性恶性肿瘤,约占所有口腔恶性肿瘤的80%以上,由于肿瘤恶性程度高、生长迅速常导致癌组织缺血缺氧甚至坏死,造成病情进展快、死亡率高[1-2]。目前OSCC诊疗技术(手术、放化疗等)虽不断完善和进步,但患者预后仍较差,5年生存率在50%以下[3]。因此,探寻OSCC新型生物治疗靶标已成为临床研究热点。微小RNA(microRNA,miRNA)是一种内源性非编码RNA小分子,参与细胞增殖、凋亡等生理学过程[4]。miR-127-3p属于miRNAs家族成员之一,既往研究显示,过表达miR-127-3p能够显著抑制OSCC细胞增殖及转移,抑制OSCC进展[5]。Zeste white 10(ZW10)相互作用着丝粒蛋白1(ZW10-interacting kinetochore protein 1,Zwint-1)是真核细胞有丝分裂过程中关键检查站蛋白,主要定位于染色体着丝粒上,能够调控细胞周期,研究表明,其异常表达与恶性肿瘤发生关系密切[6-7]。周洁等[8]研究显示,与头颈部鳞状细胞癌患者癌旁组织比较,肿瘤组织中Zwint-1表达水平显著升高,且提示Zwint-1是头颈部鳞状细胞癌潜在生物学靶标。Zhou等[9]研究显示,miR-204通过靶向下调Zwint表达抑制乳腺癌细胞增殖及转移。然而,有关miR-127-3p能否通过调控Zwint-1影响OSCC细胞生物学行为研究鲜有报道,因此本研究探讨miR-127-3p与Zwint-1对OSCC细胞增殖、侵袭迁移的影响,并分析二者靶向关系,以期为临床寻找有效新型生物学靶标提供一定理论参考。
1 材料与方法
1.1 主要材料与仪器
人源口腔鳞状细胞癌细胞系PE/CA-PJ15细胞株(CBP60828)购自南京科佰生物科技有限公司;人口腔鳞状细胞癌CAL27、SCC25、SCC15、SCC9细胞株由武汉大学口腔医学院提供;人口腔角质形成细胞(human oral keratinocytes,HOK)由北京大学口腔医院提供。
IMDM培养基(PM150510)购自武汉益普生物科技有限公司;四甲基偶氮噻唑蓝(MTT)(SY0502)、蛋白提取试剂盒(CD-02273-ML)、反转录试剂盒(RP1105-100T)、AceQqPCR SYBR Green Mix(ALH185)、Trizol Reagent核酸分离试剂(15596-018)、双荧光素酶报告基因检测试剂盒(DLG-4997)购自武汉纯度生物科技有限公司;LipofectamineTM3000转染试剂盒(HUDY03)购自北京泽平科技有限责任公司;兔抗人细胞增殖相关核抗原(Ki-67)(FNab09788)、E-钙粘附蛋白(E-cadherin)(10204-H08B)、N-钙粘附蛋白(N-cadherin)(11039-H08BL)、波形蛋白(Vimentin)(10028-H08B)、Zwint-1(A300-781A)、β-肌动蛋白(β-actin)(CERB0168)、山羊抗兔HRP(SE12-0.1)二抗均购自上海钰博生物科技有限公司。小鼠Bax单克隆抗体(ab3191)、兔Bcl-2多克隆抗体(ab196495)均购自Abcam公司。miR-127-3p-mimics及其阴性对照(miR-127-3p-mimics-NC)均由上海生工生物有限公司合成。
CO2细胞培养箱(型号BC-J80S型)、酶标仪(型号ELx800)购自美国Bio-rad公司;C1000型荧光定量PCR仪购自美国Bio-rad公司。
1.2 方法
1.2.1 细胞培养 取各细胞系解冻、复苏,于含10%灭活胎牛血清(fatal bovine serun,FBS)+IMDM培养液、37 ℃、5% CO2、95% O2培养箱中培养,每2~3 d换液,无菌操作,传代培养。
1.2.2 细胞瞬时转染及分组处理 取1.2.1培养的对数生长期PE/CA-PJ15、CAL27细胞接种于24孔板(2.5×104个/孔),培养24 h后,更换无FBS的培养液,采用LipofectamineTM3000进行转染,根据不同分组细胞各自处理。①空白对照组(NG组):细胞不做特殊处理;②阴性转染组(NC组):加入5 μL LipofectamineTM3000和50 mmol/L miR-127-3p-mimics-NC;③过表达miR-127-3p组(miR-127-3p-mimics组):加入5 μL Lipo-fectamineTM3000和50 mmol/L miR-127-3p-mimics。严格按照转染试剂盒说明书进行操作,培养细胞48 h后,倒置荧光显微镜下观察细胞绿色荧光强度,收集各组PE/CA-PJ15、CAL27细胞用于后续实验。
1.2.3 实时荧光定量PCR法检测各组细胞中miR-127-3p、Zwint-1 mRNA表达水平 Trizol法提取各组细胞总RNA并测定浓度。以RNA为模板进行逆转录合成cDNA。体系20 μL:UltraSYBR mixture(10 μL)、模板cDNA(2.0 μL)、上下游引物(各2.0 μL)、去离子纯化水(4.0 μL);条件(40个循环):93 ℃ 30 s、93 ℃ 5 s、65 ℃ 30 s。引物序列见表1,由赫澎(上海)生物科技有限公司设计并合成,以β-actin为内参,以2-ΔΔCt法计算miR-127-3p、Zwint-1 mRNA含量。
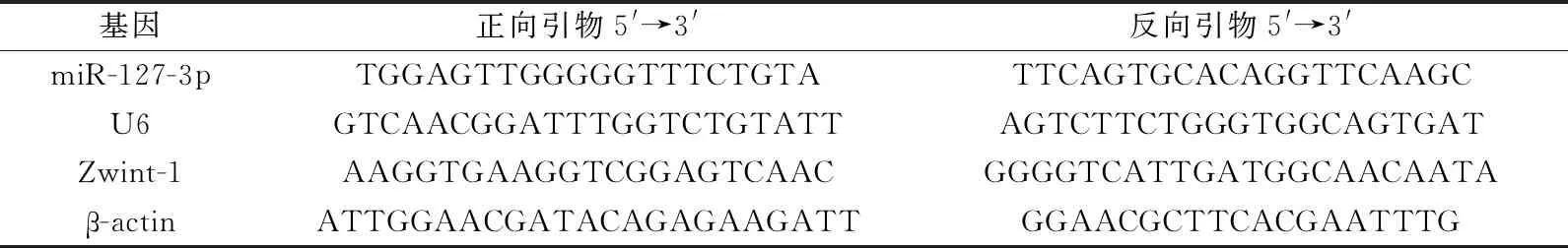
表1 引物序列
1.2.4 MTT法检测各组细胞增殖能力 取1.2.2各组培养48 h后的PE/CA-PJ15、CAL27细胞重悬并接种于24孔板(2.5×105个/孔),分别于48 h后向各孔加入20 μL MTT,4 h后,弃上清,加DMSO(150 μL),振荡、溶解。测定490 nm处各孔细胞光密度(optic density,OD)值,重复3次,取平均值。计算细胞增殖抑制率(%)=(1-实验组OD值/NG组OD值)×100。
1.2.5 划痕实验检测各组细胞迁移能力 取1.2.2各组培养48 h后的各组细胞,消化并接种于24孔板(2.5×105个/孔),待细胞长满板底后,用枪头(100 μL)划痕,PBS冲洗掉细胞碎片,更换无FBS的培养基进行光照、培养,倒置荧光显微镜下观察0 h、24 h划痕宽度(h),重复3次。划痕愈合率(%)=(h0-h24)/h0×100。
1.2.6 Transwell实验检测各组细胞侵袭能力 取50 μL液态Matrigel基质胶(2.0 mg/mL)置于Transwell小室上层,于37 ℃凝固30 min,取1.2.2各组培养48 h后的PE/CA-PJ15、CAL27细胞,重悬,接种至Transwell小室上层(3×103个/孔),下层加入600 μL含10% FBS的培养基,孵育24 h。用棉签擦除上层未迁移细胞,下层以4%甲醛溶液固定15 min,去除固定液,0.2%结晶紫染色20 min,清水冲洗,晾干封片。采用Image J软件统计拍照、统计各组细胞侵袭数。重复3次。
1.2.7 免疫印迹法检测Zwint-1增殖、迁移及侵袭相关蛋白表达情况 取1.2.2各组培养48 h后的PE/CA-PJ15、CAL27细胞,以RIPA裂解并提取总蛋白,检测浓度及纯度,行12% SDS-PAGE电泳,转膜,放入脱脂奶粉(5%)溶液室温封闭2 h,分别加入一抗Zwint-1、增殖相关蛋白(Ki-67)、凋亡相关蛋白(Bax、Bcl-2)迁移及侵袭相关蛋白(E-cadherin、N-cadherin、Vimentin)及内参β-actin,均为1∶1 000的稀释比,4 ℃过夜,加入HRP标记山羊抗兔二抗(1∶5 000),室温孵育1 h,显影、定影,半定量分析各蛋白含量。
1.2.8 双荧光素酶报告基因实验 数据库(TargetScan)显示miR-127-3p基因与Zwint-1核苷酸存在结合位点,根据miR-127-3p基因与Zwint-1-3′UTR结合位点的预测结果,采用PCR技术扩增Zwint-1-3′UTR序列中包含与miR-127-3p存在结合位点的片段。将miR-127-3p-mimics与Zwint-1基因位点结合片段插入到荧光素酶pGL4载体中,构建Zwint-1野生型质粒(Zwint-1-WT),并利用基因突变技术将个别结合位点序列突变,构建突变型质粒(Zwint-1-MT)。使用LipofectamineTM3000将Zwint-1-WT、Zwint-1-MT分别与miR-127-3p-mimics-NC、miR-127-3p-mimics共转染于PE/CA-PJ15细胞,分别为miR-127-3p-mimics-NC-Zwint-1-WT组、miR-127-3p-mimics-Zwint-1-WT组、miR-127-3p-mimics-NC-Zwint-1-MT组、miR-127-3p-mimics-Zwint-1-MT组,转染48 h后,用PBS洗涤细胞,加入RIPA裂解液(250 μL)于室温下摇床中摇晃15 min裂解细胞,收集裂解液,加入50 μL荧光素酶检测试剂Ⅱ,以自动荧光素酶检测仪测定荧光强度A,之后加入Stop&Glo试剂,测定荧光强度B,以A/B表示荧光素酶相对活性。
1.3 统计学分析
2 结 果
2.1 OSCC细胞中miR-127-3p表达水平比较
与HOK细胞比较,OSCC各细胞系中miR-127-3p表达水平均显著降低(P<0.05)。因此选择OSCC各细胞系miR-127-3p表达水平较高的CAL27细胞和miR-127-3p表达水平较低的PE/CA-PJ15细胞进行后续转染实验。见表2。
表2 HOK细胞和OSCC各细胞系中miR-127-3p表达水平比较
2.2 细胞转染效果比较
NC组、miR-127-3p-mimics组镜下均可见较强绿色荧光,且与NG组、NC组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞miR-127-3p表达水平显著升高(P<0.05),说明PE/CA-PJ15、CAL27细胞均转染成功。详见图1及表3。
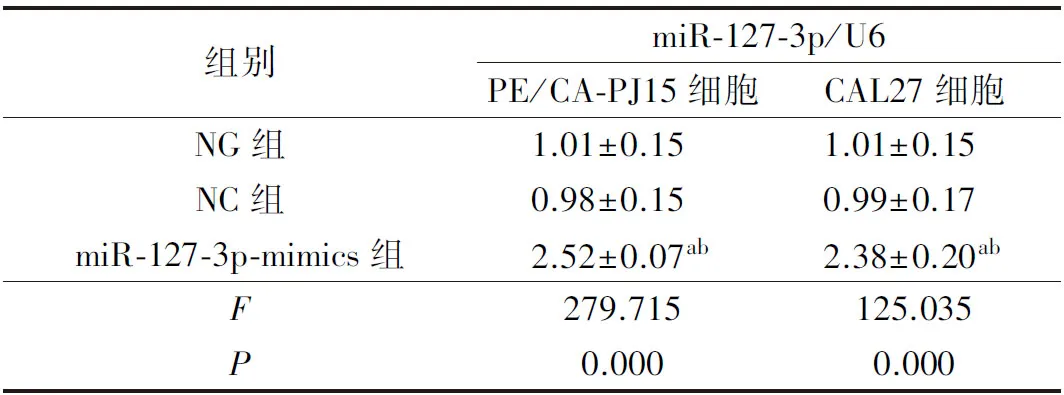
表3 各组PE/CA-PJ15、CAL27细胞miR-127-3p水平比较
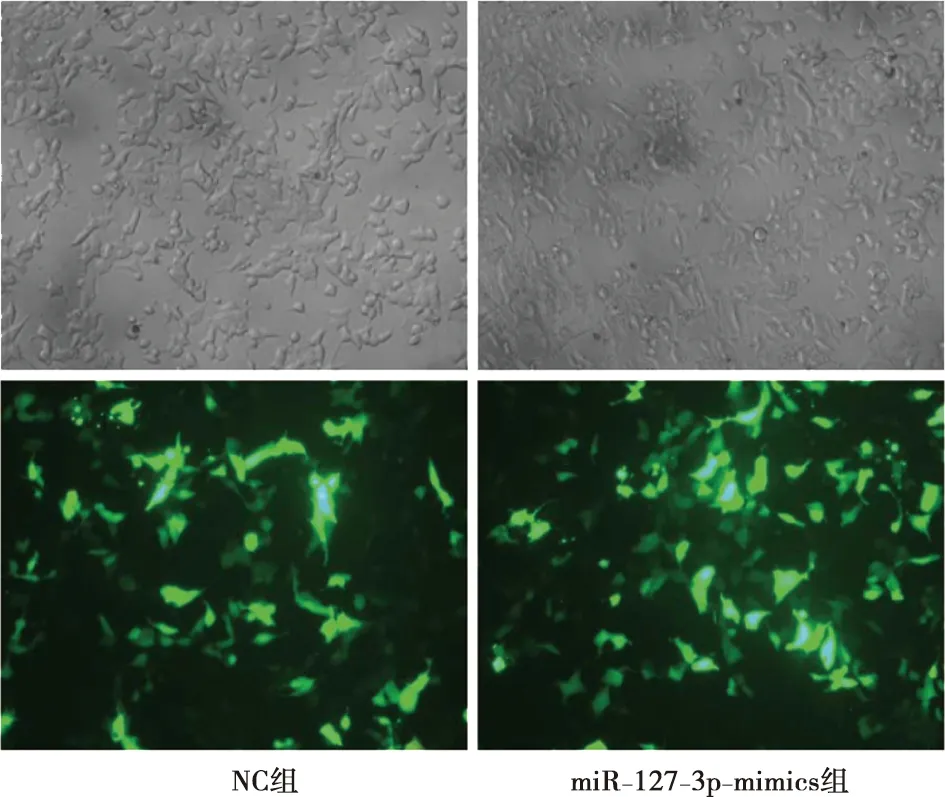
图1 细胞转染效果比较( ×200)
2.3 各组细胞增殖情况比较
与NG组、NC组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞增殖抑制率显著升高(P<0.05)。详见表4。
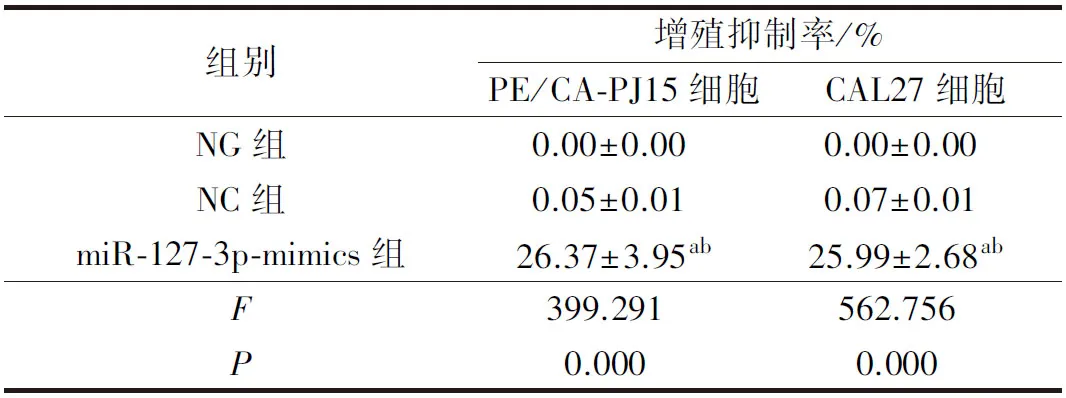
表4 各组PE/CA-PJ15、CAL27细胞增殖情况比较
2.4 各组细胞迁移情况比较
与NG组、NC组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞划痕治愈率显著降低(P<0.05)。详见图2、图3及表5。
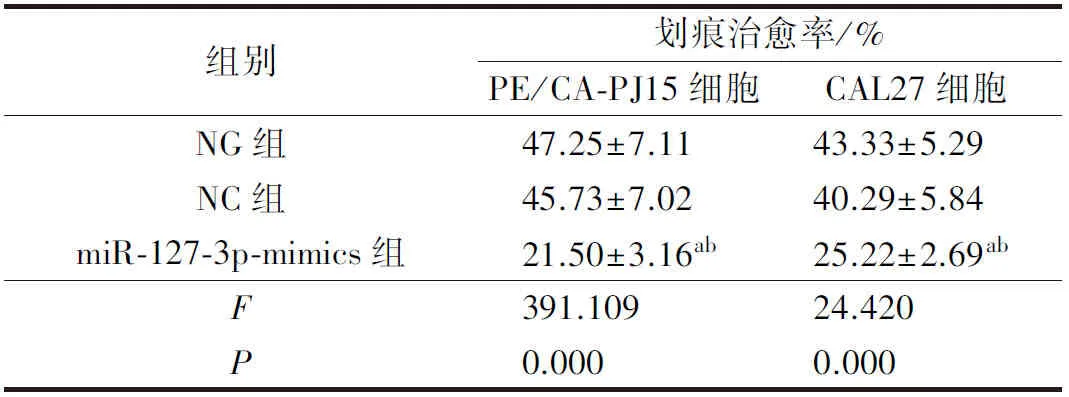
表5 各组PE/CA-PJ15、CAL27细胞迁移情况比较

图2 各组PE/CA-PJ15细胞迁移情况比较( ×200)
2.5 各组细胞侵袭情况比较
与NG组、NC组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞侵袭数显著减少(P<0.05)。详见图4和及表6。
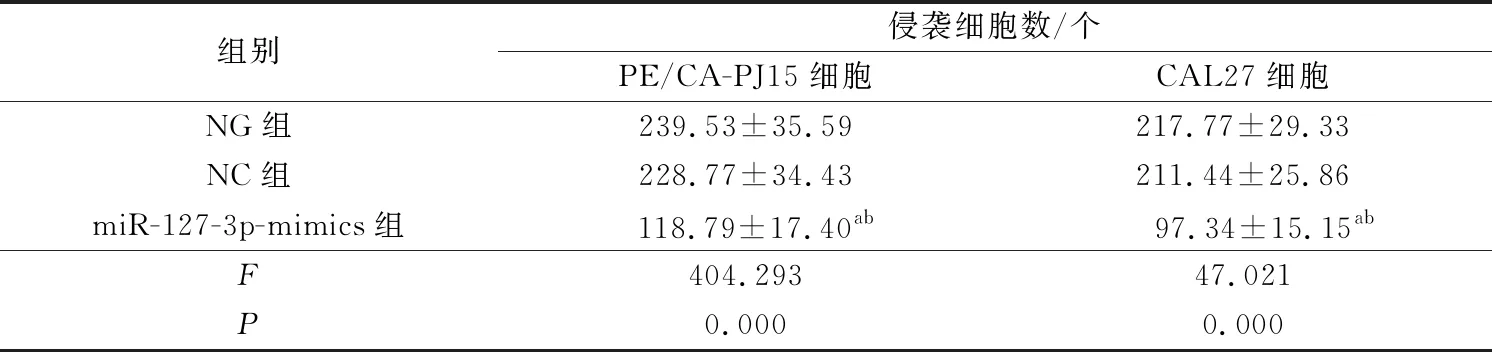
表6 各组PE/CA-PJ15、CAL27细胞侵袭情况比较
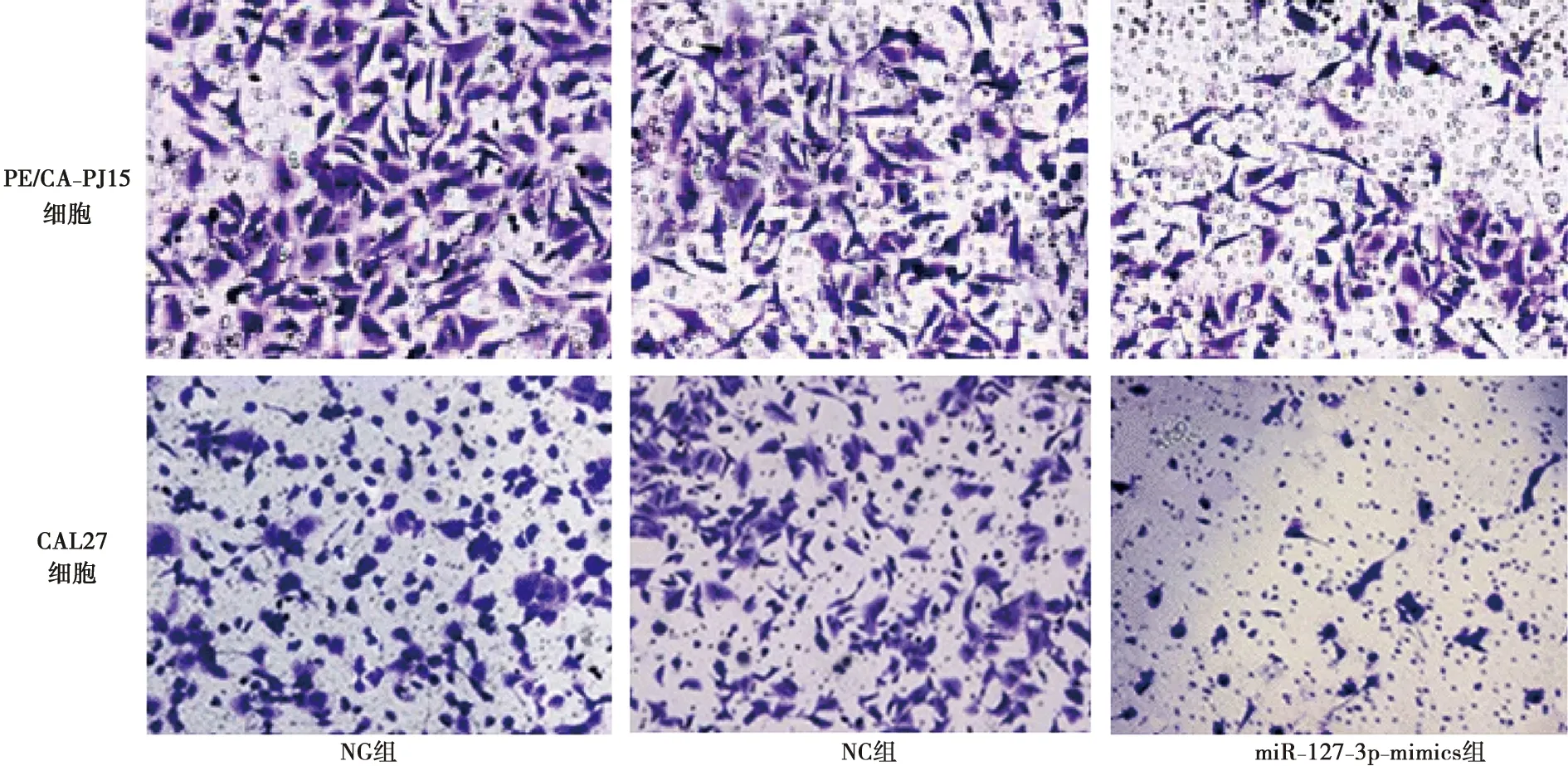
图4 各组PE/CA-PJ15、CAL27细胞侵袭情况比较( ×200)
2.6 各组细胞增殖、凋亡、迁移及侵袭相关蛋白表达比较
与NG组、NC组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞Ki-67、N-cadherin、Vimentin、Bcl-2蛋白表达显著降低(P<0.05),E-cadherin、Bax蛋白表达显著升高(P<0.05)。详见图5、表7、表8。
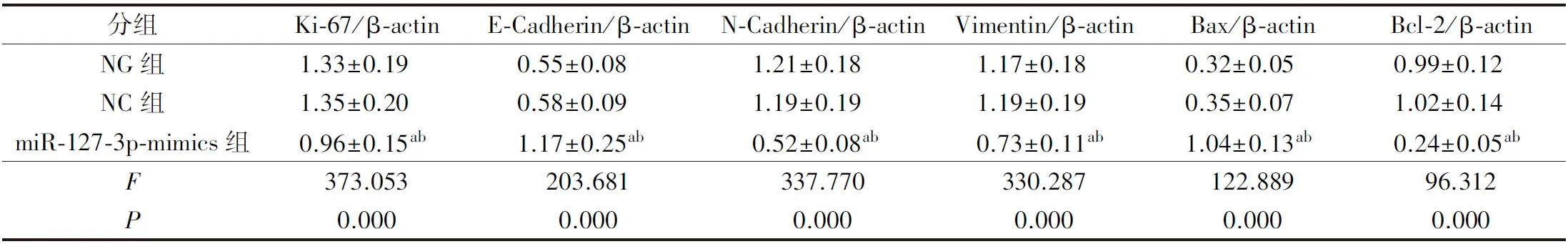
表7 各组PE/CA-PJ15细胞增殖、迁移及侵袭相关蛋白表达比较
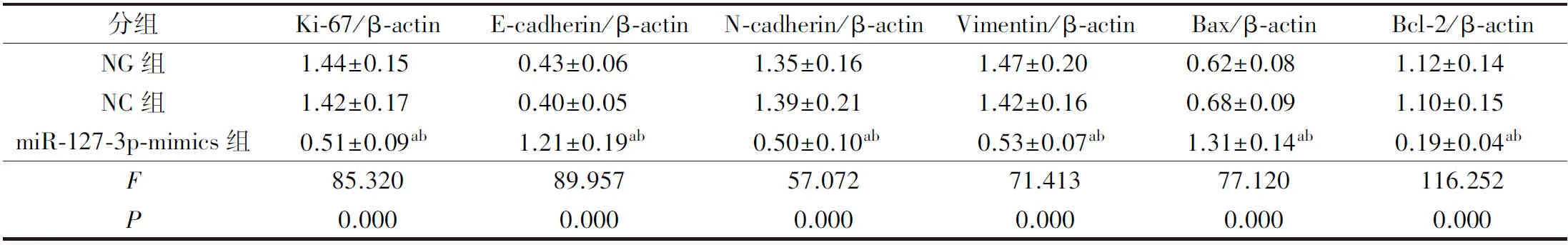
表8 各组CAL27细胞增殖、迁移及侵袭相关蛋白表达比较
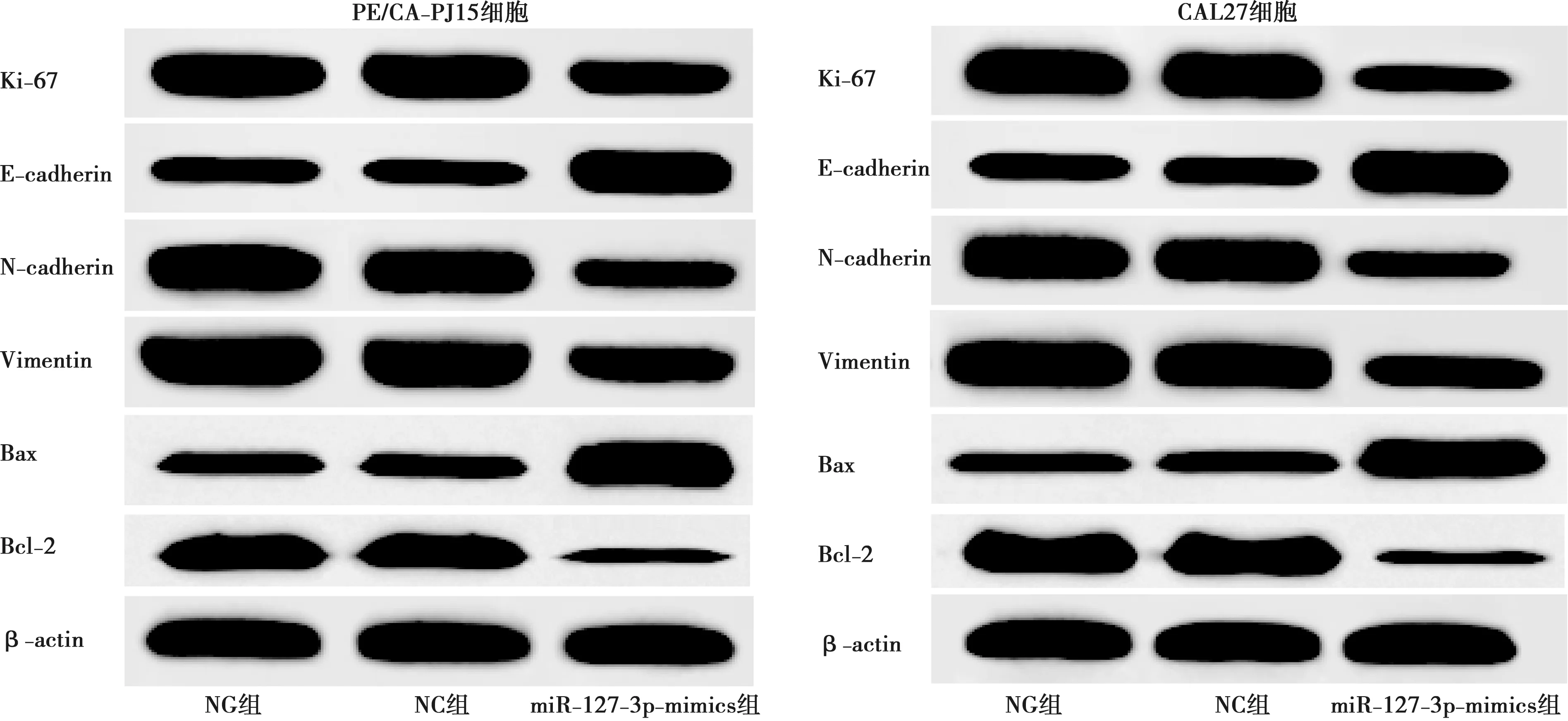
图5 各组PE/CA-PJ15、CAL27细胞增殖、迁移及侵袭相关蛋白表达比较
2.7 miR-127-3p靶向调控Zwint-1基因的关系验证
Targetscan(http://www.targetscan.org/)预测结果显示,miR-127-3p与Zwint-1基因序列存在结合位点,详见图6。荧光素酶报告基因实验结果显示,miR-127-3p-mimics-Zwint-1-WT组荧光素酶活性显著低于miR-127-3p-mimics-NC-Zwint-1-WT组((0.50±0.16)vs.(1.03±0.21))(P<0.05),详见图7。

图6 miR-127-3p与Zwint-1基因靶向关系

a:与miR-127-3p-mimics-NC-Zwint-1-WT组比较,P<0.05
2.8 各组细胞Zwint-1 mRNA及蛋白表达比较
与NG组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞Zwint-1 mRNA及蛋白表达均显著降低(P<0.05),详见图8及表9。
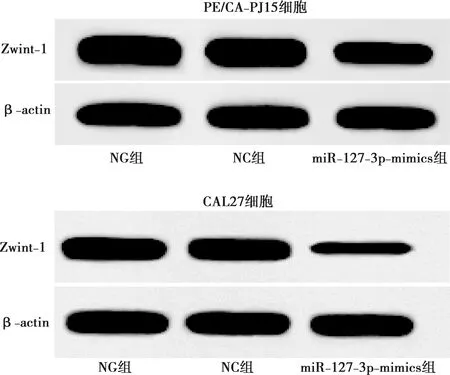
图8 各组PE/CA-PJ15、CAL27细胞Zwint-1蛋白表达情况比较
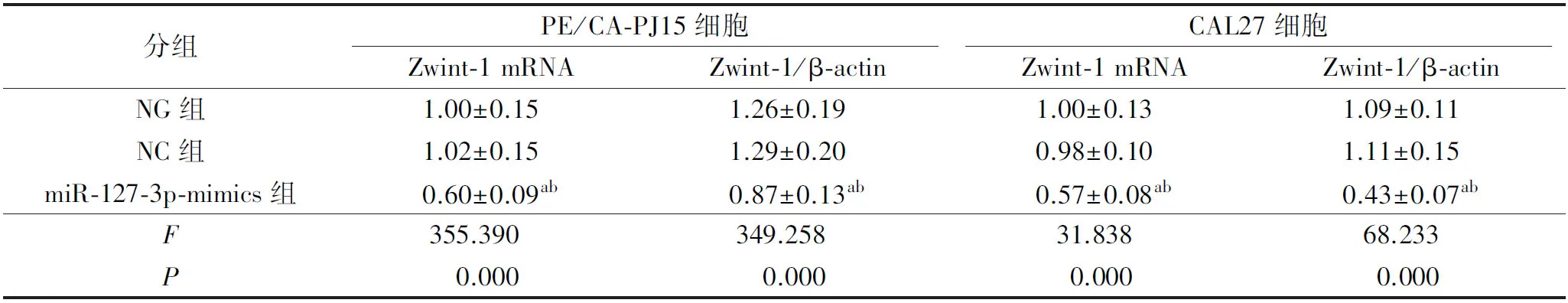
表9 各组PE/CA-PJ15、CAL27细胞Zwint-1 mRNA及蛋白表达情况比较
3 讨 论
OSCC是发病率最高的头颈部鳞状细胞恶性肿瘤,占全身恶性肿瘤的3%左右,常发生于下唇、腭、舌及扁桃体等部位,近年来其发病率呈逐年上升趋势,并趋于年轻化[10-11]。目前,有较多治疗方式如手术、放化疗及多方式综合治疗等取得了一定进步,但由于肿瘤有较高淋巴结转移倾向,使得患者预后不佳,5年生存率仍徘徊在50%左右[12-13]。因此寻找新的有效生物学治疗靶标、提高诊疗效果、改善患者预后已然是重中之重。
miR-127-3p位于染色体3q27-28 LPP基因编码的第86个碱基上,是一种单链小分子RNA,在多种肿瘤中异常表达[14]。周联明等[15]研究显示,miR-127-3p在结肠癌组织中的表达水平显著低于癌旁组织,参与肿瘤进展。已有文献报道显示上调miR-127-3p表达可显著抑制OSCC细胞增殖、侵袭及迁移[5]。细胞增殖及向邻近组织侵袭转移是肿瘤发生发展的关键,Ki-67是反映细胞增殖活性的蛋白,Bax、Bcl-2是凋亡相关蛋白,分别具有促凋亡、抑凋亡作用,E-cadherin、N-cadherin、Vimentin是细胞发生间质转化的关键蛋白,其中E-cadherin表达缺失易使细胞发生脱落或转移,N-cadherin、Vimentin能促使肿瘤血管生成,增加细胞侵袭力[16-17]。本研究发现与HOK细胞比较,OSCC各细胞系中miR-127-3p表达水平均显著降低,若仅使用一种细胞系来证明miR-127-3p在OSCC中的作用存在一定的偶然性,因此本研究后续选择OSCC各细胞系中miR-127-3p表达水平较高的CAL27细胞和miR-127-3p表达水平较低的PE/CA-PJ15细胞进行转染;而这两套细胞系是平行的OSCC细胞,二者之间没有比较的意义。本研究将PE/CA-PJ15、CAL27细胞成功转染miR-127-3p-mimics发现,与NG组、NC组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞增殖抑制率、Bax、E-cadherin蛋白表达显著升高,细胞划痕治愈率、侵袭细胞数及Ki-67、Bcl-2、N-cadherin、 Vimentin蛋白表达显著降低。与既往相关肿瘤研究结果一致,说明过表达miR-127-3p可能抑制PE/CA-PJ15、CAL27细胞增殖、侵袭及转移等。
Zwint-1是由Zwint基因进行编码,可与ZW10蛋白特异性结合共同定位于着丝粒、纺锤体及染色体微管中,对有丝分裂检查站以及染色体运动发挥调控作用,研究表明,其蛋白出现缺陷,极易导致染色体分离甚至癌变[18-19]。Jiang等[20]研究表明,过表达miR-127-3p能够靶向下调Zwint表达阻滞G1期进展进而抑制胶质母细胞瘤细胞生长。本研究经生物信息学预测网站得知miR-127-3p与Zwint-1基因序列存在结合位点,且经双荧光素酶报告实验证实,miR-127-3p-mimics-Zwint-1-WT组荧光素酶活性显著高于miR-127-3p-mimics-NC-Zwint-1-WT组。与NG组、NC组比较,miR-127-3p-mimics组PE/CA-PJ15、CAL27细胞Zwint-1 mRNA及蛋白表达均显著降低。表明过表达miR-127-3p抑制PE/CA-PJ15、CAL27细胞增殖、侵袭及迁移,可能是通过靶向下调Zwint-1基因表达实现的。
综上所述,过表达miR-127-3p可靶向下调Zwint-1基因表达,并抑制PE/CA-PJ15、CAL27细胞增殖、侵袭及迁移。但是miR-127-3p的靶基因较多,miR-127-3p是否可能通过其他靶基因影响OSCC细胞的生物学行为,尚需深入研究。另外,Zwint-1对OSCC细胞增殖、凋亡、侵袭和迁移的作用尚需进一步研究,且OSCC发生发展是多因素的复杂过程,关于其细胞增殖、侵袭及迁移等生物学恶性行为进展中,miR-127-3p对下游靶基因或相关通路的调控作用仍需深入探索。
