MTHFR 基因多态性与ALL 患儿MTX 血药浓度及严重毒副反应的相关性研究*
2022-03-11杜小换朱增燕王文娟王文静缪丽燕
杜小换,李 芳,朱增燕,周 密,王文娟,高 莉,刘 虎,王文静,缪丽燕
苏州大学附属儿童医院 1 药剂科;2 血液科,苏州 215025;3 苏州大学附属第一医院 药学部,苏州 215006
大剂量甲氨蝶呤(high-dose methotrexate,HDMTX)是儿童急性淋巴细胞白血病(acute lymphoblastic leukaemia,ALL)治疗方案中的关键药物之一。MTX 作为叶酸类似物进入细胞内,竞争性抑制二氢叶酸还原酶,阻断二氢叶酸向四氢叶酸转化,抑制肿瘤细胞的异常增殖[1]。然而,ALL 患儿在接受HD-MTX 化疗后对MTX 的敏感性和耐受性出现一定的个体差异性,所产生的毒副反应导致后续疗程中MTX 剂量的降低或治疗的中断,给ALL 患儿的预后造成不利影响。研究表明,遗传变异可能是出现个体差异的原因[2]。
亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是维持细胞内叶酸代谢和稳态的关键酶,用于催化5,10-亚甲基四氢叶酸转化为蛋白质合成和核酸甲基化所需的5-甲基四氢叶酸。当MTHFR 酶活性发生改变时,叶酸转化过程受损,细胞内叶酸代谢状态发生改变,从而影响机体对MTX 的耐受性[3]。已知MTHFR 基因编码区存在多个单核苷酸多态性(single nucleotide polymorphism,SNP),其中C677T 和A1298C 是常见的MTHFR 基因多态性位点[4]。目前有关C677T 和A1298C 基因多态性对ALL 患儿接受HD-MTX 治疗的影响及疾病发展的相关研究结果之间尚存争议[5,6]。
现通过回顾性分析MTHFR C677T 和A1298C基因多态性对ALL 患儿接受HD-MTX 化疗后的MTX 排泄延迟及血液学指标与肝脏严重毒副反应发生的影响,为临床实施MTX 个体化用药提供参考。
1 资料与方法
1.1 研究对象
收集2019 年7 月至2021 年7 月期间在苏州大学附属儿童医院收治并接受HD-MTX 化疗的77例ALL 患儿资料;疾病诊断标准参照《儿童急性淋巴细胞白血病诊疗建议(第4 次修订版)》”[7]。
1.2 方法
1.2.1 治疗方案ALL 患儿的治疗方案参照中国儿童肿瘤协作组《急性淋巴细胞白血病方案(CCCGALL-2015 或2020 方案)》,即予HD-MTX 加亚叶酸钙(calcium folinate,CF)冲击治疗。低危与中、高危患者MTX 的使用剂量分别为3 g·m-2与5 g·m-2。HDMTX 用药方式为24 h 持续静脉滴注,首先在0.5 h内给予负荷剂量(总剂量的10%),余量随后于23.5 h内持续匀速滴注。患者均接受4 次HD-MTX 化疗,常规监测每次MTX 输注开始后16、44、66 h 的血药浓度,部分患者同时监测20 h 和>68 h 的血药浓度。在MTX 输注42 h 后开始CF 解救治疗,每6 h 重复一次,共给药3 次。CF 剂量为15 mg·m-2(中、高危)或10 mg·m-2(低危)。然后根据MTX 44 h 血药浓度结果进行调整,MTX 44 h 血药浓度>1.0 μmol·L-1者增加CF 剂量并持续至MTX 低于毒性阈值。如果患者出现明显早期毒性表现,CF 解救提前到36 h。同时对患儿口腔黏膜、胃肠道及重要脏器进行保护,治疗期间监测血象、肝肾功能、水化、碱化尿液等。
1.2.2 观察指标
①MTX 44 h 血药浓度:分别于MTX 输注后不同时间点采集患儿外周静脉血2 mL 左右,应用全自动生化分析仪Viva-E(西门子公司)进行MTX 血药浓度检测。当MTX44~48 h 的血药浓度>1.0 μmol·L-1时,考虑存在MTX 排泄延迟,需要增加CF 解救剂量,因此本研究主要以MTX 输注后44 h 的血药浓度为观察指标。
②严重毒副反应指标:在HD-MTX 化疗前后及化疗过程中常规监测患儿血象、肝肾功能等。本研究主要观察血液学毒性和肝功能损害情况。血液学毒性指标含白细胞计数、中性粒细胞计数、淋巴细胞计数、血小板减少计数和血红蛋白(贫血)降低;肝损情况根据谷丙氨酸氨基转移酶、天冬氨酸氨基转移酶的指标判断。按照美国国家癌症研究所常见不良事件评价标准(CTCAE5.0 版),对记录的毒副反应指标按照严重程度进行分级。任何一项指标分级≥Ⅱ级时被认为发生与MTX 化疗相关的严重毒副反应。收集每位患者每次MTX 疗程后所发生的毒副反应情况。
1.2.3 MTHFR 基因多态性检测采用微量荧光检测仪Fluotec48E(西安天隆科技公司)和测序反应试剂盒(北京华夏时代基因科技公司)分别对MTHFR C677T 和A1298C 两个位点作基因分型定性检测。
1.3 统计学处理
以SPSS19.0 统计软件进行数据处理。采用χ2检验分析患儿临床特征(性别、年龄、体重)与MTHFR C677T 和A1298C 基因型分布的相关性;采用χ2检验比较MTHFR 各基因型与MTX 44 h 血药浓度间的相关性;采用非条件Logistic 回归模型进行多因素分析,计算比值比(OR 值)及其95%置信区间(95%CI),评估MTHFR 基因多态性与HD-MTX 化疗后各严重毒副反应发生之间的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 患者一般资料与MTHFR 基因型分布情况
本研究共纳入ALL 患儿77 例,男性43 例(占55.84%),女性34 例(占44.16%)。中位年龄5.1 岁(1.0~16.5 岁),中位体重18.0kg(9.5~43.0kg)。MTHFR C677T 基因型分布频率为CC 型19 例(占24.68%)、CT 型44 例(占57.14%)和TT 型14 例(占18.18%);MTHFR A1298C 基因型分布频率中以AA 型多见、共56 例(占72.73%),AC 型21 例(占27.27%),无纯和突变基因型(CC 型)。经χ2检验显示,患儿人群的基因型分布频率均符合Hardy-Weinberg 遗传平衡定律(P>0.05)。患儿的性别、年龄、体重等临床特征在MTHFR C677T 和A1298C 基因型分布频率上均无显著性差异(P>0.05)。
2.2 MTHFR 基因型与MTX 44 h 血药浓度的相关性
本研究中77 例ALL 患儿经过4 次HD-MTX化疗后,计308 例次MTX 44 h 血药浓度的分析结果显示,发生MTX 排泄延迟的共计65 例次(占21.10%)。经χ2检验显示,MTHFR C677T 和MTHFR A1298C 基因多态性与MTX 44 h 血药浓度之间无显著相关性(P>0.05),见表1。
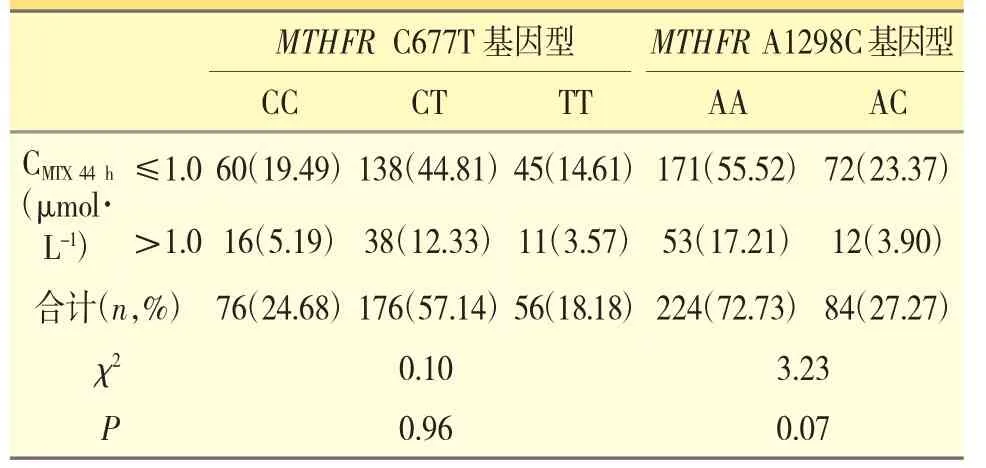
表1 MTHFR C677T 和A1298C 基因多态性与MTX 44 h 血药浓度之间的相关性[n(%)]
2.3 MTHFR 基因多态性与严重毒副反应的相关性
经统计,77 例患儿在接受每次MTX 疗程后,发生Ⅱ级以上血小板减少的仅有2 例,故未纳入分析。发生其他Ⅱ级以上严重毒副反应的共计904 例次(占58.7%),其中发生白细胞减少225 例次(占73.05%)、中性粒细胞减少194 例次(占62.99%)、淋巴细胞减少197 例次(占63.97%)、血红蛋白降低171 例次(占55.51%);发生肝功能损害为117 例次(占37.99%)。经性别、年龄以及MTX 剂量校正后的Logistic 回归模型评估结果显示,MTHFR A1298C位点杂合突变型(AC 型)发生血红蛋白减少的风险是野生型(AA 型)的2.52 倍(P=0.002),MTHFR A1298C 基因位点突变与其他各毒副反应之间差异无统计学意义(P>0.05)。MTHFR C677T 基因多态性与MTX 化疗后各严重毒副反应之间的差异均无 统计学意义(P>0.05)。见表2。

表2 MTHFR C677T 和A1298C 基因多态性与严重毒副反应之间的相关性(例次)
3 讨论
ALL 是儿童常见的恶性血液系统疾病之一,HD-MTX 在ALL 患儿化疗方案中发挥着重要的作用。由于MTX 药动学、药效学以及毒副反应在不同个体间存在显著差异性,MTX 血药浓度监测是预测MTX 化疗后的量效关系以及毒副反应的必要手段。研究表明,药物代谢酶及其靶点的基因多态性可能会影响ALL 患儿对于MTX 化疗的敏感性和耐受性,因此MTX 代谢酶基因型的检测对于提高MTX治疗效果、降低毒副反应具有重要的临床意义[8]。
体外MTHFR 酶活性的研究表明,当MTHFR C677T 基因型为CT 和TT 型时,MTHFR 酶活性分别为CC 型的60%和30%[9],酶活性的降低将可能造成机体对MTX 的代谢能力的减弱,从而发生代谢延迟。Haase R 等[1]的研究表明,MTHFR 677CC 型患者MTX 42 h 和54 h 血药浓度均值显著高于CT/TT 型患者,而MTHFR A1298C 位点突变与否与MTX 血药浓度之间未观察到差异性。在本研究中,MTX 化疗后44 h 的血药浓度与MTHFR C677T、A1298C 各基因型之间均未观察到统计学差异,这也与其他ALL患儿群体的研究结论一致[1,10]。提示MTHFR C677T、A1298C 基因多态性可能与MTX 代谢延迟之间不存在相关性。有研究显示,除了遗传变异的影响,MTX代谢延迟也可能受到患者的生理状态、药物相互作用的影响[11]。另外,需要考虑的是,当部分患者出现MTX 早期中毒表现时,临床医生将提前给予患者CF 解救,这一措施将有利于减少MTX 排泄延迟的发生。在后续的研究中,还将注意将患者是否提前接受CF 解救这一可能的影响因素纳入分析中。
有研究表明,由于MTHFR酶活性的降低,MTX化疗相关毒性发生风险可能增加[12]。如Aráoz HV等[5]在阿根廷ALL 患儿中发现,MTX 给药剂量2 g·m-2·d-1的情况下,当患儿携带至少一个677T 等位基因时,发生严重白细胞和中性粒细胞减少的风险增加,而Haase R 等[1]的研究则显示,C677T 突变基因型与严重贫血和白细胞减少负相关;当A1298C基因出现纯和突变时,严重贫血的发生率增加;但Fukushima H 等[13]的研究却有相反结论。Meta[14]分析表明,MTHFR C677T 突变型与严重血液毒性或骨髓抑制正相关;A1298C 突变型则与更低毒性事件风险相关。可见,目前关于MTHFR C677T 和A1298C 基因多态性与MTX 化疗后各毒副反应之间的相关性、国内外各项研究结果之间尚存在着争议性。在本研究中,未能观察到MTHFR C677T 基因多态性与ALL 患儿MTX 化疗后严重毒副反应之间的相关性,这与郑明霞等[15]的研究一致。当MTHFR A1298C 发生杂合突变时,血红蛋白减少的发生风险较未突变型显著增加。不同研究群体之间的种族差异、样本量的大小、患者的基础疾病及叶酸状态、MTX 用药剂量以及后续剂量的调整、方案中的其他化疗药物的影响以及毒副反应的判定标准不同等,均可能是各研究结论存在争议的原因[6]。
此外,MTX 血药浓度水平及毒性也与MTX 转运体多态性相关,如SLC19A1、SLCO1B1、ABCC2 或ABCC4 等[16]。由此可见,MTX 代谢相关的遗传变异因素对于ALL 患儿实施MTX 个体化治疗过程的作用尚有待更深入和更大样本量的研究。