信号分子活性氧和NO在土荆芥化感胁迫诱导蚕豆根边缘细胞死亡中的调控
2022-03-10何胜利谷从璟马丹炜
何胜利,谷从璟,2,马丹炜,*,张 红
1 四川师范大学生命科学学院, 成都 610101 2 云南省梁河县第一中学, 梁河 679200
“Novel Weapons”假说认为,化感作用是外来植物成功入侵的机制之一[1],扩散到新环境中的入侵植物比原产地具有更强的化感作用,从而在竞争中占有优势[2]。它们通过淋溶、挥发、根系分泌、残株腐解等方式释放到环境中的化感物质,大多数最终将进入土壤,抑制其他植物根系乃至整个植株的生长[3]。根边缘细胞 (Root border cells, RBCs) 是在植物根尖发育过程中由根冠分生组织发育而来并聚集在根冠周围的一群特殊细胞[4—5],根边缘细胞及其分泌物质构成的胞外诱捕网(Border cell extracellular traps, BETs)[6]共同在根和土壤之间构筑了一道保护屏障,抵御包括化感物质等在内的外界不良因素对根系的影响[7—9]。土荆芥(ChenopodiumambrosioidesL.)原产于热带美洲,现广泛分布于世界热带、亚热带和温带地区, 凭借其较强的化感作用[10]在我国大部分地区形成了优势种群,是一种威胁我国生态安全的外来恶性杂草[11]。土荆芥全株富含的挥发性化感物质具有较强的细胞毒性和遗传毒性[12—14],干扰受体RBCs的释放并引起RBCs活性降低[13],进而导致根尖细胞出现氧化损伤[15]以及Ca2+和Caspase依赖性的细胞凋亡[16]。活性氧(Reactive oxygen species,ROS)和NO本身具有毒性,另一方面也是植物细胞信号传递的关键组分,在逆境胁迫下,植物细胞内ROS和NO增加,其浓度在未达到毒性水平的情况下,会作为信号分子进行传递,触发一系列信号转导过程以应对逆境胁迫[17]。然而,有关土荆芥化感作用诱导RBCs死亡及其相关信号调节过程却知之甚少。本研究以西南地区土荆芥入侵地广泛种植的蚕豆(ViciafabaL.)RBCs为靶标,研究了土荆芥挥发性化感物质作用下,受体RBCs的ROS和NO等信号分子和粘胶层的变化规律,旨在探讨土荆芥挥发性化感物质诱导受体RBCs死亡的信号转导过程,明确土荆芥化感作用对受体防御功能的干扰机制,为土荆芥入侵机制的研究提供理论依据。
1 材料与方法
1.1 材料
成熟期的土荆芥全株采自四川省成都市包江桥附近(104°5′57″E,30°35′34″N);供试蚕豆品种“成胡14#”购自成都市新都区龙桥镇。试验所用标准品α-萜品烯购于上海Aladdin-阿拉丁试剂公司 (≥90%),ρ-对伞花素购自上海Adamas-beta试剂有限公司(≥99%)。
1.2 挥发油和处理母液的制备
将土荆芥材料剪成1—2 cm的小段,参照Singh等[18]的水蒸气蒸馏法提取土荆芥挥发油,经无水Na2SO4除水后4℃保存备用。该挥发油的密度为843 mg/mL,其主要成分α-萜品烯和ρ-对伞花素的含量分别为151 mg/mL和156 mg/mL。
分别用二甲基亚砜(DMSO)配制土荆芥挥发油、α-萜品烯和ρ-对伞花素的处理母液。将10 μL 挥发油用25% DMSO 稀释至100 μL 得到0.1 μL /μL的挥发油处理母液。根据10 μL挥发油中α-萜品烯和ρ-对伞花素的含量,配制二者的处理母液,其终浓度分别为0.0205 μL/μL 和0.0179 μL/μL。
1.3 材料培养及处理1.3.1 材料培养和RBCs的收集
选择大小一致,饱满无损的蚕豆种子,用0.5%的KMnO4溶液表面消毒10—15 min,使用蒸馏水清洗3—5次,置于25℃培养箱浸种24 h,催芽2—3 d,待种子露白后,将种子铺在垫有湿润双层无菌纱布的磁盘中,再盖上一层无菌纱布,置于25℃培养箱中黑暗条件下继续培养2—3 d。待根长约3 cm时(此时RBCs数量达到峰值),随机切取长约5 mm根尖5个,置于装有100 μL ddH2O的1.5 mL离心管中,旋涡振荡30 s,再用50 μL ddH2O冲洗根尖2次,移液枪吸打3—4次,使成团的RBCs分散,制得细胞悬液。
1.3.2试验处理
A组:分别取处理母液1、2、3、4 μL和5 μL (记为T1, T2, T3, T4, T5),用DMSO补足体积至5 μL,加入盛有200 μL细胞悬液的离心管,混匀。溶剂对照组为25% DMSO 5 μL +200 μL ddH2O,阴性对照组为205 μL ddH2O;所有处理均置于25 ℃培养箱中黑暗培养30 min。每处理重复3次。
B组:分别取挥发油、α-萜品烯和ρ-对伞花素处理母液5 μL,分别加入ROS清除剂抗坏血酸(AsA:0.05,0.10,0.50 mmol/L) 、硝酸还原酶抑制剂叠氮化钠(NaN3:0.05,0.25,1.25 mmol/L)、泛Caspase抑制剂(Z-VAD-FMK:0.063,0.125,1.250 mmol/L),混匀后加入装有200 μL细胞悬液的离心管,混匀。溶剂对照组为25% DMSO 5 μL +200 μL ddH2O,阴性对照组为205 μL ddH2O;所有处理均置于25 ℃培养箱中黑暗培养30 min。每处理重复3次。处理结束后,用ddH2O漂洗2次进行指标测定。
1.4 指标测定
1.4.1RBCs的原位观察
随机取2个长度约3.0 cm的根尖,分别置于载玻片上,将其中1个根尖上滴1滴ddH2O,将根冠浸入水中数秒后,滴1滴吖啶橙/溴化乙锭(AO/EB)染液;另1个根尖直接滴加AO/EB染液;二者均在室温下避光染色3 min,用Nikon ECLIPSE 55i荧光显微镜观察并拍照。
1.4.2RBCs形态观察和活性测定
RBCs的凋亡形态观察参照杨小环等[19]的方法。取细胞悬液20 μL,加入8 μL AO/EB染液,混匀后避光染色1—3 min,Nikon ECLIPSE 55i荧光显微镜观察并拍照,每个处理重复3次。统计死亡细胞的数量和细胞总数,计算RBCs死亡率:RBCs 死亡率=死亡细胞数/总细胞数×100%。
1.4.3RBCs黏胶层厚度的测定
采用杨小环等[19]的方法略有改动。取细胞悬液40 μL,加入8 μL印度墨水均匀混合后染色1 min,用Nikon ECLIPSE 55i显微镜明场观察并拍照,测量黏胶层厚度。
1.4.4RBCs中ROS原位观察和含量测定
采用活性氧检测试剂盒(碧云天,上海)测定,Nikon ECLIPSE 55i荧光显微镜观察RBCs中ROS的分布,酶标仪测定ROS相对荧光值(激发波长为488 nm,发射波长为525 nm)。
1.4.5RBCs中NO含量的测定
采用DAF-FM DA(NO荧光探针)试剂盒(碧云天,上海)测定,酶标仪测定NO相对荧光值(激发波长为495 nm,发射波长为515 nm)。
1.5 数据统计与分析
根据Williamson和Richardson[20]提出的化感作用响应指数(Allelopathy response index, RI)用于衡量化感作用强度。
式中,C为对照值,T为处理值,RI<0表示抑制效应,RI>0表示促进效应,其绝对值表示化感作用强度大小;化感作用综合效应(Synthesis effect, SE)为RI的算术平均值[21]。
用SPSS 20.0对测定指标进行单因素方差分析(One-Way ANOVA)、Tukey检验多重比较(LSD)和Pearson相关性分析,Excel 2019作图。
2 结果与分析
2.1 土荆芥挥发性物质对蚕豆RBCs形态的影响
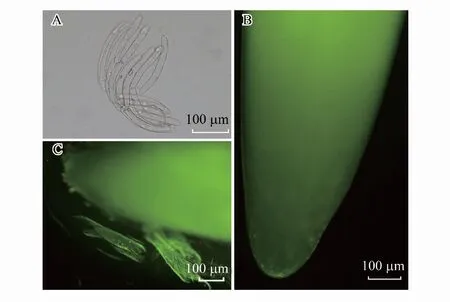
图1 蚕豆根边缘细胞的原位观察Fig.1 In situ observation of V. faba root border cells A:蚕豆根边缘细胞显微结构图;B:未浸入水中的根尖;C:浸入水中后的根尖
蚕豆RBCs呈现细长的椭圆形(图1A),明显的细胞核,细胞质清晰;从图1B可以看出,蚕豆根尖未浸入水中时,RBCs紧贴在根冠周围(图1B)。当根尖浸入水中时,RBCs就会从根冠周围释放出来,甚至呈片状状态从根冠周围脱落(图1C)。
2.2 土荆芥挥发性物质对蚕豆RBCs黏胶层厚度的影响
本研究中,溶剂对照组和阴性对照组的粘胶层厚度等各种指标均无显著差异(P>0.05),表明溶剂二甲基亚砜对RBCs影响不大,后续指标对此不再赘述。与阴性对照组相比,在土荆芥挥发性物质处理下RBCs粘胶层显著增厚,其中以挥发油处理变化最大(图2)。随着处理浓度增加,RBCs粘胶层厚度逐渐增加(P<0.05),在最大处理浓度下,土荆芥挥发油、ρ-对伞花素和α-萜品烯处理的RBCs黏胶层厚度分别为对照组的2.21倍、2.14倍和1.95倍。

图2 土荆芥挥发油、ρ-对伞花素和α-萜品烯作用下蚕豆RBCs黏胶层厚度的变化Fig.2 Changes of the Adhesive layer thickness of root border cells of V. faba exposed to the volatile oil from C. ambrosioides, p-cymene and α-terpineneA、B、C和D分别是对照、α-萜品烯、ρ-对伞花素和挥发油的T5处理组,不同小写字母表示同一处理组中不同处理之间在95%水平上的差异显著性
2.3 土荆芥挥发性物质作用下蚕豆RBCs内ROS的变化
ROS原位观察显示 (图3),阴性对照组中RBCs呈现较弱的绿色荧光, ROS主要集中在细胞核中,少部分分布在细胞壁上,而细胞质中ROS的分布比较少 (图3A)。α-萜品烯处理组中,ROS主要分布在细胞质中(图3B),而ρ-对伞花素处理组中ROS更多的集中分布在细胞质中,细胞核中分布较少 (图3C);挥发油处理组绿色荧光最强,ROS几乎分布于整个细胞中(图3D)。综上所述,土荆芥挥发油、ρ-对伞花素和α-萜品烯处理诱导蚕豆RBCs内ROS水平升高。

图3 土荆芥挥发油、ρ-对伞花素和α-萜品烯作用下蚕豆根边缘细胞内ROS的分布Fig.3 Distribution of reactive oxygen species in root border cells exposed to volatile oil from C. ambrosioides, p-cymene and α-terpinene
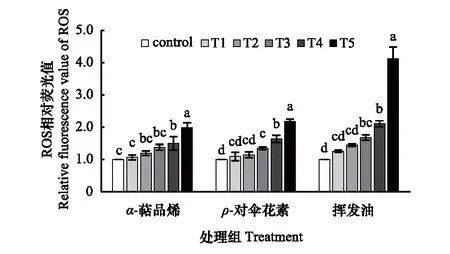
图4 土荆芥挥发油、ρ-对伞花素和α-萜品烯作用下蚕豆根边缘细胞中ROS相对含量的变化Fig.4 Changes of ROS relative content in V. faba root border cells exposed to the volatile oil from C. ambrosioides, p-cymene and α-terpineneT1、T2、T3、T4、T5分别代表α-萜品烯、ρ-对伞花素和挥发油的不同处理浓度
土荆芥挥发油、ρ-对伞花素和α-萜品烯均可诱导RBCs内ROS的积累(图4),且随着处理浓度的升高,ROS含量不断增加。T5处理组的细胞中,ROS积累量最大,挥发油、ρ-对伞花素和α-萜品烯处理组分别为对照组的4.13倍、2.19倍和2.0倍。
2.4 土荆芥挥发性物质作用下蚕豆RBCs内NO含量的变化

图5 土荆芥挥发油、ρ-对伞花素和α-萜品烯作用下蚕豆根边缘细胞NO相对含量的变化Fig.5 Changes of NO relative content in V. faba root border cells exposed to the volatile oil from C. ambrosioides, p-cymene and α-terpinene
从图5可知,随着土荆芥挥发油、ρ-对伞花素和α-萜品烯浓度的升高,蚕豆RBCs内NO的含量逐渐增大。当浓度达到最大时(T5),细胞内NO的含量达到最大值,分别为对照组的14.37倍、7.02倍和8.17倍。说明土荆芥挥发油、ρ-对伞花素和α-萜品烯胁迫处理诱导蚕豆RBCs内NO的产生。
2.5 土荆芥挥发性物质作用下蚕豆RBCs活性的变化
2.5.1土荆芥挥发性物质作用下蚕豆RBCs的形态学观察
从图6中可见,土荆芥挥发性物质对蚕豆RBCs具有致死效应。经过AO/EB染色后,对照组(图6A)RBCs呈现绿色荧光,细胞轮廓清晰,细胞核结构明显,且呈现绿色荧光亮斑;经过挥发性物质处理(图6B, 图6C, 图6D)后,RBCs染色不均匀且细胞呈现浅橘红色荧光,细胞核呈现橘红色荧光亮斑,甚至部分细胞核已经裂解,表明RBCs活性丧失,表现出凋亡特征。
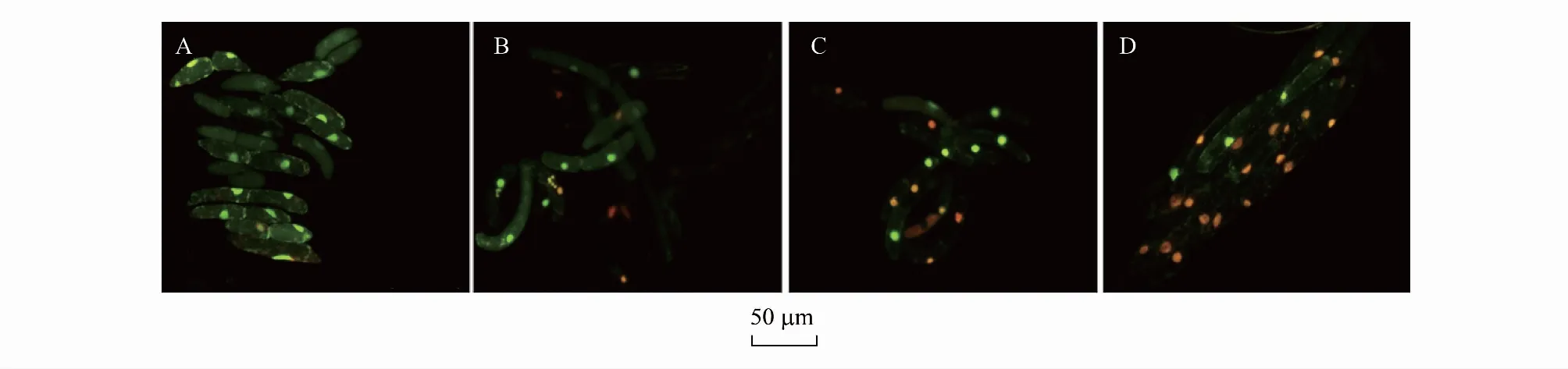
图6 土荆芥挥发油、ρ-对伞花素和α-萜品烯胁迫下蚕豆根边缘细胞荧光图像Fig.6 Root border cell fluorescence images of V. faba exposed to the volatile oil from C. ambrosioides, p-cymene and α-terpinene
2.5.2土荆芥挥发性物质作用下蚕豆RBCs的活性变化
图7显示,蚕豆RBCs对土荆芥挥发性物质十分敏感,在低浓度(T1)处理下,细胞都会大量死亡,随着处理浓度的增大RBCs而增加,呈现浓度梯度效应。最大处理浓度下(T5),挥发油、ρ-对伞花素和α-萜品烯处理组的细胞死亡率分别达到了78.29%、55.11%和47.88%。
2.5.3泛Caspase抑制剂对土荆芥挥发性物质诱导RBCs死亡的影响
在处理组中加入泛Caspase抑制剂Z-VAD-FMK后,土荆芥挥发油、α-萜品烯和ρ-对伞花素诱导的RBCs死亡明显减少(图8),且Z-VAD-FMK浓度越大,死亡率越低(P<0.05)。在Z-VAD-FMK处理浓度最大时,细胞死亡率较T5处理组显著下降,挥发油、ρ-对伞花素和α-萜品烯处理组的细胞死亡率分别降低为10.56%、9.31%和12.28%。结合荧光染色试验结果可见,土荆芥挥发性物质诱导RBCs死亡形式为Caspase依赖性的细胞凋亡。
2.5.4抗坏血酸对土荆芥挥发性物质诱导RBCs死亡的影响
施加ROS清除剂AsA处理RBCs后,土荆芥挥发油、α-萜品烯和ρ-对伞花素诱导的RBCs死亡明显减少(图9)。即使施加低浓度AsA(0.05mmol/L),细胞凋亡率也会显著降低(P<0.05),并且AsA浓度越高,这一效应更为显著,呈现浓度梯度效应。当AsA浓度最大时(0.50mmol/L),土荆芥挥发性物质对蚕豆RBCs致死的缓解效应最强,与T5处理组相比,挥发油、ρ-对伞花素和α-萜品烯处理组细胞死亡率显著下降,分别降低为12.49%、10.41%和15.19%,表明在土荆芥挥发性物质处理诱导的细胞死亡与细胞内ROS诱导的氧化损伤密切相关。
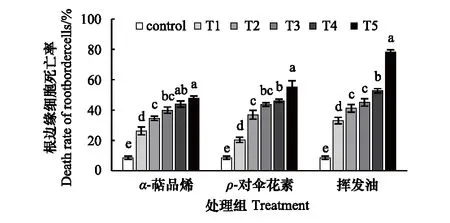
图7 土荆芥挥发油、ρ-对伞花素和α-萜品烯作用下对蚕豆根边缘细胞活性的变化Fig.7 Changes of the ctivity of V. faba root border cells exposed to the volatile oil from C. ambrosioides, p-cymene and α-terpinene

图8 Caspase抑制剂对土荆芥挥发油、ρ-对伞花素和α-萜品烯诱导蚕豆根边缘细胞死亡的缓解效应Fig.8 Alleviated effect of Caspase inhibitor on volatile oil from C. ambrosioides, p-cymene and α-terpinene induced death of root border cells of V. faba
2.5.5NaN3对土荆芥挥发性物质诱导RBCs死亡的影响
施加NO清除剂叠氮化钠(NaN3)处理RBCs后,土荆芥挥发油、α-萜品烯和ρ-对伞花素诱导的RBCs死亡明显减少(图10)。即使施加低浓度NaN3(0.05mmol/L),细胞凋亡率也会显著降低(P<0.05),并且NaN3浓度越高,这一效应更为显著,呈现浓度梯度效应。当NaN3浓度最大时(1.25mmol/L),对蚕豆RBCs的缓解效应最强,与单独施加α-萜品烯、ρ-对伞花素和土荆芥挥发油的对照相比,细胞凋亡率分别降低为22.25%、22.55%和36.54%。

图9 抗坏血酸对土荆芥挥发油、ρ-对伞花素和α-萜品烯诱导的蚕豆根边缘细胞凋亡的缓解效应Fig.9 Alleviated effect of ascorbic acid on the volatile oil from C. ambrosioides, p-cymene and α-terpinene induced death of root border cells of V. faba

图10 NaN3对土荆芥挥发油、ρ-对伞花素和α-萜品烯诱导的蚕豆根边缘细胞凋亡的缓解效应Fig.10 Alleviated effect of NaN3 on the volatile oil from C. ambrosioides, p-cymene and α-terpinene induced death of root border cells of V. faba
2.5.6土荆芥挥发性物质作用下蚕豆RBCs相关参数之间的相关性分析
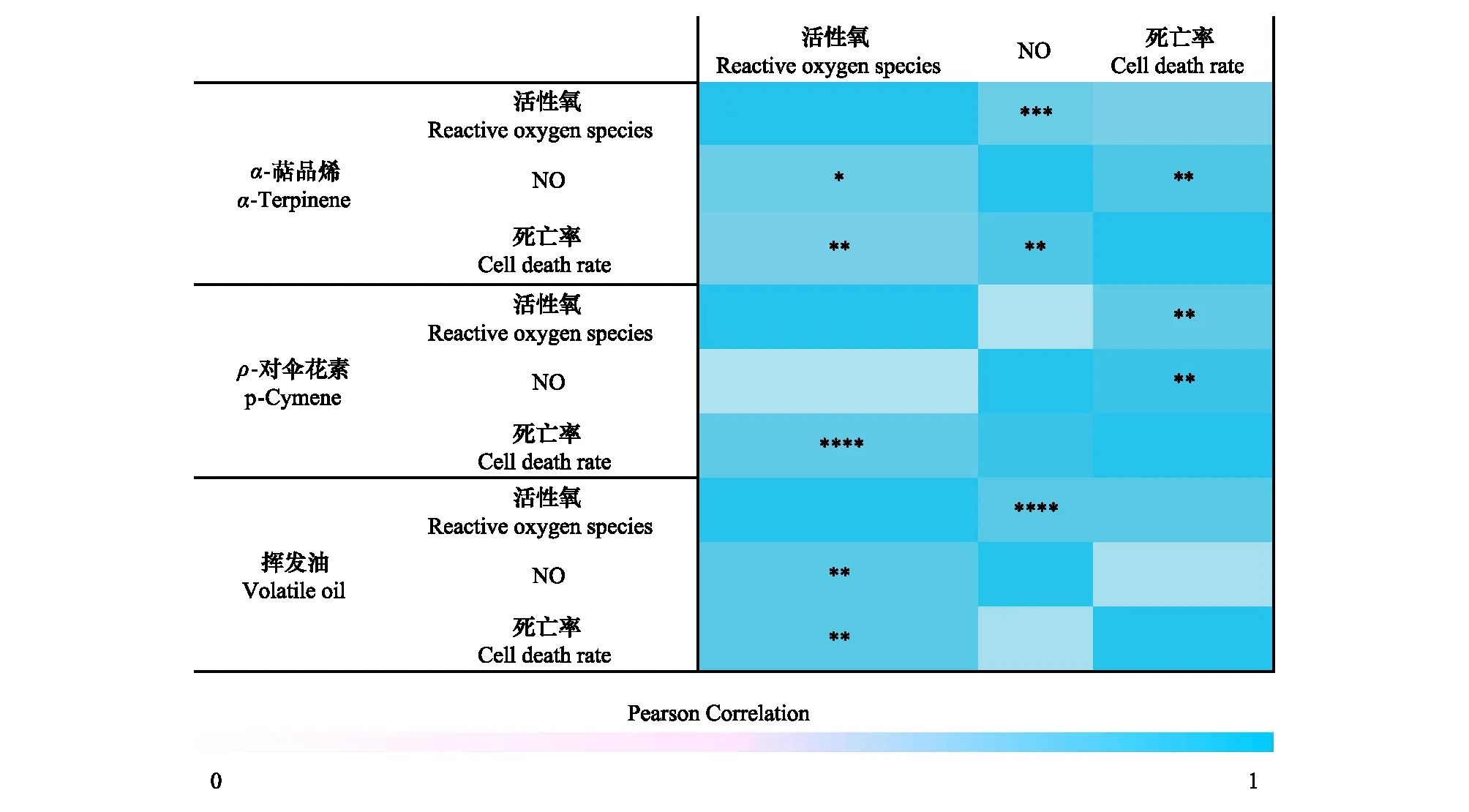
图11 土荆芥挥发油、α-萜品烯和ρ-对伞花素作用下蚕豆根边缘细胞参数相关性热图Fig.11 Heat Map of the Correlation of Parameters of V. faba root border cells under the action of C. ambrosioides volatile oil, α-terpinene and p-cymene
从图11相关性分析可知,RBCs死亡率与ROS和NO呈显著正相关;在土荆芥挥发油作用下,RBCs死亡率与ROS和NO的相关系数较大,分别达到0.685和0.95。在ρ-对伞花素和α-萜品烯作用下,RBCs死亡率与ROS和NO也存在极显著的相关性(P<0.01)。此外,在α-萜品烯和挥发油处理中,RBCs中ROS水平和NO水平的变化存在着极显著的正相关关系(P<0.01)。上述结果表明,土荆芥挥发性物质诱导RBCs死亡与ROS和NO之间有着紧密的相关关系,且ROS和NO二者协同作用的结果。
2.6 土荆芥挥发油与两个主要成分化感效应的比较
本研究综合分析不同梯度处理下的细胞死亡率、粘胶层厚度、ROS水平、NO水平4个指标化感响应指数发现,土荆芥挥发油及其两个主要成分的化感综合效应指数(SE)从大到小依次是挥发油(0.782)>α-萜品烯(0.541)>ρ-对伞花素(0.536)。由此可见,挥发油化感效应最强,挥发油的两个主要成分的化感效应比挥发油小,两个单体成分的化感效应差异不大。
3 讨论
3.1 土荆芥化感胁迫对蚕豆根边缘细胞的致死效应
RBCs及其BETs是根系与土壤之间的一道生物屏障[22]。当一种植物通过各种途径释放的化感物质进入土壤后,会刺激受体植物加速释放根边缘细胞并增加BETs厚度来抵御化感胁迫,如在肉桂酸作用下,黄瓜(CucumissativusL.)和西葫芦(FigleafGourd)RBCs数量增加,BETs厚度增大[23];在ρ-对羟基苯甲酸刺激下,葡萄RBCs通过增加数量、提高次生代谢物质和水杨酸的积累,激活了细胞的抗氧化防御系统[24];大豆[Glycinemax(Linn.) Merr.] RBCs受到土荆芥根系分泌物化感胁迫时,可能通过加速死亡并分泌一些物质螯合土荆芥根分泌物,以缓解根系分泌物对根尖组织的伤害[25];豌豆(PisumsativumL.)RBCs受到土荆芥挥发油化感胁迫时,根尖通过上调PME活性,加速释放根边缘细胞来抵御化感胁迫[26]。但这种缓解效应是有限的,随着处理时间延长、处理强度增大,RBCs活性下降而导致其保护根尖的功能减弱甚至丧失。本研究中,在土荆芥挥发油及其主要成分α-萜品烯和ρ-对伞花素作用下,蚕豆RBCs粘胶层厚度增大,随着处理强度增加RBCs活性下降,与上述研究结果和本实验室之前的研究成果[7,14]相吻合。在泛Caspase抑制剂Z-VAD-FMK作用下,土荆芥挥发油、α-萜品烯和ρ-对伞花素诱导对RBCs的致死效应明显减弱,表明蚕豆RBCs的死亡形式是Caspase依赖性的细胞凋亡,荧光染色的细胞结构特征也映证了这一论断。由此可见,化感作用通过诱导受体植物RBCs凋亡而干预了受体植物的防御功能。
土荆芥挥发油成分较为复杂,含有萜类及其氧化物、酯类、酮类、醇类和酚类等化合物[13],并且其成分也随着分布区而变化,在不同地区的土荆芥挥发油中普遍存在α-萜品烯和ρ-对伞花素这两种主要成分[27-28]。Li等[16]研究发现,土荆芥挥发油诱导的细胞凋亡效应显著高于α-萜品烯和ρ-对伞花素同时诱导的细胞凋亡效应,挥发油诱导的化感应激是其多种化学成分协同作用的结果。本研究通过分析综合化感效应发现,α-萜品烯略大于ρ-对伞花素的化感效应,但二者的化感效应小于挥发油,与上述研究结果基本一致。这一结果说明,土荆芥挥发油对RBCs作用的物质除ρ-对伞花素和α-萜品烯外,还存在着其他的化感活性物质。由此可见,土荆芥通过挥发途径对蚕豆根系生长所产生的化感作用应该是包括α-萜品烯和ρ-对伞花素在内的多种化感活性物质协同作用的结果。后续研究尚需进一步挖掘主效化感物质。
3.2 ROS和NO对土荆芥化感胁迫诱导蚕豆根边缘细胞凋亡的影响
细胞凋亡是一种在环境刺激下消除特定细胞的可控机制。当外界胁迫程度超过植物自身的承受范围时,植物就会以ROS、NO等作为信号分子,诱导植物特定部位发生程序性死亡,从而避免胁迫对其他组织的伤害,由此获得不良环境的适应[29-30]。本研究结果表明,在土荆芥挥发油及其主要成分α-萜品烯和ρ-对伞花素化感作用下,蚕豆RBCs内ROS和NO水平均大幅度升高,且呈现浓度依赖效应,尤其是挥发油处理组的涨幅最为剧烈。另一方面,RBCs却随着处理浓度的增大而死亡率逐渐增加。相关性分析表明,α-萜品烯和ρ-对伞花素2个处理组中,RBCs死亡率与ROS和NO水平呈极显著的相关性。挥发油处理组中,ROS水平与RBCs死亡率和NO水平之间均存在着呈极显著的正相关性。通过施加ROS和NO的清除剂后,土荆芥挥发性化感物质对蚕豆RBCs的致死效应得到显著缓解。综合上述结果可以说明,ROS和NO参与了土荆芥化感胁迫诱导RBCs凋亡的信号调节过程。在逆境胁迫下,ROS和NO同时产生,二者之间存在着复杂的互作关系[31]。NO可以作为一种抗氧化剂,在氧化应激过程中淬灭ROS,减少膜脂过氧化[32],而高浓度的NO能导致ROS爆发,诱导氧化损伤而引起细胞死亡[33]。ROS和NO协同作用触发了细胞快速死亡,是凋亡样细胞死亡和自噬细胞死亡的触发器[34]。本研究结果表明,在α-萜品烯处理组和挥发油处理组中,ROS水平变化和NO水平变化之间具有极显著的关联性,表明二者协同作用调控了蚕豆根边缘细胞凋亡(图12)。
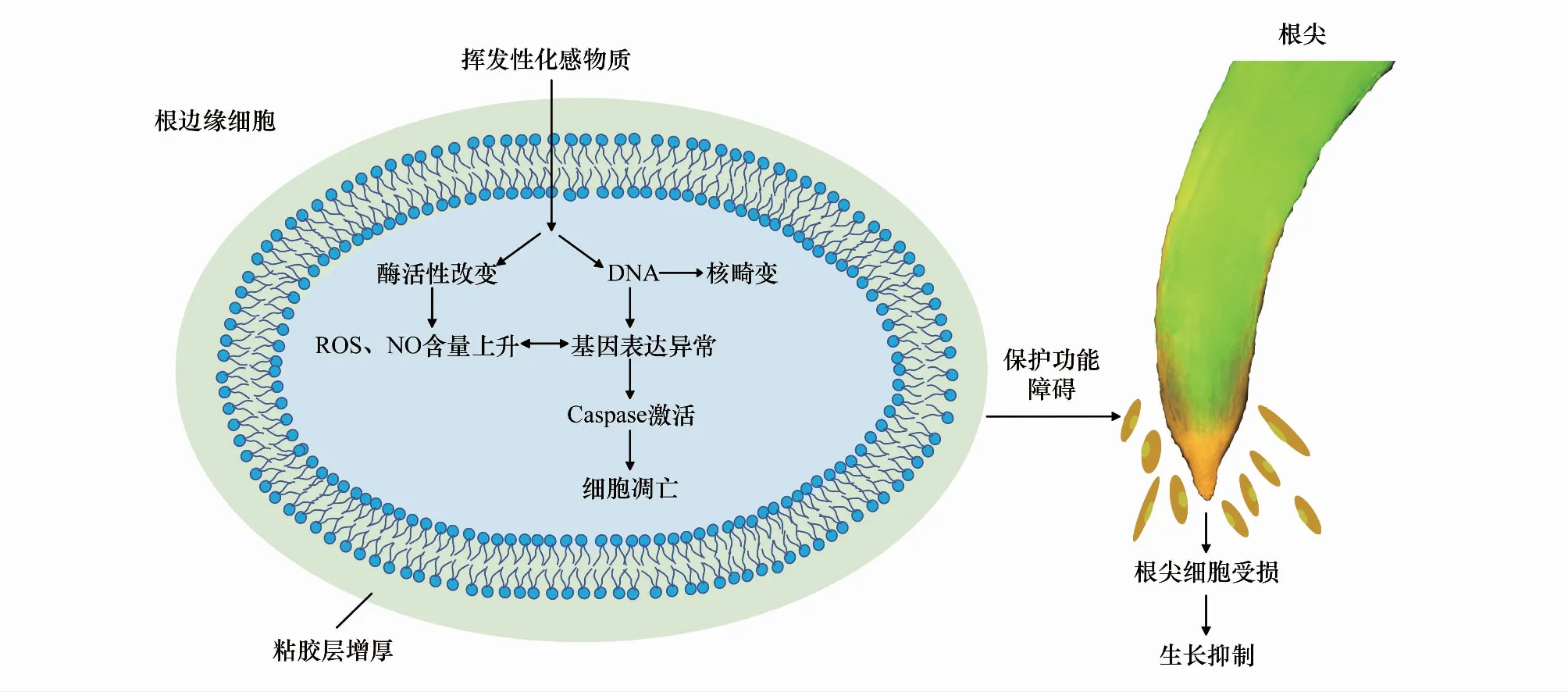
图12 土荆芥挥发性化感物质对受体植物根生长的作用机制示意图Fig.12 Schematic diagram of the mechanism of action of volatile allelochemicals from C. ambrosioides on the growth of recipient plant root
4 结论
土荆芥挥发油及其主要成分α-萜品烯、ρ-对伞花素具有较强的化感胁迫,导致蚕豆RBCs粘胶层厚度增加,细胞内ROS和NO水平升高,二者协同作用,诱导RBCs出现Caspase依赖性的细胞凋亡,导致受体植物防御功能障碍,影响植物根系发育。
