亚热带米槠天然林凋落物和根系输入变化对土壤磷组分的影响
2022-03-10贾淑娴李啸灵陆宇明林伟盛郭剑芬
张 磊,贾淑娴,李啸灵,陆宇明,林伟盛,郭剑芬,*
1 福建师范大学地理科学学院,福州 350007 2 湿润亚热带生态—地理过程教育部重点实验室,福州 350007
土壤磷素是植物在生长发育过程中必备营养元素,是仅次于氮素的第二大限制植物生长的营养元素[1]。但是,土壤磷素由于化学性质及形态等因素导致其难以被植物吸收利用。在湿润的中亚热带森林酸性土壤中,土壤高度风化消耗了储存于矿物中大量磷素,且磷素极易被土壤颗粒以及铁铝化合物等固定在土壤中[2]。因此,磷素被认为是限制中亚热带地区净初级生产力增加的关键营养元素[3]。
亚热带地区深受全球气候变暖[4]以及氮沉降[5]等因素的影响,导致净初级生产力的变化很可能又通过改变凋落物以及植物根系等物质的输入,形成正反馈效应,进而影响整个森林生态系统。其中,地上凋落物和地下植物根系是除岩石风化外土壤磷素的主要来源,二者输入变化也会导致土壤微环境的变化,进而间接影响磷素在生态系统中的循环过程以及有效性。Huang等人[6]在欧洲山毛榉林中的凋落物添加与去除实验中发现,凋落物的添加显著影响了表层土壤有效磷的含量,特别是树脂磷含量明显增加。而Sayer等人[7]在巴拿马常绿阔叶林中的凋落物输入变化试验中发现,凋落物对土壤磷素含量几乎没有影响。其中,酸性磷酸酶(Acid phosphatase, ACP)是生态系统磷循环的关键因子,它会促进土壤中有机磷的分解矿化,增加磷素有效性[8]。王文华等人[9]发现植物根系可以分泌大量酸性磷酸酶来促进有机磷矿化成无机磷,供植物吸收。Kotroczo等人[10]则认为凋落物和植物根系的输入,为土壤微生物繁殖提供了充足的碳源,从而促进酸性磷酸酶等胞外酶的产生,促进磷素的矿化。目前,磷对凋落物和根系输入的响应还存在争议,特别是土壤微生物以及相关酶活性对磷的影响程度仍不清楚。因此,需要进一步探究凋落物与植物根系对土壤磷素的影响程度。
一般将磷素分为有机磷与无机磷,但土壤中磷素形态多种多样,并且不同形态之间可以相互转化。目前土壤磷素分级方法有多种,其中Hedley连续浸提法[11]根据不同磷素的溶解度差异,对土壤磷素进行组分分级。该方法因可以较精确地反映不同磷组分动态变化过程以及可利用性而得到广泛应用[12]。其中,活性磷被认为是磷组分中最活跃的部分;中等活性磷是磷组分中转换为活性磷的关键组分之一,是植物吸收利用的后备磷源[2],且容易被铁(Fe)、铝(Al)等物质所吸附[13];稳定态磷和残留态磷是土壤中较为稳定的磷形态,通常被认为难以被植物吸收利用。由于不同形态磷含量变化明显且化学性质差异大,所以不同磷组分对凋落物和植物根系输入变化的响应程度可能有所不同。
米槠(Castanopsiscarlesii) 天然林广泛分布于我国亚热带地区的山地丘陵地带,是该区域顶级群落。它在维持土壤肥力,涵养水源以及维护地区生态平衡具有关键作用。因此,本研究在亚热带米槠天然林内设置凋落物和根系的添加与去除试验,采用Hedley连续浸提法[11],分析不同土层(0—10 cm、10—20 cm)土壤磷组分以及土壤理化性质、土壤酶活性,探究亚热带地区土壤磷的有效性及其影响因素对凋落物与植物根系输入的响应,可为我国亚热带地区森林磷循环及其影响机制研究提供参考依据。
1 材料与方法
1.1 研究区概况
研究区域位于福建省三明市格氏栲自然保护区(117°28′ E,26°11′ N),海拔305—315 m,坡度15°—20°。该保护区属中亚热带季风气候,具冬冷夏热、水热同期、湿润多雨等特点,在1956—2006年间,年平均气温为19.5℃。土壤为砂岩发育的山地红壤。本研究区的米槠天然林林龄约200年,人为干扰较少,2012年的群落调查表明,建群种为米槠(Castanopsiscarlesii),林下植被主要为华山姜(Alpiniachinensis)、硃砂根(Ardisiacrenata)、香花崖豆藤(Millettiadielsiana)、桂北木姜子(Litseasubcoriacea)和狗脊(Woodwardiajaponica)等。
1.2 DIRT样地设置
本研究于2012年6月,在米槠天然林分别随机布设3块20 m× 20 m标准样地,在每块标准样地内随机布设5个1 m× 1 m的试验小区,设计5种处理,3个重复,共设置15个试验小区,包括:对照(Control,CT)、去除根系(No root,NR)、去除地上凋落物(No litter,NL)、去除凋落物与根系(No input,NI)、添加双倍地上凋落物(Double litter, DL)。地下根系的去除处理是在试验小区周围挖1m深壕沟,并埋入0.1mm孔径的尼龙网,以隔绝地下根系的输入。凋落物的去除处理是在试验小区上方布设1mm孔径的尼龙网凋落物框,以隔绝地上凋落物的输入。每两周将NL试验小区凋落物框中凋落物均匀铺于DL试验小区内以达到去除地上凋落物与双倍地上凋落物。
1.3 土壤样品采集
2018年12月(干季),在各处理小区内利用“S”点取样法进行取样,用直径为3 cm的土钻钻取0—10 cm与10—20 cm土层土样,5根土芯置于已除菌的自封袋混合均匀后保存,迅速带回实验室去除肉眼可见的砾石和动植物残体。新鲜土样分为三部分:一部分土样用于测定土壤酶活性以及土壤微生物生物量含量,一部分土样过2 mm筛后测定土壤基本理化性质,另一部分土样室内自然风干后过0.149 mm筛,测定土壤磷组分等指标。
1.4 土壤基本理化性质测定

1.5 土壤微生物生物量碳、磷与酸性磷酸酶活性测定
微生物生物量碳(MBC)测定采用氯仿熏蒸-硫酸钾浸提法,采用TOC 分析仪(TOC-VPH/CPN,Shimadzu,日本)测定。土壤微生物生物量磷(MBP)采用氯仿熏蒸-碳酸氢钠浸提法[14],采用连续流动分析仪(Skalar San++,荷兰)测定。计算公式为:
MBC=ΔEC/KC
MBP=ΔEP/KP
式中,ΔEC为熏蒸与未熏蒸土壤有机碳含量差值;KC为 MBC 的浸提系数,为 0.45;ΔEP为熏蒸与未熏蒸土壤无机磷含量差值,KP为MBP的浸提系数为0.40。
土壤酸性磷酸酶(Acid phosphatase,ACP)参照Saiya-Cork[15]的方法培养测定。具体方法如下:取1.00 g鲜土,用125 mL 50 mmol/L的醋酸盐缓冲液(pH=5)提取,用磁力搅拌器搅拌5min混合均匀。待溶液澄清后,用移液器取200 μL溶液移于96孔微孔板。用伞形酮(MUB,Methylumbelliferyl)作为底物标示。将微孔板在黑暗环境放置培养箱内经过20℃恒温培养4 h,使用多功能酶标仪(Spectra Max M5,Molecular Devices,美国)测定荧光度。

表1 凋落物与根系输入变化下土壤基本理化性质
1.6 土壤磷组分测定
土壤磷组分测定采用1982年由Hedley[12]提出,Tiessen[16]改进的磷分级方法。称取0.5 g过0.149 mm筛的风干土于50 mL离心管中逐级提取,按照提取顺序逐级加入阴离子树脂交换膜、0.5 mol/L NaHCO3(pH=8.5)、0.1 mol/L NaOH、1 mol/L HCL。在加入浸提液之后,将含有土壤悬浮液的离心管置于恒温震荡仪中,在25℃下以250 Hz/min连续震荡960 min之后以8000 r/min离心5 min,将上清液过0.45 μm滤膜过滤后备用。最后将离心管剩余残渣放到凯式消煮管内,加入浓硫酸以及高氯酸进行高温消解,定容澄清后,取上清液待测。把0.5 mol/L NaHCO3、0.1 mol/L NaOH浸提的磷组分取部分置于高压灭菌锅内消解后,这部分为该浸提磷组分的总磷。另一部分置于离心管中,加入浓硫酸,以6000 r/min离心10 min,这部分为浸提磷组分的无机磷(Pi)部分,总磷与无机磷的差值,即为该磷组分的有机磷(Po)。
根据植物对磷素的吸收与利用的难易程度分为活性磷(Resin-P、NaHCO3-Pi、NaHCO3-Po),中等活性磷(NaOH-Pi、NaOH-Po、NaOHu.s-Pi、NaOHu.s-Po),稳定态磷(HCl-Pi),残留态磷(Residual-P)。根据磷素的生物有效性则分为有机磷(NaHCO3-Po、 NaOH-Po和NaOHs-Po)、无机磷(Resin-P、NaHCO3-Pi、NaOH-Pi、NaOHs-Pi、HCl-Pi与Residual-P)。上述浸提液使用连续流动分析仪(Skalar San++,荷兰)测定磷酸根含量,总磷为磷组分之和。
1.7 数据处理
数据经过Excel 2010软件处理,用SPSS 24.0软件进行统计分析。采用单因素(one-way ANOVA)分析、邓肯检验法(Duncan)检验不同处理之间各指标的差异显著性(P=0.05)。采用双因素(two-way ANOVA)方差分析判断土层与处理是否存在交互效应。采用独立样本 T 检验对不同土层之间的各指标进行显著性检验,显著性水平设定为P=0.05。采用 Canoco5.0 软件,将不同土层土壤总磷以及磷组分作为响应变量,土壤基本理化性质、ACP、MBC和MBP作为环境因子进行冗余分析图形绘制(RDA)。其余图形由Origin 2018软件完成。
2 结果与分析
2.1 凋落物和根系输入变化对土壤磷组分的影响
由图1可知,土壤总磷含量在0—10 cm土层中变化明显,CT总磷含量最高为188.93 mg/kg,DL处理总磷含量则仅次于CT处理,NR与NL处理总磷含量差异不显著,NI处理则含量最低(157.07 mg/kg)。在10—20 cm土层中,各处理间没有显著差异(P>0.05)。在0—10 cm土层中,CT处理总有机磷(图1)含量显著大于其他处理(P<0.05),其余处理间没有显著差异。在10—20 cm土层中有机磷呈现与0—10 cm中不同的变化趋势,DL处理有机磷含量显著大于其他处理,其余处理之间没有显著差异。不同土层之间土壤总无机磷含量差异不显著(P>0.05)。在0—10 cm土壤中,NI处理无机磷含量最低且显著低于其他处理(P<0.05);而在10—20 cm土层中,DL处理无机磷的含量最低,仅有107.13 mg/kg。
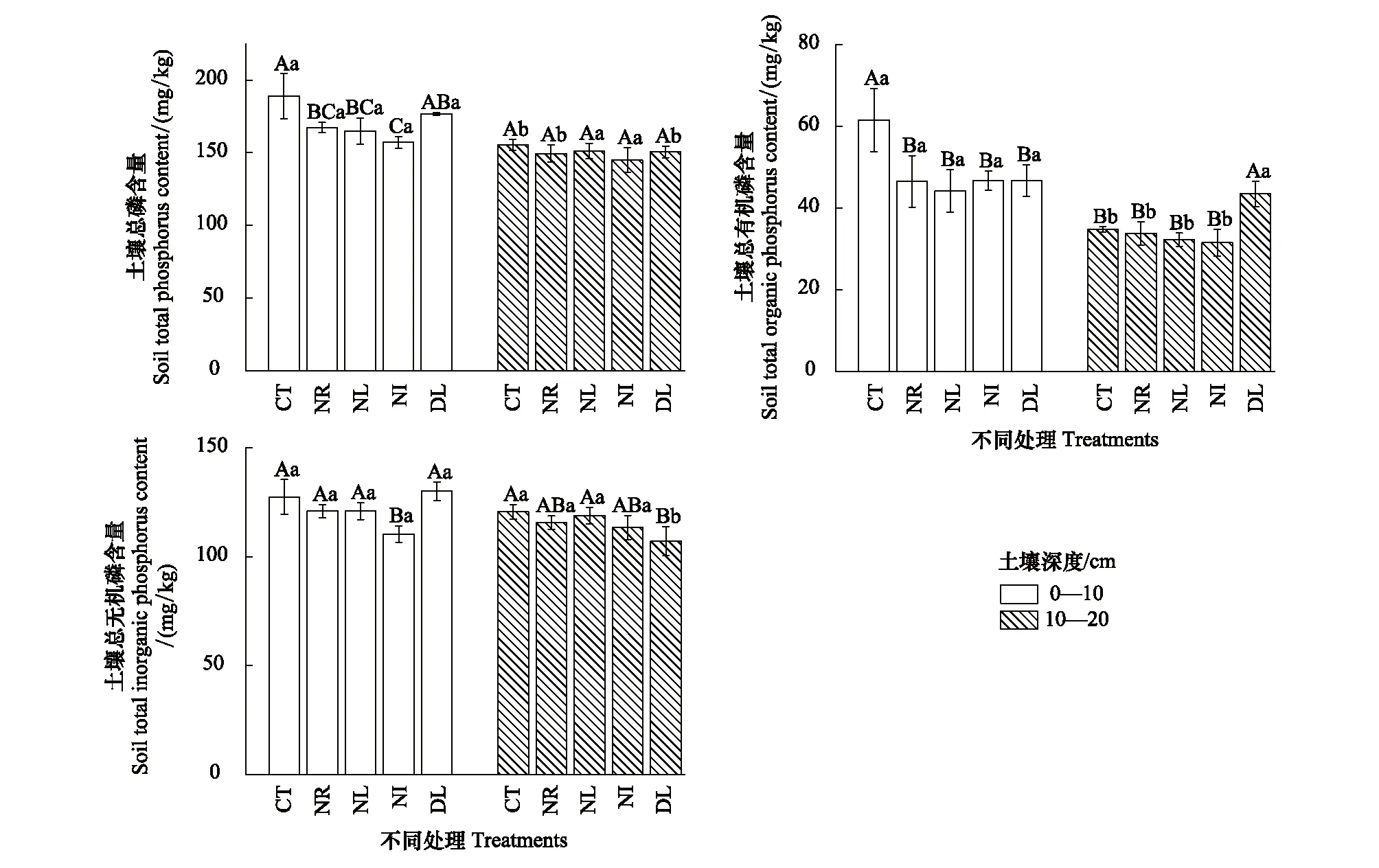
图1 凋落物与根系输入变化土壤总磷 (TP) 、总无机磷 (TPi) 、总有机磷 (TPo) 含量Fig.1 Soil total phosphorus (TP), total inorganic phosphorus (TPi) and total organic phosphorus (TPo) contents in the Detritus Input and Removal Treatments (DIRT)CT: 对照;NL: 去除凋落物;NR: 去除根系;NI: 去除凋落物与根系;DL: 添加双倍凋落物
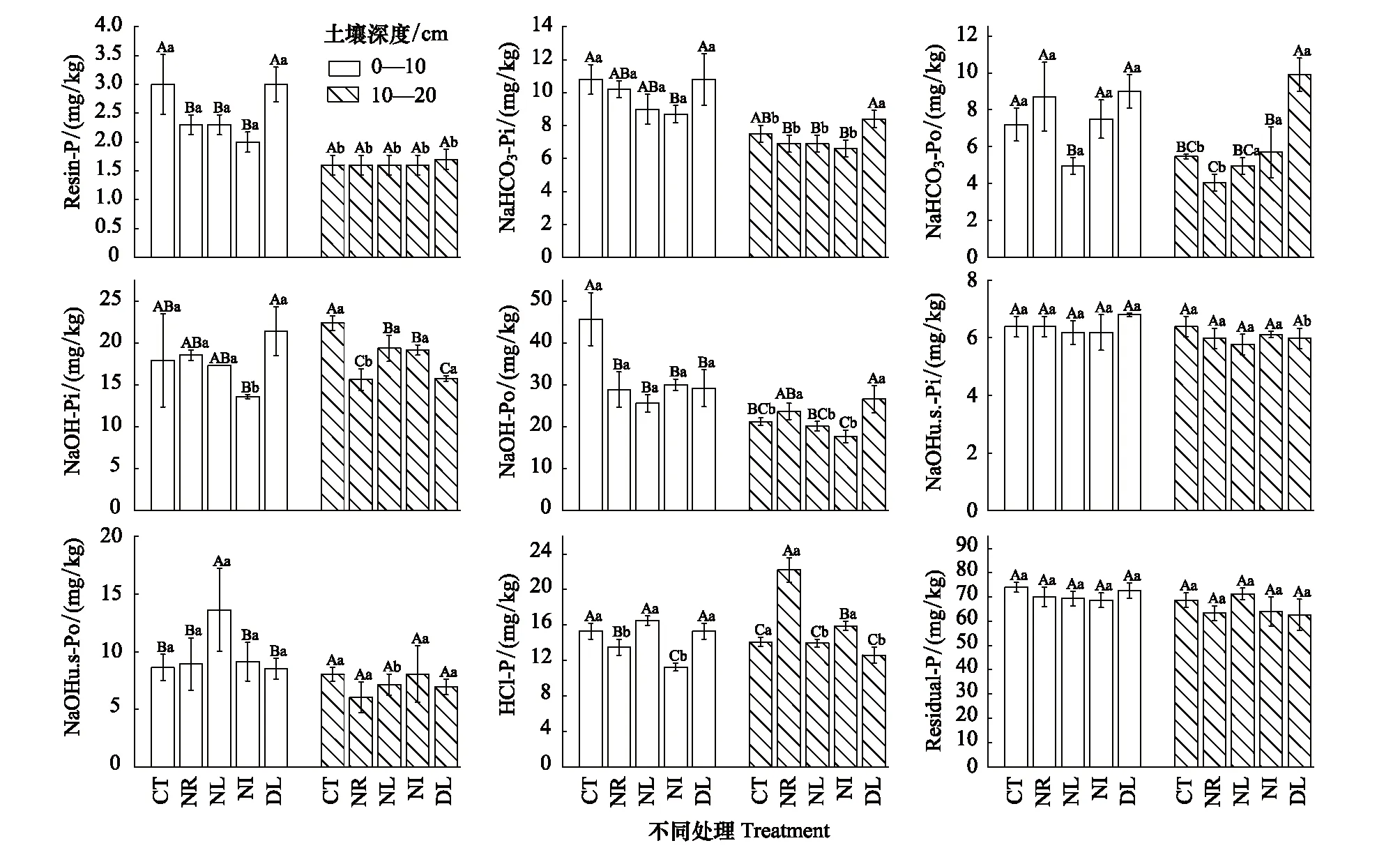
图2 凋落物与根系输入变化土壤磷组分含量Fig.2 The contents of soil phosphorus fractions in the Detritus Input and Removal Treatments (DIRT)
在0—10 cm土层,CT与DL处理的Resin-P含量显著大于其他处理;NI处理的NaHCO3-Pi、NaOH-Pi和HCl-Pi(图2)含量均显著低于其他处理;在NL处理中NaHCO3-Po含量为4.95 mg/kg,明显低于其他处理;NaOH-Po在CT处理中显著高于其他处理,含量为45.71 mg/kg;NL处理NaOHu.s-Po含量显著高于其他处理,且其余处理间无显著差异(P>0.05)。在10—20 cm土层,Resin-P含量在各处理间无明显变化;NaHCO3-Pi在CT处理中含量显著大于NR、NL、NI处理;NaHCO3-Po在DL处理中含量显著大于其他处理(P<0.05); NaOH-Pi含量在CT处理中最高,而在NR与DL处理中最低;NaOH-Po含量在NI处理中最低;NaOHu.s-Po各处理间没有明显差异;HCl-Pi含量在NR处理中最高。而在不同土层之间仅Resin-P差异显著,其余磷组分没有明显变化(图2),这可能是与Resin-P具有较强的流动性有关。
根据各磷组分不同活性分为活性磷、中等活性磷、稳定态磷以及残留态磷。由表2可知在两土层中,残留态磷含量及占比最高,中等活性磷次之,而活性磷与稳定态磷含量及占比最低。除NL处理外,各处理活性磷在不同土层间有显著差异;而各处理残留态磷在不同土层之间均没有显著差异。在0—10 cm土层中,活性磷的含量在各处理间差异显著(P<0.05),呈现DL>CT>NR>NI>NL的变化趋势;中等活性磷在NL与NI处理中含量最低,DL含量最高;稳定态磷在NI处理显著低于其他处理。在10—20 cm土层中,活性磷含量在DL处理显著大于其余处理,其余处理间差异不显著(P>0.05);中等活性磷含量在CT处理显著高于NI处理;NR处理稳定态磷则显著高于其他处理(P<0.05)。

表2 凋落物与根系输入变化下土壤磷组分含量以及所占比例
2.2 凋落物和根系输入变化对土壤微生物生物量碳磷以及酸性磷酸酶的影响
从图3看出,MBC含量在不同土层之间差异显著(P<0.05)。两土层MBC含量变化趋势基本相同。DL处理由于双倍凋落物的添加,MBC含量最高,NR处理MBC含量显著高于NL处理(P<0.05)。NI处理由于没有凋落物和植物根系输入,MBC含量最低。MBP含量在不同土层之间差异显著(P<0.05, 图3)。在0—10 cm土层,DL处理MBP含量显著高于其他处理,达到36.39 mg/kg,而NI和NL处理差异则不明显。在10—20 cm土层,MBP含量变化趋势与0—10 cm土层相似,与0—10 cm土层不同的是NR与NL处理微MBP差异显著(P<0.05);NI处理含量最低,仅为4.91 mg/kg。MBC/MBP在0—10 cm土层明显大于10—20 cm土层(图3)。在0—10 cm土层中,CT与DL处理MBC/MBP显著低于其他处理(P<0.05),而去除凋落物或根系输入情况下(NR、NL、NI)MBC/MBP值差异不显著(P>0.05)。在10—20 cm土层,NI处理MBC/MBP显著高于其他处理,而CT与NR处理显著低于其他处理,NL与DL处理间差异不显著(P>0.05)。
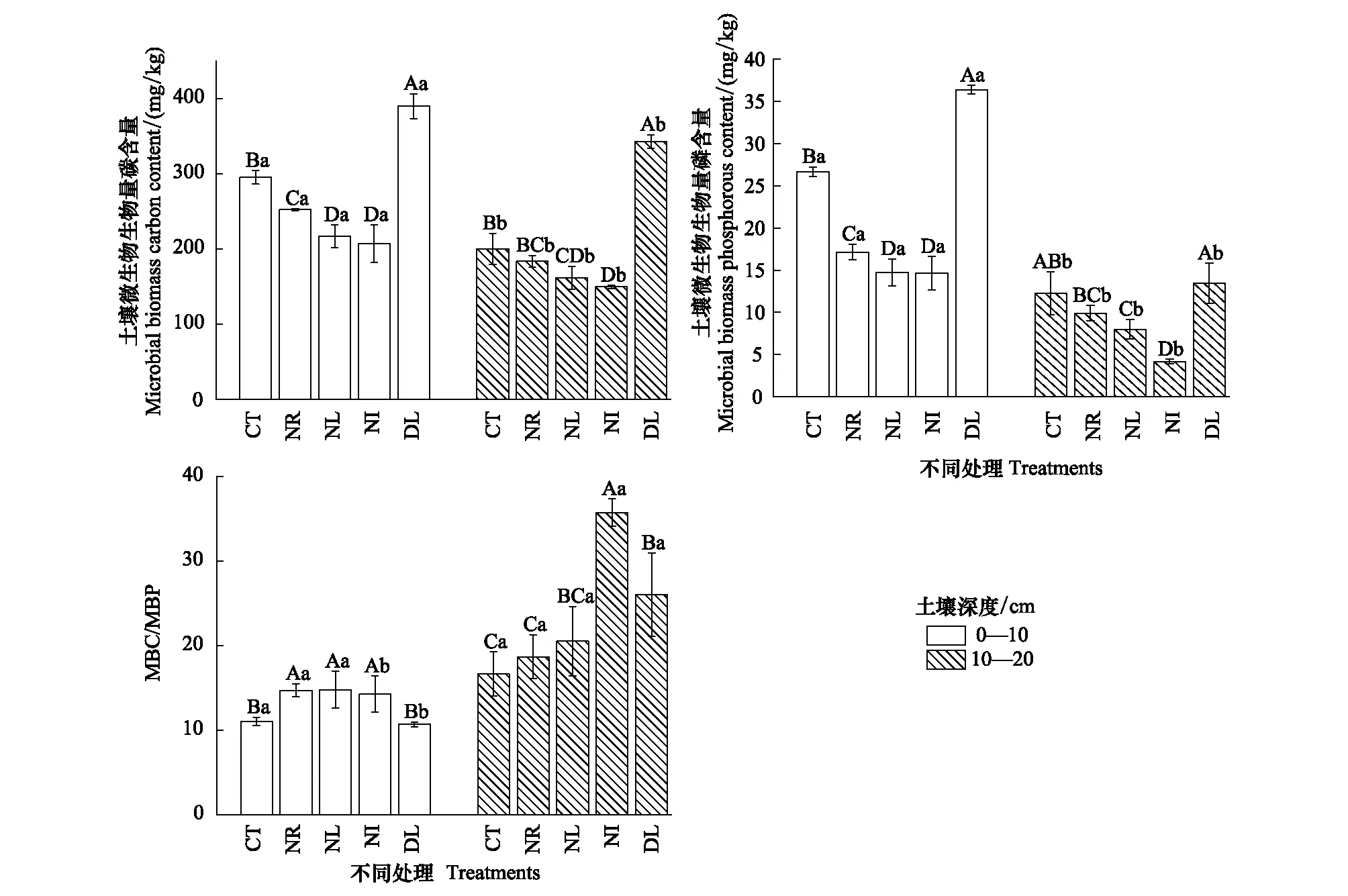
图3 凋落物与根系输入变化下土壤微生物碳磷含量及比值Fig.3 Soil microbial biomass carbon and phosphorus contents and their ratio in the Detritus Input and Removal Treatments (DIRT)MBC: 微生物生物量碳 Microbial biomass carbon; MBP: 微生物生物量磷 Microbial biomass phosphorus
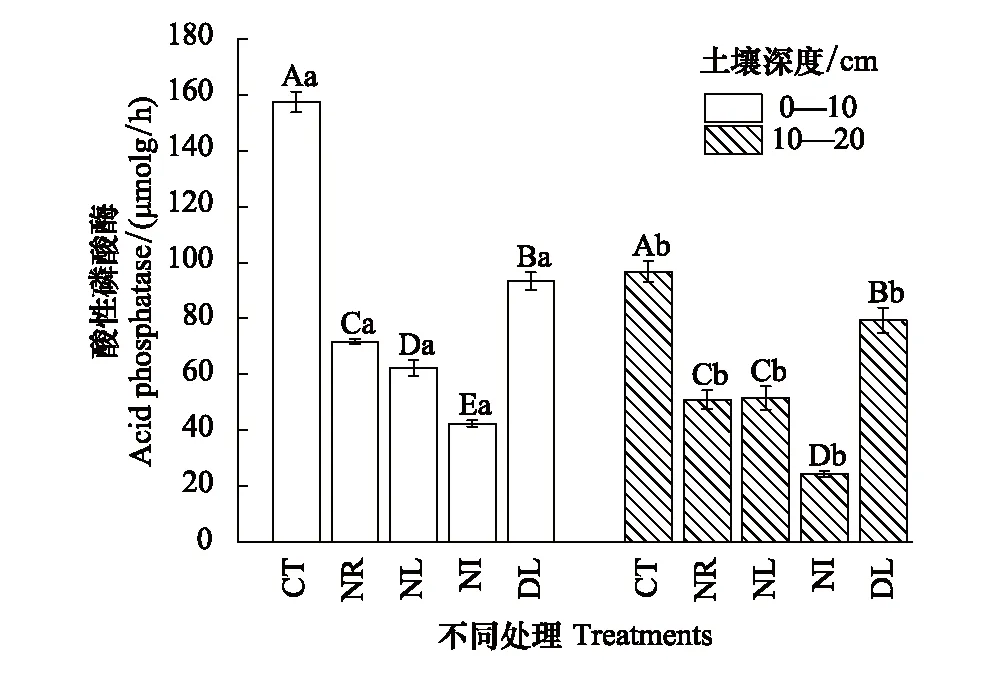
图4 凋落物与根系输入变化下土壤酸性磷酸酶活性Fig.4 Soil acid phosphatase activity in the Detritus Input and Removal Treatments (DIRT)
不同土层间ACP活性差异显著,0—10cm土层ACP活性显著大于10—20cm土层(P<0.05)。同时,同一土层中不同处理ACP活性差异显著(P<0.05),在0—10cm土层中ACP活性变化趋势为CT > DL>NR>NL>NI。而在10—20 cm土层中,NR与NL处理ACP活性没有显著差异,NI处理(24.25 μmolg/h)活性最低,DL处理活性显著高于NL处理(图4)。
2.3 凋落物和根系输入变化下土壤磷组分变化的影响因素
把 0—10 cm与10—20 cm土层土壤磷组分分别作为响应因子,土壤的基本理化性质、ACP、MBC和MBN作为环境因子,并且选择了贡献值前四的环境因子进行冗余分析(RDA)。结果显示所有处理在两土层间均有较好的聚类表现(图5)。在0—10 cm土层中(图5),ACP对磷组分的解释度最高为24.70%(P=0.008),其次为DON,解释度为20.0%(P=0.02),其中第一标准轴(RDA1)和第二标准轴(RDA2)分别解释土壤磷组分变量的29.71%和17.97%。在10—20 cm土层中(图5),TN对磷组分的解释度最高为47.0%(P=0.002),其次为SWC,解释度为9.8%(P=0.048),其中第一标准轴(RDA1)和第二标准轴(RDA2)分别解释土壤磷组分变量的49.68%和11.8%。
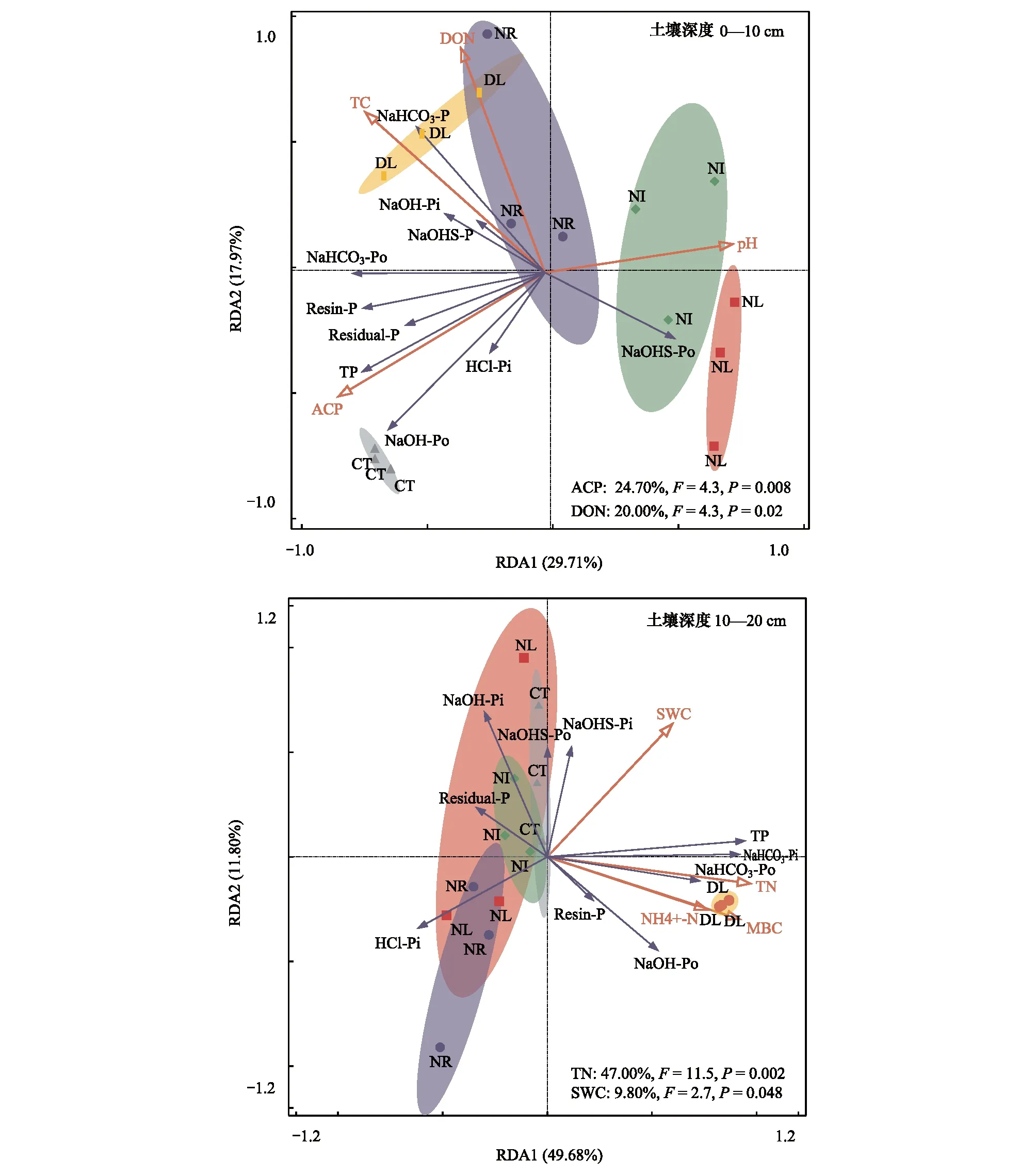
图5 凋落物与根系输入变化下土壤磷组分冗余分析Fig.5 Redundancy analysis (RDA) of soil phosphorus fractions in the Detritus Input and Removal Treatment (DIRT)SWC: 含水率Soil water content; DON: 可溶性有机氮 Dissolved organic nitrogen; TN: 总氮 Total nitrogen; ACP: 酸性磷酸酶Acid phosphatase; MBC: 微生物生物量碳 Microbial biomass carbon
3 讨论
3.1 凋落物和根系输入变化对土壤磷组分影响
土壤磷素是表征土壤肥力以及土壤质量的重要营养限制因子之一,土壤微生物生物量的多少以及比值变化是评定土壤肥力与生产力的重要依据之一[16]。本研究发现,土壤总磷含量在0—10 cm土层中,DL处理与NL处理差异不显著(P>0.05)。这与刘旭军等人[17]在华北落叶松人工林的研究结果不同。这是因为亚热带地区土壤磷素的主要来源是岩石母质的风化,且该地区土壤高度风化,使其成为磷限制区域[3],导致植物体内所含总磷相对较低。同时,叶片是凋落物的主要成分,有研究证明米槠叶片总磷含量显著低于其他亚热带典型植物叶片[18],因此凋落物输入数量的变化并不会对土壤总磷含量有明显影响。另外,在该土层中NI处理总磷含量显著低于其他处理,且MBC/MBP比值显著大于其他处理。MBC/MBP大小可以反映微生物对土壤磷素的释放与固化能力以及陆地生态系统中的磷等养分限制状况[19]。这是因为土壤微生物是以异养型为主,微生物必须利用碳维持自身生命活动与能量充足。当碳源不足时,将产生不含磷的碳水化合物,并将其贮存于自身体内形成MBC,而磷作为不必要营养元素并不会被微生物大量吸收,致使MBC含量远大于MBP含量以及磷等元素含量降低。Elser[20]也认为微生物会在碳源供应不足时,通过改变自身的物质以及群落结构来应对环境变化。同时,我们发现在0—10 cm土层,CT处理有机磷含量显著高于DL处理,而在10—20 cm土层中CT处理有机磷含量又显著低于DL处理。另外,DL处理在0—10cm的无机磷也显著低于其他处理。这主要因为凋落物中含有大量低分子有机酸等有机物[21],这类物质在凋落物分解与淋溶过程中被大量释放,通过各种化学机制促进土壤快速活化部分有机磷转化为无机磷[22],被活化的部分无机磷易被淋溶到土壤深层,部分土壤表层磷素释放后被根系吸收。
土壤磷分级对进一步了解森林生态系统磷循环过程具有重要意义。其在0—20 cm土层中DL处理活性磷含量显著大于NI处理,说明凋落物和根系输入变化对土壤活性磷的影响较大,这与Soltangheis等人[23]在农田中覆盖植物残体的研究结果相一致。另外,MBC与MBP在DL处理中显著大于其他处理,同时NI处理含量最低,这与本研究活性磷的变化趋势相一致。一方面因为土壤中凋落物以及根系输入会导致大量相关碳的输入,增加了微生物活动的能量来源,导致微生物的数量以及活性增加[24],同时,在碳充足供应时,土壤微生物会调整自身营养策略,利用更多能量来获取限制性元素,拓宽自身营养元素吸收范围,维持自身化学计量比平衡[25]。另一方面凋落物中主要以活性磷为主,凋落物的增加促进了大量活性磷归还到土壤中[26]。在0—10 cm土层中,NL处理活性磷含量显著小于NR处理。根系作为植物汲取养分的主要器官之一,在磷限制地区[3],可以调节自身根的形态以及生理变化,如细根增多以及延长等,同时也分泌部分有机酸,增强其他磷组分的活化与矿化,促进植物体对磷素的吸收,而NR处理对土壤根系的去除,使得活性磷只被土壤微生物所吸收固定。
在0—10 cm土层中,DL处理中等活性磷含量显著大于NL与NI处理。有研究证明,中等活性磷一般是吸附于土壤铁铝化合物上,且与土壤中腐殖酸关系密切[27]。凋落物中大量不稳定碳输入到土壤中,使得热带亚热带森林土壤中有效氧气的周期性消耗,从而形成阶段性厌氧环境[28]。而厌氧环境是细菌还原Fe3+的适宜场所。部分氢氧化铁(Fe(OH)3)被还原成氢氧化亚铁(Fe(OH)2),而Fe(OH)2具有更大的表面积,导致对磷的吸附能力与容量增强,特别是由NaOH提取态的磷极容易被Fe、Al等物质所吸附[29]。腐殖酸类物质会增加Fe3+的还原速度与数量,促进Fe(OH)2的生成,加强对中等活性磷的吸附[21]。
本研究中,0—10cm土层稳定态磷在NI处理显著低于NL处理,这可能是凋落物的输入导致土壤肥力以及养分状况发生改变,进而作用于土壤微生物群落,促进解磷菌对土壤有机磷的矿化。残留态磷组分所占比例最大,且不同土层与不同处理间含量差异不显著,说明凋落物和植物根系输入变化对不同土层残留态磷没有明显影响。
3.2 凋落物和根系输入变化对土壤磷组分影响因素分析
冗余分析表明,不同土层磷组分的驱动因子有所区别,在0—10 cm土层中磷组分的驱动因子为ACP与DON,在0—20cm土层中驱动因子为TN与SWC。总体而言,本研究土壤磷组分的变化主要受ACP、SWC、土壤氮素影响。
一般认为,ACP被植物或微生物分泌到土壤中,其就会将磷酸二酯键合的磷水解为可被植物根吸收的磷酸根离子,而该部分磷占土壤有机磷的20%—80%[30]。SWC是土壤的基本理化性质之一,对土壤营养元素流动以及凋落物的分解速率具有直接影响。在本研究中,SWC与土壤磷组分成正相关关系。一方面,在亚热带地区干季,水分是土壤微生物活性的重要保证之一,适宜的水分会促进微生物活性的增加,进而促进磷的释放。另一方面,水分的聚集会导致土壤厌氧环境的形成,促进Fe、Al元素对土壤磷素的吸附[27]。而土壤氮素作为土壤有机质的重要组成部分对磷组分的变化具有积极意义。在本研究中,TN、DON都与总磷、活性磷成正相关关系。曾晓敏[31]在亚热带典型植被的磷素的影响因素研究中也发现,在冬季氮素是磷组分含量变化的主要驱动因素之一。主要是因为氮素是微生物的主要构成元素之一,另外充足的氮素也会增强微生物的活性,促进微生物分泌ACP,而ACP又会对土壤磷素进行水解,促进活性磷的生成。另外,亚热带地区是氮沉降影响最严重的地区之一[32],土壤中过剩的氮素以及有机质的结合使得土壤C/N比下降,加快了有机质的分解以及养分的释放[33],促进了土壤磷组分含量的增加。Houlton[34]的Meta分析也表明随着氮有效性的增加,微生物将会生产更多可以获取磷的酶。因此,土壤氮素对磷组分的影响可能是通过微生物构成以及土壤化学计量比来实现,但具体影响过程还需进一步的研究。
4 结论
凋落物和根系输入变化显著影响了米槠天然林土壤总磷以及磷组分含量。与去除凋落物对比发现,添加双倍凋落物后表层土壤中微生物生物量碳增加了79.8%、微生物生物量磷增加了112.2%、酸性磷酸酶活性增加了50.1%,同时土壤表层活性磷提高了49.2%、中等活性磷提高了15.2%,说明凋落物输入通过增加土壤微生物生物量和增强土壤酸性磷酸酶活性来矿化有机磷,有利于改善土壤肥力状况,提高森林净初级生产力。和去除凋落物和根系处理相比,仅含有根系的处理中表层土壤活性磷降低了12.8%,却增加了31.8%的稳定态磷。虽然根系会矿化活性磷,但也吸收了大量的磷素维持自身的生长。此外,酸性磷酸酶、土壤水分以及土壤氮素是驱动该地区土壤磷组分变化的关键因子。由此可见,凋落物的添加在一定程度上缓解了该地区磷限制状况,同时促进了土壤磷素结构的改善;植物根系对保持磷素稳定性具有一定的作用,但作为植物的营养器官也吸收了大量磷素,其对土壤总磷增加的直接作用远低于凋落物。
