面包酵母自交提升耐高糖发酵力的研究
2022-03-10孙雅芳郭天芬陈莉婷覃先武
孙雅芳,王 龙,郭天芬,陈莉婷,覃先武*
(安琪酵母股份有限公司 酵母功能湖北省重点实验室,湖北 宜昌 443000)
酿酒酵母(Saccharomyces cerevisiae)因其具有容易培养、清洁安全和有高经济价值代谢产物等优点,一直以来都是生物工业发展的主力军[1-2]。其在工业上的食品应用、医学研究、环境保护以及能源开发等领域为人类做出了重要的贡献[3-5],无论是提升发酵率,提高发酵乙醇产量和质量还是提升发酵活力和保存率等,都是该领域的研究热点。目前,提升酵母特性的遗传操作策略很多,主要包括随机诱变、进化工程、代谢工程和杂交育种等[6-9]。而杂交育种无论在方向性还是自觉性方面,比诱变和进化都前进了一大步。不仅可消除某一菌株在经过长期诱变后所出现的产量上升缓慢的现象,而且因模拟自然选择的过程,克服了生物基因改造在商业应用中的难题[10]。
在杂交育种中,近交与人工选择相结合一直是提高优势的重要手段之一[11-12],近交的优势在于促使等位基因纯合、保持优良个体血统、提高群体同质性等[13],我国的水稻、小麦、棉花等作物采取这样的连续选择,已先后育成许多新的优良品种[14-16]。但同时近交衰退现象也会有所体现,因此把握应用时机、防止近交衰退发生能更充分的发挥近交的有利功能。
对于酿酒酵母而言,从四分体分析入手,能更清楚的了解控制目标性状等位基因的分离情况[17],有目的的杂交能更加有效的获取提升性状的菌株,提高杂交效率。
面包酵母的耐高糖发酵力是一种在工业中受到高度关注的特性,其机理较为复杂,涉及蔗糖酶活力[18]、耐高渗能力[19]和糖酵解的多方面因素。本实验从四分体分析出发,以利用工业面包酵母BH3自交来提升其耐高糖发酵力为例验证方法,探讨复杂基因控制性状下工业酵母菌开发的研究思路。
1 材料与方法
1.1 材料与试剂
工业耐高糖面包酵母BH3:保藏于安琪酵母菌种研究室。
面粉(小麦粉):河北五得利面粉集团有限公司;10%蜗牛酶(酶活0.5 U/μL):华东医药公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Mastermix(0.1 U/μL):天根生化科技有限公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L。
YPD固体培养基:YPD液体培养基加入2%琼脂。
菌体收集摇瓶培养基:酵母膏20 g/L,蔗糖100 g/L,磷酸氢二钾1 g/L,七水硫酸镁1 g/L,pH4.7~4.9,每瓶培养基300 mL。
孢前培养基:酵母膏8 g/L,蛋白胨3 g/L,葡萄糖100 g/L,琼脂20 g/L。
产孢培养基:醋酸钾10 g/L,酵母膏1 g/L,葡萄糖0.5 g/L,琼脂20 g/L。
以上培养基均在121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
ZWYR-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;LXJ-IIB低速大容量多管离心机:上海安亭科学仪器厂;SPX-II300生化培养箱:上海跃进医疗器械有限公司;Risograph酵母活性产气测定仪:美国National Mfg公司;MSM400酵母显微操作工作站:英国Singer instrument公司;DYY6C凝胶电泳系统、GelDocXR+凝胶成像系统:美国Bio-Rad公司。
1.3 方法
1.3.1 酵母产孢
将亲本菌株BH3接种于孢前培养基1 d,用来储备营养。然后将长出的菌体刮下转移到产孢培养基于22 ℃恒温培养5 d左右,待其产生较多的四分体。
1.3.2 有性孢子的分离
于产孢培养基取适量菌体置于100 μL的无菌水中,加入20 μL的10%蜗牛酶(终含量2%),37 ℃水浴15 min后立即放置冰上,终止酶解。将菌液适量稀释后滴加到YPD固体培养基,置于显微操作仪上,用微针解剖子囊,将同一子囊的4个孢子在YPD固体培养基上排成一列并做好标记。
1.3.3 孢子接合型鉴定
使用聚合酶链式反应(PCR)检测孢子MAT基因型[20]。挑取其单菌落作为脱氧核糖核酸(deoxyribonucleic acid,DNA)模板,根据GenBank中酿酒酵母性别决定的MAT-a和MAT-α基因座及附近基因序列设计3条引物:MAT-F:5'-AGTCACATCAAGATCGTTTATGG-3'是位于MAT基因座右侧的序列;MAT-α:5'-GCACGGAATATGGGACTACTTCG-3'是位于MAT-α和HML-α之间的序列;MAT-a:5'-ACTCCACTTCAAGTAAGAGTTTG-3'是位于MAT-a和HMR-a之间的序列。
PCR扩增体系:25 μL PCR体系中加入适量细胞,三种引物各1 μL,2×TaqPCR MasterMix预混液12.5 μL和双蒸水(ddH2O)7.5 μL进行扩增。PCR扩增条件:95 ℃预变性10 min;95 ℃变性45 s,55 ℃复性60 s,72 ℃延伸70 s,32个循环;最后72 ℃延伸10 min。将PCR扩增产物进行琼脂糖凝胶电泳进行鉴定。
1.3.4 单倍体交配
a型和α型的单倍体经过YPD培养基培养后,各取5 mL加入50 mL YPD培养基中,在培养箱中30 ℃静置培养,期间观察哑铃型结合子的形成和细胞的凝集状况,静置4~6 h后用无菌水稀释混合菌液至适宜倍数,滴加在YPD固体培养基,使用显微操作仪挑取“哑铃”状长出了接合管的酵母细胞,作为疑似杂合子,待其于30 ℃在YPD固体培养基上长出菌落,用步骤1.3.3所述方法进行鉴定。
1.3.5 酵母的培养与生物量测定
将单倍体及杂合子接种于5 mL YPD培养基中,在30 ℃条件下180 r/min恒温振荡培养16 h,然后以1%的接种量接种于菌体收集摇瓶培养基,在30 ℃条件下180 r/min恒温振荡培养20 h。5 000 r/min离心5 min收集酵母,计算其生物量,以湿质量计。
1.3.6 耐高糖发酵力性能的测定
对单倍体及杂合子进行耐高糖发酵力评估,选择面团实验对酵母进行发酵力测定,面团实验方法如下:称取280.0 g小麦粉倒入和面机,另称取1%氯化钠和16%白砂糖至一干净三角瓶,加入120 mL蒸馏水溶解。按面粉1%干酵母的使用量称取收集的酵母,与上述糖盐水混匀后倒入和面机中,混合搅拌5 min,面团温度控制在30 ℃立即放入Risogragh产气仪测定其120 min的产气总量(mL,30 ℃、760 mm Hg条件下)。
2 结果与分析
2.1 单倍体菌株制备
由图1A可知,亲本菌株BH3在产孢培养基上培养5 d后,产生许多孢子,其中产生了4个孢子的菌体被称为四分体。由图1B可知,用蜗牛酶对四分体进行破壁处理,使用显微操作仪挑出孢子,有序排列,培养24 h,单倍体即可长成菌落。由图1C可知,1号单倍体在404 bp处有条带,为MAT-α型,2号、3号单倍体在544 bp处有条带,为MAT-a型,经过鉴定后,确认获得51株MAT-a型单倍体和51株MAT-α型单倍体共102株单倍体。

图1 单倍体菌株制备Fig.1 Preparation of haploid strain
2.2 四分体特性分析
在得到孢子后,首先对孢子群体进行分析,一般可以采取随机孢子分析法[21]或者四分体分析法。本研究在显微操作仪下进行四分体分析,即在得到完整的子囊孢子分离株后,进行接合型检测和性状分析。一组四分体包含了亲本所有基因,对完整四分体中单倍体进行分析,能判断基因的连锁和性状的显隐性分离,还有助于实现目标性状的基因定位。
2.2.1 单倍体生物量分析
对所有单倍体摇瓶富集,统计其生物量,其中有21组完整的四分体孢子,共计84个单倍体,将生物量高于生物量平均值(50.61 g/L)的单倍体称为较高生物量单倍体,记为(+);低于这个数值的单倍体称为较低生物量单倍体,记为(-)。单倍体生物量与生物量平均值的绝对偏差见表1,(+)标记数值为正值,(-)标记数值为负值。

表1 单倍体生物量分析Table 1 Analysis of haploid biomass
由表2可知,较高生物量单倍体40个,占比47.6%;较低生物量单倍体44个,占比52.4%。在大多数四分体组中,生物量性状(+)与(-)分离呈现2∶2的比例,因此如果子囊数2∶2的比例居多,可以初步判断是一对等位基因的分离造成的。虽不能证明在此酵母中生物量仅有一对等位基因控制,但可以看出控制生物量的主基因在四分体中的分离情况,并且这个基因在BH3酵母中是杂合的。
酵母接合型是由第III条染色体MAT基因座上的等位基因MATa和MATα所控制的,在菌株BH3的四分体中,a型与α型的比例是2∶2正常分离的,与生物量性状结合来看,a(+)∶a(-)∶α(+)∶α(-)=33∶9∶7∶35,因此对其分配进行卡方检验[22],χ2用于衡量实际值与理论值的差异程度,结果见表2。

表2 卡方检验基因连锁Table 2 Gene linkage of Chi-square test
由表3可知,这两对基因各自的分离都符合1∶1分离比率,但从总χ2来看,这两对基因的传递规律不符合独立遗传,说明他们之间存在连锁关系。可以判断控制生物量性状的主效基因与MAT基因是连锁的,其中MATa与控制较高生物量的主效基因连锁,MATα与控制较低生物量的主效基因连锁,这两对基因的交换值也就是其重组频率为重组单倍体占总单倍体比例即(9+7)/84=19%。全部单倍体生物量分布见图2。
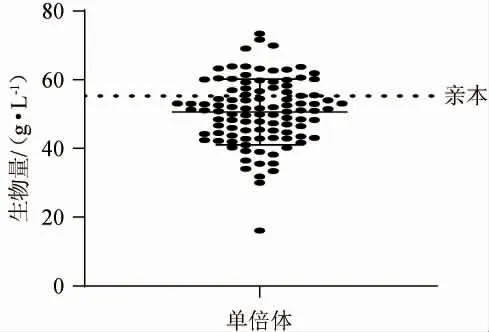
图2 单倍体生物量Fig.2 Biomass of haploid
由图2可知,亲本生物量水平为(55.27±0.11)g/L,略高于单倍体生物量均值(50.61 g/L),单倍体的生物量分离体现出控制生物量性状的等位基因的不完全显性。
2.2.2 单倍体耐高糖发酵力分析
对102株单倍体进行面团的发酵力测试,先对21组四分体进行分析。用与生物量同样的分析方法,耐高糖发酵力比均值(610.13 mL)高的单倍体记为(+),耐高糖发酵力比均值低的单倍体记为(-)。单倍体耐高糖发酵力与其均值的绝对偏差如表3所示,(+)标记数值为正值,(-)标记数值为负值,同表1。

表3 单倍体耐高糖发酵力分析Table 3 Analysis of fermentation activity of haploid with high sugar tolerance
由表3可知,统计得到较高发酵力单倍体43个,占比51.2%;较低生物量单倍体41个,占比48.8%。控制其耐高糖发酵力的主效基因分离情况与生物量的分离类似,四分体内大多也呈现了“两高两低”这种2∶2的分离比例。与a/α这对等位基因结合来看,a(+)∶a(-)∶α(+)∶α(-)=26∶16∶17∶25,同样进行卡方检验,结果如表4所示。

表4 卡方检验基因连锁结果Table 4 Gene linkage results of Chi-square test
由表4可知,控制耐高糖发酵力的主要基因也是按照1∶1正常分离的,从总χ2来看这对基因和MATa/α之间的连锁可能性较低。单倍体的耐高糖发酵力分布如图3所示。
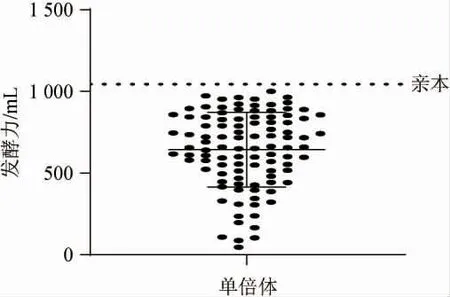
图3 单倍体耐高糖发酵力Fig.3 Fermentation activity of haploid with high sugar tolerance
由图3可知,与亲本菌株比较,这些单倍体的耐高糖发酵力都低于亲本菌株,主要原因可能是由于单倍体与双倍体本身区别。有人猜测,通过将能量汇集到基因的复制和蛋白质合成,而不是细胞分裂和膜的合成,多倍体增加了组织的新陈代谢能力[23],相反由于单倍体酵母菌株较低的热稳定性,对酸、碱、乙醇和其他抑制剂的耐受能力都很低[24-25]。虽然所有的单倍体发酵活力都低于亲本,但将有优势的单倍体进行交配是有意义的。
此菌株的单倍体后代在生物量和耐高糖发酵力上出现了性状分离,在四分体中优劣性状大多呈现了2∶2的比例分配,推测这些性状分离是由于等位基因的分离,说明BH3这株菌在这两对性状上的主效QTL基因是杂合的。
2.3 选择性交配提升耐高糖发酵力
从102株中优选耐高糖发酵力良好的单倍体18株,以提升耐高糖发酵力为目的进行配对交配,所选单倍体见表5。

表5 交配用单倍体选择情况Table 5 Selection of haploid for mating
由表5可知,优选耐高糖发酵力良好的单倍体18株中11株为a型,7株为α型;18株单倍体的生物量为33.43~73.39 g/L,发酵力为728.17~1 000.92 mL。虽然所有的单倍体发酵活力都低于亲本,但通过大批量的单倍体筛选,优选的单倍体体现了足够的优势用于交配。
将这些不同配型的单倍体菌液按照不同的组合混合在液体YPD培养基中交配后,用显微操作仪挑取如图4A所示形态的细胞,待其长出菌落后,利用菌落PCR验证配型,产生如图4B所示双条带,即成功得到了杂合子。

图4 杂合子的挑取与鉴定Fig.4 Selection and identification of heterozygotes
利用以上单倍体共构建27个交配组合,将得到的杂合子用同样的方式测试耐高糖发酵力,结果见表6。

表6 杂合子的耐高糖发酵力测定结果Table 6 Determination results of fermentation activity with high sugar tolerance of heterozygous
由表6可知,有11个交配组合的新菌株的耐高糖发酵力达到亲本水平及以上,最高能超过亲本菌株16.73%,说明菌株BH3在纯系育种上还有一定的上升空间。但是从其他自交组合二倍体的耐高糖发酵力可以看出,与亲本相比有所减弱,这可能是近交衰退现象。
3 结论
酵母的杂交是非常经典的遗传育种方式,但现有研究中对酵母的杂交选育还有优化空间。本研究着重于交配前的酵母四分体分析,分析基因连锁和性状分离情况,得出亲本菌株BH3在生物量和耐高糖发酵力基因上是杂合的,主效应QTL在四分体中呈现2∶2的基因分离比,其中生物量主效应基因和MAT基因极大可能是连锁遗传的。在交配前的酵母四分体性状与基因连锁分析可以有效指导设计交配组合,更高效率得到优势性状菌株。
杂交和人工选择相结合是遗传学上的经典思路,本文以此为依据,利用工业高糖面包酵母BH3生孢自交来提升其耐高糖发酵力。制备了102株单倍体,优选18株单倍体构成27个组合进行交配,最终得到11株耐高糖发酵力高于亲本的新菌株,可以从中精选出用于纯系品种选育的下一个世代亲本。同时,即便进行了单倍体优选,依然有不少新菌株不如亲本,这是近交衰退的表现。自交系进行连续的纯合选育,可进一步促使性状分离固定,开发更优性状工业酵母菌株。
