基于MKL1/CAAP1通路探讨香青兰总黄酮对胃癌MGC-803细胞恶性生物学行为的影响
2022-03-10白露刘静静张欢何亚飞刘芳芳赵瑞娟
白露 刘静静 张欢 何亚飞 刘芳芳 赵瑞娟
(1濮阳医学高等专科学校,河南 濮阳 457000;2郑州大学医药科学研究院)
胃癌是最常见的恶性肿瘤之一,其死亡率在世界癌症中排名第三,由于缺乏早期诊断,大多数胃癌患者被诊断时已为晚期,临床上胃癌手术后治疗失败的最常见原因是原发性胃癌中游离癌细胞的播种引起腹膜转移,而且其高复发率和高转移率是胃癌患者低生存率的重要原因〔1〕。研究表明,巨核细胞白血病因子(MKL)1/半胱氨酸天冬氨酸蛋白水解酶活性和凋亡抑制因子 (CAAP)1通路参与肿瘤细胞增殖、分化、侵袭和迁移等细胞恶性生物学行为过程〔2〕。MKL1在许多组织中广泛表达,在血管平滑肌细胞和心肌细胞分化及肿瘤转移中起重要作用〔3,4〕。有研究表明,MKL1也可能参与胃癌细胞增殖〔5〕。CAAP1通过调节半胱氨酸天冬氨酸蛋白水解酶(Caspase)的表达和活性,被认为是凋亡途径的负调节因子〔6〕。因此,MKL1/CAAP1通路作为肿瘤治疗的新靶点逐渐得到重视。中草药因毒副作用小和抗肿瘤作用显著等优势越来越受到研究者的关注。香青兰总黄酮是香青兰的重要活性成分,具有抗炎、抗氧化应激等多种生物活性〔7〕。但关于香青兰总黄酮抗肿瘤活性的研究很少。因此,本研究主要检测香青兰总黄酮对胃癌MGC-803细胞恶性生物学行为的影响,并探讨MKL1/CAAP1通路是否参与这一过程,为研发胃癌新的治疗策略提供参考。
1 材料与方法
1.1实验细胞及药物 人胃癌MGC-803细胞株(购自中科院上海细胞生物研究所,批号:CM-1520);香青兰总黄酮(购自新疆维吾尔自治区药物研究所,原料药,纯度98.5%,批号:JL9017-13);曲妥珠单抗(购自上海罗氏制药有限公司,批号:B3344)。
1.2主要试剂与仪器 RPMI1640培养基、胎牛血清(购自美国Gibco公司,批号:PM16000044、10270106);四甲基噻唑蓝(MTT)试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒、TRIzol试剂、细胞蛋白抽提试剂盒、鼠抗人二抗(购自美国Amresco公司,批号:S0793、CA1020、P0033、A2016、L6017);反转录试剂盒、荧光定量PCR试剂盒、MKL1、CAAP1、基质金属蛋白酶(MMP)-2、Caspase-3和β-肌动蛋白(β-actin)抗体(购自美国Santa Cruz公司,批号:DRR019A、RR012A、HZ-048245、HZ-018542、HZ-0684R6、HZ-0611R10、HZ-0742R1);二氧化碳细胞培养箱(购自上海道尚生物科技有限公司,型号:Revco Elite I);酶标仪(购自南京德铁实验设备有限公司,型号:HBS-1096B);显微镜(购自日本奥林巴斯公司,型号:CX43);荧光定量PCR仪(购自西安天隆科技有限公司,型号:DTC-3G);垂直电泳仪(购自北京德元国际科技有限公司,型号:DYCZ-Mini2);流式细胞仪、凝胶成像仪(购自美国UVP公司,型号:CytoNova、GelDoc-IT TS3)。
1.3细胞培养和分组 在常规细胞培养条件下用含10%胎牛血清的RPMI1640培养基培养MGC-803细胞,待细胞融合度达到50%时进行实验。实验分为对照组,香青兰总黄酮低、中、高剂量组和曲妥珠单抗组。对照组不进行处理,香青兰总黄酮低、中、高剂量组分别给予浓度为25、50、100 mg/L的香青兰总黄酮〔8〕,曲妥珠单抗组给予浓度为10 mg/L的曲妥珠单抗,24 h后收获细胞进行相关检测〔9〕。
1.4MTT法检测细胞增殖率 按1.3给予受试物干预后接种于6孔板中(3 ml/孔),20 h后加入MTT试剂(50 μl/孔),继续培养4 h,离心弃上清,加入二甲基亚砜,室温振荡10 min,用酶标仪在630 nm处测定吸光度值(OD值),计算细胞增殖率〔细胞增殖率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%〕。只含有培养基、MTT试剂、二甲基亚砜设为空白组。
1.5流式细胞仪检测细胞凋亡率 按1.3给予受试物干预后接种于6孔板中(3 ml/孔),24 h后收获细胞,用磷酸盐缓冲液洗涤2次,离心弃上清,分别加入5 μl Annexin V-FITC与PI,充分混匀后室温避光孵育20 min,检测细胞凋亡率。
1.6Transwell法检测细胞侵袭能力 按1.3给予受试物干预后接种在24孔Transwell小室中,下室加入10%胎牛血清的RPMI1640培养液,24 h后取出小室,擦除上室中的细胞,用甲醛固定,用0.1%结晶紫染液染色30 min,冲洗干净后倒置显微镜下观察计数紫色染色的细胞(侵袭细胞数)。
1.7细胞划痕法检测细胞迁移能力 按1.3给予受试物干预后接种于6孔板中(3 ml/孔),待细胞贴壁后,用100 μl枪头划“一”字划痕,24 h后,显微镜下拍照,用图像分析仪测量划痕宽度,计算迁移距离(迁移距离=0 h时划痕宽度-24 h时划痕宽度)。
1.8实时荧光定量PCR法检测胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3 mRNA水平 将细胞以1×106个/ml接种于6孔板中(3 ml/孔),按1.3给予受试物干预24 h后,弃培养基,加入TRIzol进行总RNA提取,测定RNA的浓度和纯度,根据mRNA反转录试剂盒说明书,将总RNA转化为cDNA,制备20 μl反应体系,进行扩增。引物由上海捷瑞生物工程有限公司合成,MKL1上游引物为5′-GCGCTGAATCACATGCCAATACAGG-3′,MKL1下游引物为5′-AAGCACTTGGGGGCCGCAGTAGCGCAT-3′;CAAP1上游引物为5′-GGGAGTGAATAACGGGCGAAAAGTA-3′,CAAP1下游引物为5′-TACCTAGGCTGGCTTTTTTATATCA-3′;MMP-2上游引物为5′-CCCTTCAATGGTTGGTACATGG-3′,MMP-2下游引物5′-ACATTGATCTCCGTGACAGCC-3′;Caspase-3上游引物为5′-GACTCTGGAATATCCCTGGACAACA-3′,Caspase-3下游引物为5′-AGGTTTGCTGCATCGACATCTG-3′;β-actin上游引物为5′-TGCGACTTCAACAGCAACTC-3′,β-actin下游引物为:5′-CTTGCTCAGTGTCCTTGCTG-3′;采用2-△△Ct法计算MKL1、CAAP1、MMP-2和Caspase-3 mRNA的相对表达量(以β-actin作为内对照)。
1.9免疫印迹法检测胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3蛋白水平 将细胞以1×106个/ml接种于6孔板中(3 ml/孔),按1.3给予受试物干预24 h后,弃培养基,用磷酸盐缓冲液洗涤两次,根据细胞量加入细胞蛋白抽提试剂,冰浴裂解2 h,离心取上清,用聚丙烯酰胺凝胶进行电泳,转膜后用5%脱脂牛奶在室温下封膜1 h,将膜与MKL1(1∶300)、CAAP1(1∶200)、MMP-2(1∶400)、Caspase-3(1∶300)和β-actin(1∶2 000)抗体进行孵育,4℃过夜,室温条件下加入鼠抗人二抗(稀释比1∶5 000)孵育30 min。滴加电化学发光剂进行显色,采集图像,用Image J软件分析条带灰度值,以β-actin作为内对照。
1.10统计学分析 采用SPSS20.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1香青兰总黄酮对胃癌MGC-803细胞增殖和凋亡的影响 与对照组比较,各香青兰总黄酮剂量组细胞增殖率显著降低,细胞凋亡率显著增加,呈剂量依赖性,但效果不如曲妥珠单抗组(P<0.05)。见表1、图1、图2。
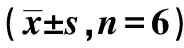
表1 香青兰总黄酮对胃癌MGC-803细胞增殖和凋亡的影响
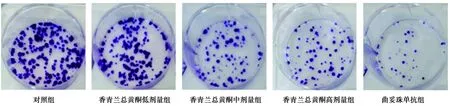
图1 香青兰总黄酮对胃癌MGC-803细胞增殖的影响(MTT染色,×200)
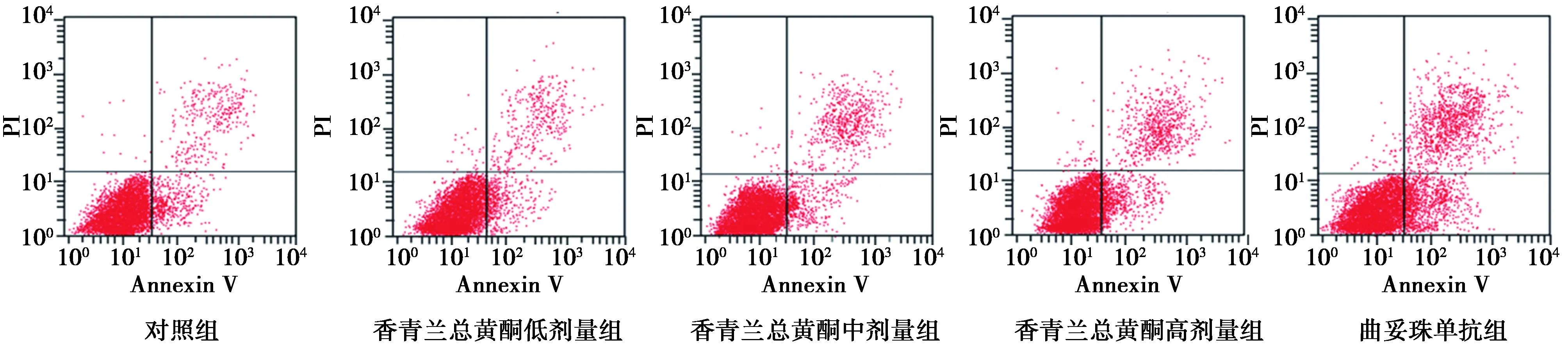
图2 香青兰总黄酮对胃癌MGC-803细胞凋亡的影响
2.2香青兰总黄酮对胃癌MGC-803细胞侵袭和迁移的影响 与对照组比较,各香青兰总黄酮剂量组侵袭细胞数和迁移距离显著降低,呈剂量依赖性,但效果不如曲妥珠单抗组(P<0.05)。见图3、图4、表2。

图3 香青兰总黄酮对胃癌MGC-803细胞侵袭的影响(结晶紫染色,×200)

图4 香青兰总黄酮对胃癌MGC-803细胞迁移的影响(×100)
表2 香青兰总黄酮对胃癌MGC-803细胞侵袭和迁移的影响
2.3香青兰总黄酮对胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3 mRNA水平的影响 与对照组比较,各香青兰总黄酮剂量组胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3 mRNA水平显著降低,呈剂量依赖性,但效果不如曲妥珠单抗组(P<0.05)。见表3。
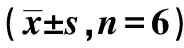
表3 香青兰总黄酮对胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3 mRNA水平的影响
2.4香青兰总黄酮对胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3蛋白水平的影响 与对照组比较,各香青兰总黄酮剂量组胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3蛋白水平显著降低,呈剂量依赖性,但效果不如曲妥珠单抗组(P<0.05)。见表4、图5。
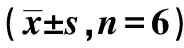
表4 香青兰总黄酮对胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3蛋白水平的影响
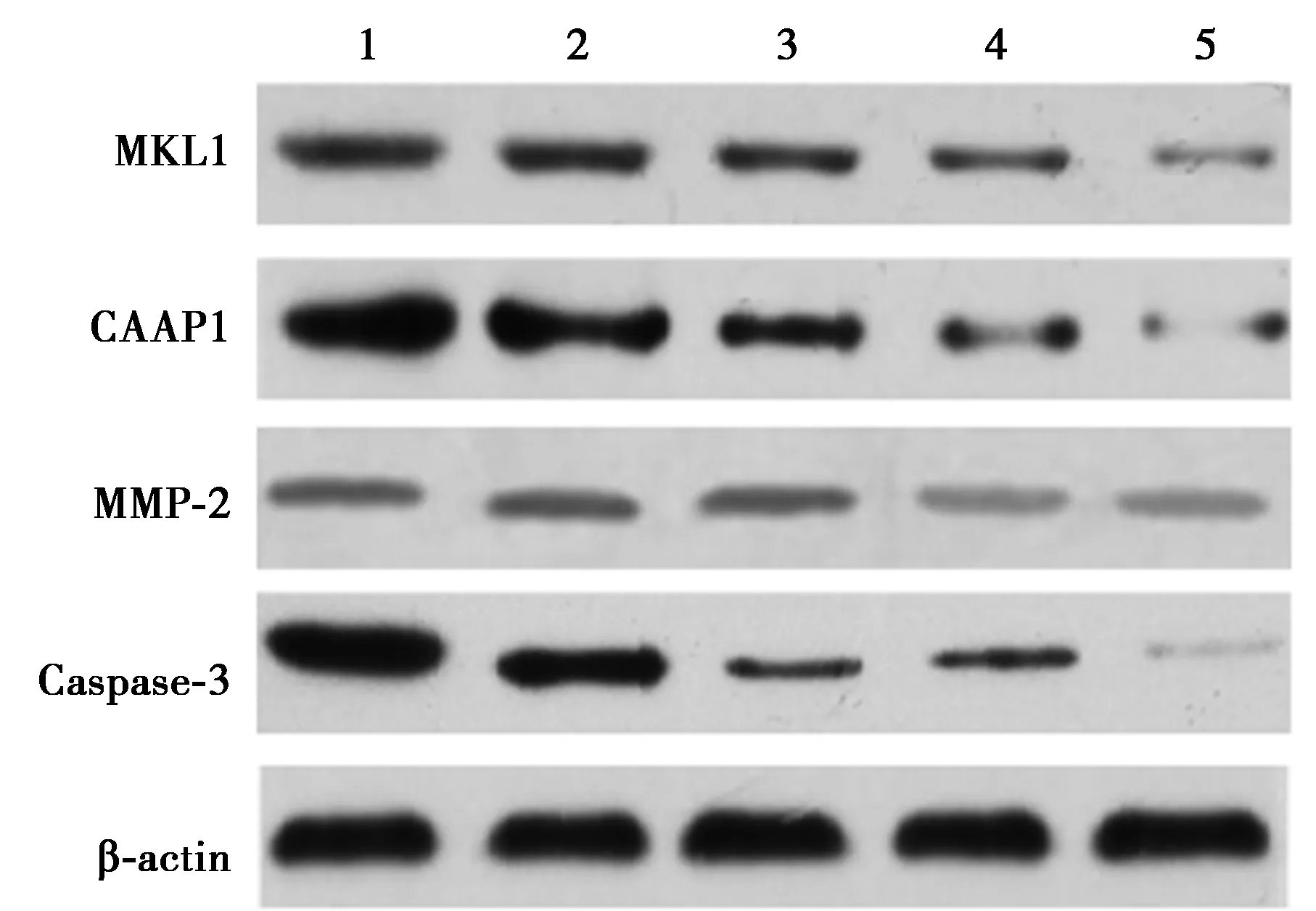
1~5:对照组、香青兰总黄酮低剂量组、香青兰总黄酮中剂量组、香青兰总黄酮高剂量组、曲妥珠单抗组图5 香青兰总黄酮对胃癌MGC-803细胞中MKL1、CAAP1、MMP-2和Caspase-3蛋白水平的影响
3 讨 论
胃癌是消化道最常见的恶性肿瘤之一,化疗仍然是主要的策略。然而,由于缺乏靶向治疗,这些传统化学物质还会对正常组织和细胞造成损伤,导致严重的毒副作用和耐药性〔10〕。因此,从分子水平研究胃癌的病因和发展机制,开发针对肿瘤靶点的靶向药物蛋白和信号通路成为当前研究的重点。天然产物中的抗癌化合物因其良好的安全性和多靶点效应,为肿瘤化疗提供了一个很有前途的选择〔11〕。本研究首次证明香青兰总黄酮能有效抑制胃癌细胞的增殖、侵袭和转移,并诱导细胞凋亡。曲妥珠单抗被美国食品与药品管理局批准用于治疗转移性胃癌患者〔12〕。虽然香青兰总黄酮对胃癌MGC-803细胞的生物学作用不如曲妥珠单抗,但考虑到曲妥珠单抗的副作用较多,香青兰总黄酮还是有进一步研究的价值。本研究同时发现,香青兰总黄酮能抑制胃癌MGC-803细胞中MKL1/CAAP1通路的激活。而CAAP1调节Caspase-10依赖的线粒体Caspase-3/9反馈扩增环来调控细胞凋亡。因此,MKL1/CAAP1通路可能在胃癌MGC-803细胞恶性生物学行为中发挥重要的调控作用。
MKL1是血清反应因子(SRF)的转录共激活因子。SRF通过与靶基因启动子区的高度保守的核苷酸序列〔CC(A/T)6GG〕结合,调控与细胞生长相关的多种靶基因的表达〔13〕。研究表明,MKL1参与了多种人类恶性肿瘤的发病机制,MKL1通过直接与细胞周期蛋白依赖性激酶6的启动子结合以增加其表达来促进胃癌细胞的侵袭〔14〕。此外,MKL1可以促进胃癌MGC-803细胞的G1/S期转化,促进细胞增殖〔4〕。MMP-2和金属蛋白酶1组织抑制因子(TIMP-1)是肿瘤侵袭转移过程中有两个关键因素。有报道称,胃癌中上皮细胞MMP-2的高表达与低生存率相关,胃癌侵袭性中TIMP-1的低表达与低生存率相关。在胃癌中,抑制MMP-2或上调TIMP-1的表达均可抑制转移〔15~18〕。在本研究中,香青兰总黄酮能降低胃癌MGC-803细胞中MKL1和MMP-2 mRNA和蛋白的表达,成功地抑制了胃癌细胞的侵袭和迁移。
CAAP1是一种具有强抗凋亡能力的蛋白质,具有很强的保守型,可以在各种组织中表达〔19〕。CAAP1干扰Caspase-10的激活,进而有效激活线粒体死亡途径所需的Caspase-3/9反馈放大环的生成。在细胞水平上,当CAAP1过表达时细胞凋亡水平降低,而当CAAP1沉默时细胞凋亡水平升高,而肿瘤细胞过度增殖往往与细胞凋亡和自噬失衡有关〔20〕。在本研究中,香青兰总黄酮能降低胃癌MGC-803细胞中CAAP1和Caspase-3 mRNA和蛋白的表达。因此,MKL1可以靶向CAAP1来抑制胃癌细胞的凋亡并促进增殖的发生,这意味着MKL1可以用作胃癌细胞中的促肿瘤基因。
综上所述,香青兰总黄酮可通过抑制胃癌MGC-803细胞增殖、迁移、侵袭、诱导细胞凋亡来发挥其抗癌作用,其机制可能与MKL1/CAAP1通路的抑制有关,可能为胃癌的治疗提供了一种新的策略。
