藤本月季花瓣形态结构和色素含量相关性分析
2022-03-10刘智媛杜习武彭勇政
刘智媛,叶 康,杜习武,彭勇政,秦 俊*,曾 丽*
(1.上海交通大学农业与生物学院,上海 200240;2.上海辰山植物园,上海 201602)
藤本月季‘安吉拉’(Rosa‘Angela’)为蔷薇科蔷薇亚科蔷薇属植物,20世纪80年代由德国Kordes公司育成,因花成簇开放、花量大、花色鲜艳、多季节开花、枝条长势强、叶色中绿有光泽、耐热性及抗病性好等特点,广泛应用于高架桥、花墙、花架、廊道及建筑墙面等立体绿化中,近年来受到越来越多的关注,也是目前中国长三角地区园林绿化应用的热点花卉之一[1-2]。花是植物最重要的观赏器官之一,其中花色种类丰富,色彩绚丽且渲染力强,是园林景观不可缺少的元素,也是提升和评价园林植物景观品质的重要指标之一。狭义的花色是指构成花冠的花瓣所呈现的颜色,广义的花色是指完整花器官甚至苞叶所呈现的颜色[3]。植物的花色受花色素种类及含量、糖类、脂类、细胞pH、花瓣结构、温度、光照、水分等综合因素的影响[4-5]。前人对月季花色的研究较多,SCHMITZER等[6]利用高效液相色谱/质谱法测量月季花发育过程中花色苷、槲皮素、儿茶素和酚酸的浓度,并计算色度参数与花色苷之间的相关性。OSTERC[7]发现月季从花蕾到衰老发育过程中,花瓣L*值增加,b*值和a*值减少;花朵盛开期花青素和槲皮素的总含量最高,而凋花期最低。程怡等[8]研究表明月季品种‘仙境’花色主要受到花色苷的直接作用,其他因素则通过影响花色苷间接影响花色的呈现。WAN等[9]对月季‘Sun City’花瓣进行高效液相色谱和质谱检测分析,花发育过程中花半开放时总黄酮含量最高(1 152.29 μg/g),类胡萝卜素盛花期最高(142.71 μg/g),黄酮醇和类胡萝卜素是形成黄色花的主要色素。目前有关月季发育过程中花瓣颜色、形态结构、色素分布、色素种类、色素含量等方面的变化规律仍缺乏较系统的研究,有关藤本月季‘安吉拉’花色与花瓣结构及色素含量变化规律尚未见报道。
该研究以藤本月季‘安吉拉’为试验材料,通过其花色度的L*值(明度)、a*值(红绿参数)、b*值(黄蓝参数) 、h值(色相角)和C*值(彩度),花色苷,类黄酮,类胡萝卜素和叶绿素含量的测定,结合花瓣发育过程中形态结构的变化,探索藤本月季‘安吉拉’发育过程花瓣形态结构和色素的相关性及变化规律,研究结果对提升藤本月季景观效果、推动藤本月季行业高效发展具有积极意义。
1 材料与方法
1.1 试验材料
藤本月季‘安吉拉’,来自上海辰山植物园,试验期间进行常规养护管理。
1.2 试验方法
1.2.1 花瓣发育过程的分期 参考程怡等[8]将花瓣发育过程分为 6 个时期(图 1),分别为小蕾期(BS,花蕾直径0.70 cm±0.02 cm)、大蕾期(CCS,小蕾期后3 d,花蕾直径0.75 cm±0.06 cm)、露色期(CES,小蕾期后6 d,花蕾直径1.10 cm±0.08 cm,花萼略微张开,花瓣从花萼中显现)、初开期(IOS,小蕾期后 9 d,花萼完全张开,花瓣逐渐开始开放,花瓣较小,花径4.25 cm±0.12 cm)、盛开期(FOS,小蕾期后10 d,花瓣完全展开,花径4.91 cm±0.08 cm)以及凋花期(WS,小蕾期后13 d,花型松散,花瓣开始掉落,花径6.02 cm±0.25 cm)。
花瓣发育过程中花蕾及花朵外部直径的测定是在相同栽培条件下,随机采取同一发育时期不同花蕾或花朵10个测其直径,取平均值。
1.2.2 花色值测定 采用英国皇家园艺协会比色卡(Royal Horticultural Social Color Chart,RHSCC)(RHS,2015)测定不同发育时期的花瓣颜色。
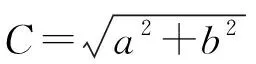
1.2.3 花瓣形态结构观察 通过徒手切片法、石蜡切片法及扫描电镜法观察不同发育时期花瓣结构。
徒手切片法:分别选取6个发育时期的新鲜花瓣,采用双刀片法划取花瓣中间部位,取下刀片间花瓣结构,在Olmypus BX41显微镜下观察花瓣横切结构及色素分布,并拍照。
石蜡切片法:分别选取6个发育时期的新鲜花瓣中间部位,进行脱水、透明、浸蜡、包埋及修块等步骤后,利用莱卡Leica2245切片机进行切片,切片厚度8~10 μm,将切片放置于莱卡H1220烘片台烘片,条带完全展开后用番红/固绿溶液染色,Olmypus BX41显微镜下观察花瓣横切结构,并随机选择不同发育时期5个花瓣样本测量花瓣厚度,取平均值为花瓣厚度。
扫描电镜法:选取6个发育时期的新鲜花瓣,将花瓣中间部位剪裁成0.5 cm×0.5 cm,立即用2.5%戊二醛溶液固定保存24 h,在磷酸缓冲液中彻底清洗。随后用乙醇溶液梯度脱水,叔丁醇逐级置换,用VFD冷冻干燥仪进行冷冻干燥后粘于样品台上,材料表面喷镀薄层金膜,置于HITACHIQ250扫描电镜下观察花瓣上表皮和下表皮结构,并拍照。同时在3000 ×放大倍数下对花瓣上表皮细胞(upper epidermal cells,UC)数目和下表皮细胞(below pidermal cells,BC)数目进行统计,重复5次,取平均值。
1.2.4 花瓣不同色素含量的测定 采集不同发育时期的花瓣,迅速用液氮冷冻并保存于-80 ℃冰箱内,去除花瓣基部,取花瓣前2/3部分进行不同色素含量的测定。
类黄酮测定参考WAN等[9]方法,采用AlCl3显色法,烘干样品0.02 g,加入 2 mL 提取液,60 ℃振荡提取2 h取上清,依次6 μL的NaNO2混匀; 5 min后加入6 μL的AlCl3混匀,放置 6 min;加 80 μL的NaOH溶液,静置15 min后,在波长510 nm处的测定其OD值。花色苷测定参考唐琳等[10]采用pH示差法,称取烘干样品0.1 g,加入1 mL 60%酸性乙醇提取液,取20 μL上清液,分别用pH l.0的氯化钾-盐酸缓冲液、pH 4.5的醋酸钠-盐酸缓冲液稀释10倍,40 ℃水浴20 min,分别在530 nm和 700 nm下测定其OD值。
类胡萝卜素(carotenoid,Car)和叶绿素(chlorophyll,Chl)采用唐延林等[11]方法进行提取测定,剪取0.2 g花瓣样品加入(丙酮、无水乙醇 、蒸馏水的体积比为4.5∶4.5∶1)100 mL提取液于室温下遮光静置至花瓣完全发白,在波长663、645和440 nm下测量其OD值,类胡萝卜素和叶绿素计算公式:
叶绿素a (mg/L)=9.784OD663 nm-0.990OD645 nm
叶绿素b(mg/L)=21.426OD645 nm-4.650OD663 nm
总叶绿素(mg/L)=5.134OD663 nm+20.436OD645 nm
类胡萝卜素(mg/L)=4.695OD440 nm-0.268 (叶绿素a+叶绿素b)
叶绿素(mg/g)=[叶绿素 (mg/L)×提取液体积(mL)]/[样品质量(g)×1 000]。
类胡萝卜素(mg/g)=[类胡萝卜素(mg/L)×提取液体积(mL)]/[样品质量(g)×1 000]。
1.3 数据分析
利用SPSS22.0进行数据分析,使用SigmaPlot 14.0软件绘制图表。
2 结果与分析
2.1 花瓣不同发育时期表型变化特征
采用英国皇家园艺协会比色卡测定不同发育时期的花瓣近轴面、远轴面颜色(图1)。从小蕾期至凋花期近轴面花色值依次为154D-39B-63A-N57B-N66B-N66D,远轴面花色值依次为154D-38A-58B-62A-62A-73B,由此可以看出近轴面和远轴面花瓣颜色变化规律相似,但远轴面花色比近轴面花色略浅。
利用分光测色仪测花瓣上表皮、下表皮的L*值、a*值、b*值如表1所示。小蕾期花瓣L*值和b*值显著高于其他时期,a*值和h值显著低于其他时期,说明花色亮度较高,主要呈黄绿色且有明显的色相差。大蕾期L*值、b*值和C*值开始下降,a*值和h值显著增加,说明此时花瓣亮度开始降低,红色开始显现,但仍有明显的色像差。露色期L*值达到最低,a*值和C*值升高,b*值和h值下降,说明此时花瓣红色开始加深。初开期L*值上升,a*值和C*值达到较高,b*值和h值持续降低,说明此时花瓣红色程度达到最高,花瓣颜色均匀。盛开期L*值虽有显著上升,但a*值、b*值、C*值和h值均出现显著降低的趋势,说明此时花瓣红色开始褪减,花瓣颜色分布不均匀。凋花期花瓣L*值显著增加,但a*值和C*值显著下降,b*值与盛花期时无明显差异,说明此时花瓣红色表现持续减弱,部分褪至白色,整体颜色分布不均。花瓣近轴面与远轴面花色变化规律基本一致。
注:A是小蕾期;B是大蕾期;C是露色期;D是初开期;E是盛开期;F是凋花期;BP是近轴面,FP是远轴面。Note: A is bud stage; B is color changing stage; C is color exposing stage; D is initial opening stage; E is full opening stage; F is wilting stage; BP is back petal, FP is front petal.图1 花瓣不同发育时期形态Fig.1 Morphology at different development stages

表1 花瓣不同发育时期花色值变化Tab.1 The changes of petals color changes at different development stages
2.2 花瓣不同发育时期横切结构的变化
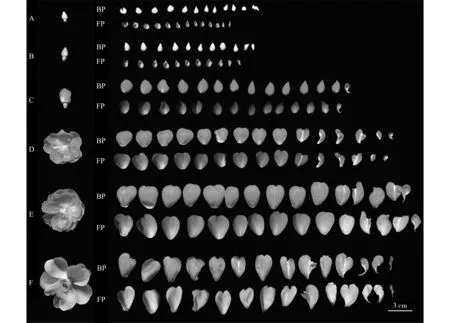
通过石蜡切片法观察藤本月季‘安吉拉’花瓣横切结构,如图2 所示。花瓣横切结构由上表皮、栅栏组织、海绵组织和下表皮四个部分组成,上表皮、栅栏组织和下表皮由一层细胞组成,细胞间排列较紧密,海绵组织由多层细胞组成,细胞间有间隙,其中分布有维管束。采用徒手切片法观察不同发育时期花瓣结构如图3,大蕾期、露色期、初开期色素集中分布在上表皮和下表细胞中,盛开期部分海绵组织有色素分布。
小蕾期(图2A)上表皮向外成圆形凸起,细胞排列紧密;栅栏组织间细胞排列紧密,构成细胞形状有差异;海绵组织无规则排列,多层,有明显细胞空隙;下表皮细胞呈柱状,细胞紧密排列,细胞表面无明显突起,细胞体积较上表皮细胞大。此时未见明显色素分布(图3A)。
大蕾期(图2B)上表皮细胞有明显圆锥状突起,细胞体积增大;栅栏组织和海绵组织细胞体积开始增大;下表皮细胞体积纵向增长,花瓣厚度未见有明显差异。上表皮和下表皮有明显色素积累,颜色较浅。花瓣结构与小蕾期无显著差异(图3B)。
露色期(图2C)花瓣结构与小蕾期、大蕾期结构出现显著差异。上表皮细胞向外凸起伸长呈乳突状;栅栏组织和海绵组织排列疏松,细胞间存在明显空隙;下表皮细胞体积增大,细胞表面无明显突起。上表皮、下表皮细胞有明显色素积累,颜色加深(图3C)。
初开期(图2D)花瓣厚度持续增加,上表皮细胞顶部开始萎缩,由较长的乳突状变为扁平的乳突状;栅栏组织一层细胞,排列紧密程度降低;海绵组织细胞间隙增加;下表皮细胞排列整齐,细胞形状、大小有差异。上表皮、下表皮细胞和栅栏组织均有明显色素积累,且亮度较高(图3D)。
盛开期(图2E)花瓣厚度达到最大,上表皮细胞持续萎缩,栅栏组织与初开期相似,海绵细胞空隙进一步增加,下表皮细胞排列整齐,细胞间无间隙。与初开期细胞结构无明显差异。此时细胞色素积累减少,颜色变浅(图3E)。
凋花期(图2F)花瓣厚度变薄,上表皮呈弯曲状,细胞宽度增加,高度降低,仅基部紧密相连;无明显栅栏组织,组成海绵组织的细胞基本破裂,细胞间隙变大;下表皮呈弯曲状,细胞间排列仍保持紧密。上表皮、下表皮色素分布均不明显(图3F)。

注:A是小蕾期;B是大蕾期;C是露色期;D是初开期;E是盛开期;F是凋花期;UC是上表皮细胞;MC是中层细胞;BC是下表皮细胞;IS是细胞间隙;Pa是栅栏组织;Sp是海绵组织。 Note: A is bud stage; B is color changing stage; C is color exposing stage; D is initial opening stage; E is full opening stage; F is wilting stage; UC is upper epidermal cells; MC is middle cells; BC is below pidermal cells; IS is clearance between cells; Pa is palisade tissue; Sp is sponge tissue.图2 花瓣不同发育时期横切结构变化Fig.2 Cross-sectional structure of petals at different development stages
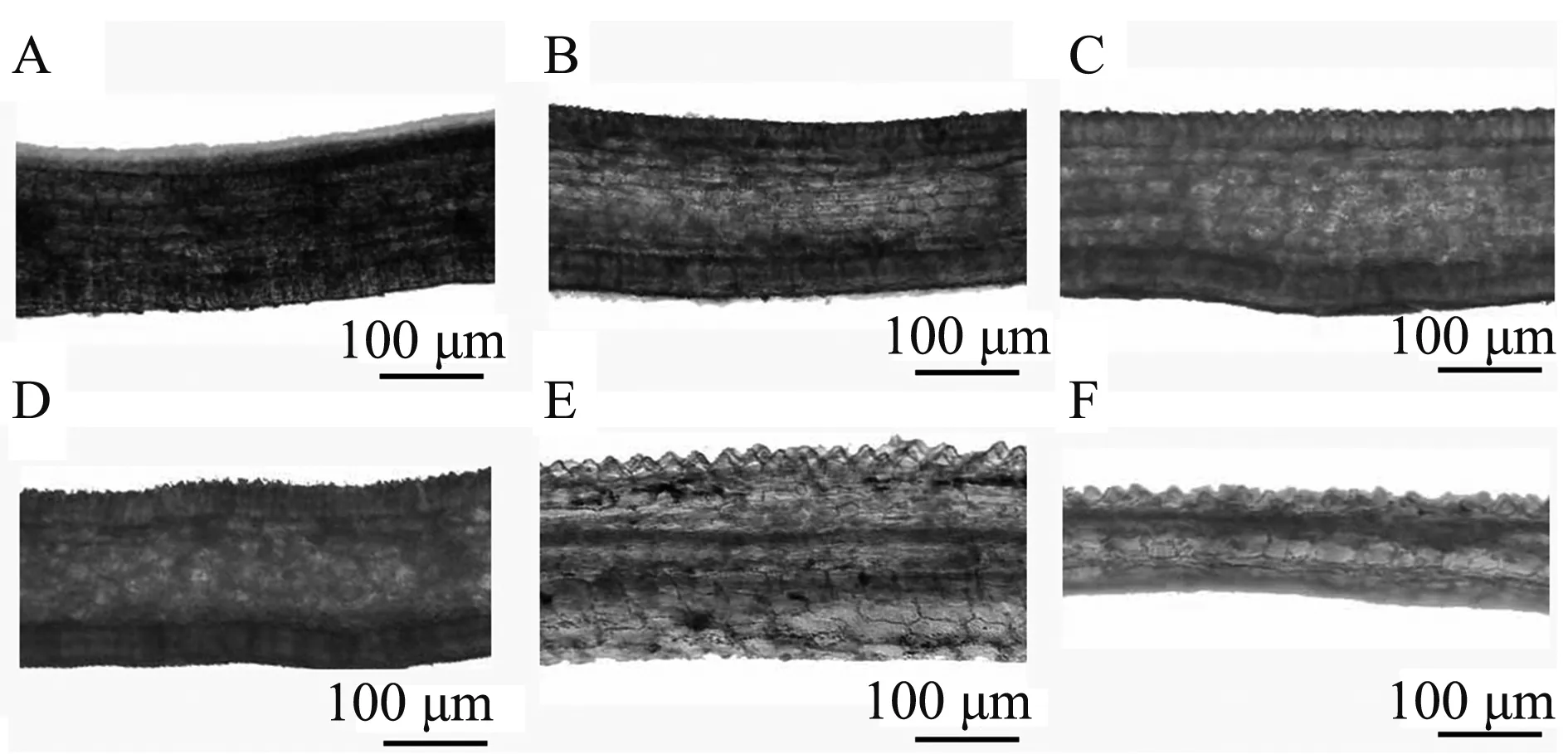
注:A是小蕾期;B是大蕾期;C是露色期;D是初开期;E是盛开期;F是凋花期。Note: A is bud stage; B is color changing stage; C is color exposing stage; D is initial opening stage; E is full opening stage; F is wilting stage.图3 花瓣不同发育时期表皮色素积累变化Fig.3 Changes in epidermal pigmentation at different development stages
花瓣不同发育时期厚度发生变化,见图4。盛开期花瓣厚度最大为324.25 μm,显著高于其他时期;小蕾期和大蕾期花瓣厚度变薄,分别为111.72 μm和115.98 μm,无显著性差异。
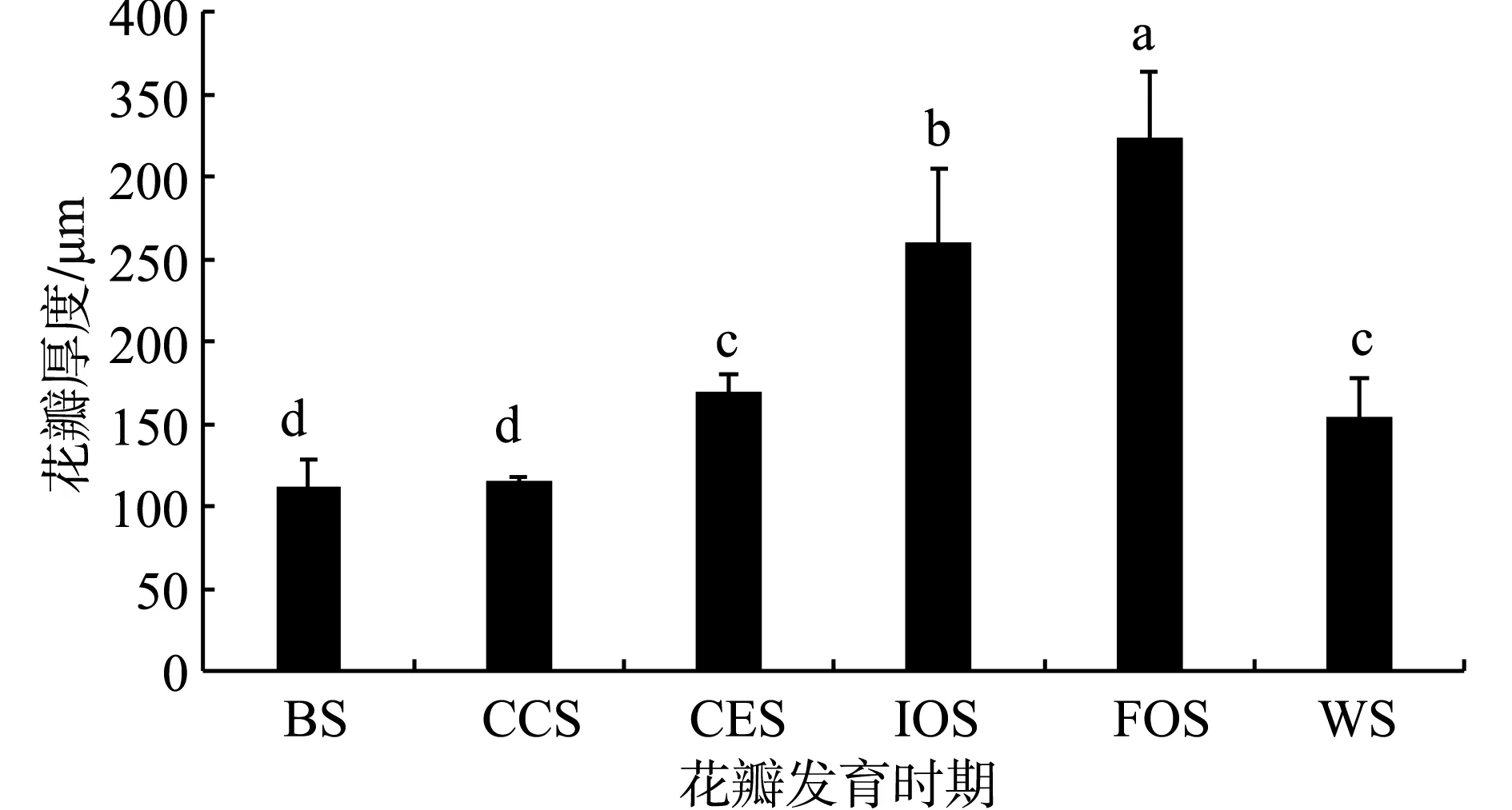
注:a、b 和 c表示P≤0.05水平有显著性差异;BS、CCS、CES、IOS、FOS和WS分别代表小蕾期,大蕾期,露色期,初开期,盛开期和凋花期。Note:a, b and c indicate significant difference at P≤0.05 level; BS, CCS, CES, IOS, FOS and WS represent stand for bud stage, color changing stage, color exposing stage, initial opening stage, full opening stage and wilting stage.图4 花瓣不同发育时期厚度的变化Fig.4 Changes of petal thickness of Rosa ‘Angela’ at different development stages
2.3 花瓣不同发育时期上表皮、下表皮细胞形态及数目的变化
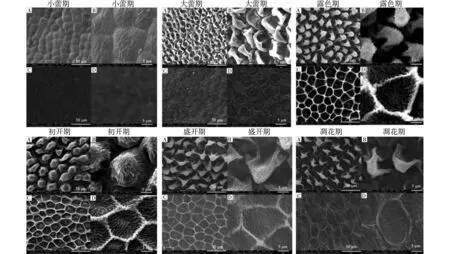
利用扫描电镜法观察花瓣不同发育时期的上表皮和下表皮外部形态,同时在3000×放大倍数下对花瓣上表皮细胞数目和下表皮细胞数目进行统计,如图5。随花瓣的发育,上表皮细胞和下表皮细胞不断生长,体积持续增加,同一视野中上表皮细胞数目和下表皮细胞数目均呈下降趋势,上表皮细胞体积较小,其数目均明显多于下表皮细胞。
图6所示花瓣不同发育时期上表皮和下表皮结构。花瓣近轴面和远轴面表皮细胞形态完整且排列规则,但表皮细胞大小、形状存在差异。

注:a、b 和 c表示上表皮细胞P≤0.05水平有显著性差异;A、B和C表示下表皮细胞P≤0.05水平有显著性差异;BS、CCS、CES、IOS、FOS和WS分别代表小蕾期,大蕾期,露色期,初开期,盛开期和凋花期。 Note: a, b and c indicate significant difference at P≤0.05 level of UC; A, B and C indicate significant difference at P≤0.05 level test of BC; BS, CCS, CES, IOS, FOS and WS represent stand for bud stage, color changing stage, color exposing stage, initial opening stage, full opening stage and wilting stage.图5 花瓣不同发育时期表皮细胞数目的变化Fig.5 Changes of epidermal cells number of Rosa ‘Angela’ at different development stage
小蕾期花瓣上表皮细胞呈不规则多边形,细胞间排列紧密,细胞表面微微隆起,细胞表面有不规则条纹褶皱,细胞间无空隙,细胞体积较小。下表皮细胞呈扁平状,细胞边缘出现波纹状条纹,细胞间无明显差异。
注:A是上表皮结构3 000×倍数,B是上表皮结构10 000×倍数,C是下表皮结构3 000×倍数,D是下表皮结构10 000×倍数。Note: A is upper epidermal structure at 3000×multiple, B is upper epidermal structure 10000×multiple, C is below epidermal structure at 3000×multiple, D is below epidermal structure at 10000×multiple.图6 花瓣不同发育时期表皮结构变化Fig.6 Petal epidermal structure at different development stages
大蕾期花瓣上表皮细胞开始向上伸长,顶部扁平呈穹顶型,细胞表面光滑,细胞间无间隙,细胞体积开始增大。下表皮细胞呈不规则多边形状,细胞边缘出现不规则褶皱,细胞间无明显差异。
露色期花瓣上表皮细胞顶部持续向上伸长,细胞顶端出现明显褶皱且细胞呈乳突状,细胞体积持续增加。下表皮细胞中部开始向下凹陷,表面形成明显的网状突起,细胞表面布满褶皱,细胞边缘轮廓清晰。
初开期花瓣上表皮细胞呈乳突状,细胞顶端褶皱加深,细胞饱满且体积持续增加,部分细胞尖端开始变扁平。下表皮细胞中部持续向下凹陷且褶皱逐渐加深,细胞形态结构与露色期无明显差异。
盛开期花瓣上表皮细胞尖端扁平,表面的褶皱纹路变少,细胞出现萎缩。下表皮细胞形状与露色期和初开期无明显差异,但部分细胞体积开始变小。
凋花期花瓣上表皮细胞皱缩严重,细胞体积缩小。下表皮细胞网状凸起变扁平,褶皱减少甚至消失。
2.4 花瓣不同发育时期色素含量的变化
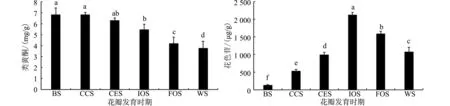
花瓣不同发育时期类黄酮和花色苷含量的变化如图7。小蕾期和大蕾期随花瓣发育类黄酮含量相同,均为6.82 mg/g,初开期至凋花期花瓣类黄酮含量呈显著下降趋势,分别为5.47、4.52和3.43 mg/g。花色苷含量呈现先增加再降低的规律,小蕾期花色苷含量最低,为132.82 μg/g,随着花瓣发育花色苷含量显著升高,初开期花色苷含量最高,为2 124 μg/g,显著高于其他时期,盛开期和凋花期花色苷含量显著下降,分别为1 589.17 μg/g和1 150.46 μg/g。
注:a、b 和 c表示P≤0.05水平有显著性差异;BS、CCS、CES、IOS、FOS和WS分别代表小蕾期,大蕾期,露色期,初开期,盛开期和凋花期。Note:a, b and c indicate significant difference at P≤0.05 level; BS, CCS, CES, IOS, FOS and WS represent stand for bud stage, color changing stage, color exposing stage, initial opening stage, full opening stage and wilting stage.图7 花瓣不同发育时期类黄酮和花色苷含量的变化Fig.7 Changes of flavonoids and anthocyanins contents of Rosa ‘Angela’ at different development stages
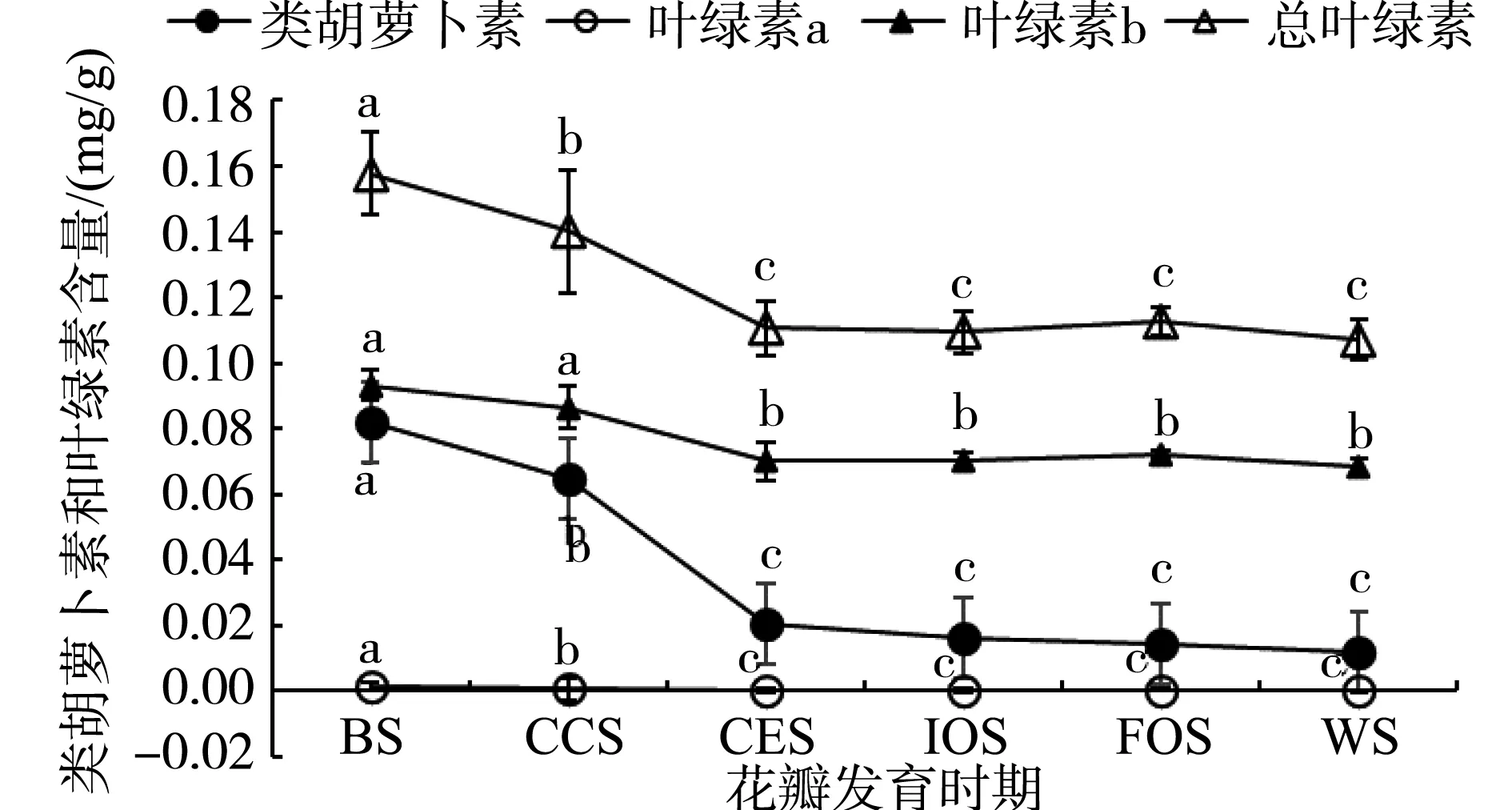
花瓣不同发育时期类胡萝卜素和叶绿素含量的变化见图8。花瓣发育过程中叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量变化规律相似,均呈逐渐下降的趋势。小蕾期达到最高,且显著高于其他时期,盛开期和凋花期之间无显著性差异。
2.5 花瓣不同发育时期各指标间相关性分析
利用SPSS22.0对各指标进行相关性分析结果见表2和表3。花瓣a*值与b*值、叶绿素a、叶绿素b、总叶绿素、类胡萝卜素存在负相关关系。花瓣远轴面a*值与花色苷表现出显著的正相关关系,而与上表皮细胞数目呈显著的负相关关系。花色苷含量与花瓣厚度呈显著正相关关系,与类胡萝卜素、叶绿素a和总叶绿素含量呈负相关关系。类黄酮含量和花瓣近轴面b*值呈正相关关系,与上表皮细胞数目呈显著负相关关系。类胡萝卜素与总叶绿素存在极显著的正相关关系,相关系数达到0.99。上表皮细胞数目、下表皮细胞数目与花瓣中类黄酮、类胡萝卜素、总叶绿素等呈正相关关系。花瓣红色的程度与细胞数目和花色苷含量呈显著正相关,而花瓣黄绿色程度则与类黄酮、类胡萝卜素和总叶绿素含量呈显著正相关。
注:a、b 和 c表示P≤0.05水平有显著性差异;BS、CCS、CES、IOS、FOS和WS分别代表小蕾期,大蕾期,露色期,初开期,盛开期和凋花期。 Note: a, b and c indicate significant difference at P≤0.05 level; BS, CCS, CES, IOS, FOS and WS represent stand for bud stage, color changing stage, color exposing stage, initial opening stage, full opening stage and wilting stage.图8 花瓣不同发育时期类胡萝卜素和叶绿素含量的变化Fig.8 Changes of chlorophyll and carotenoid contents of Rosa ‘Angela’ at different development stages
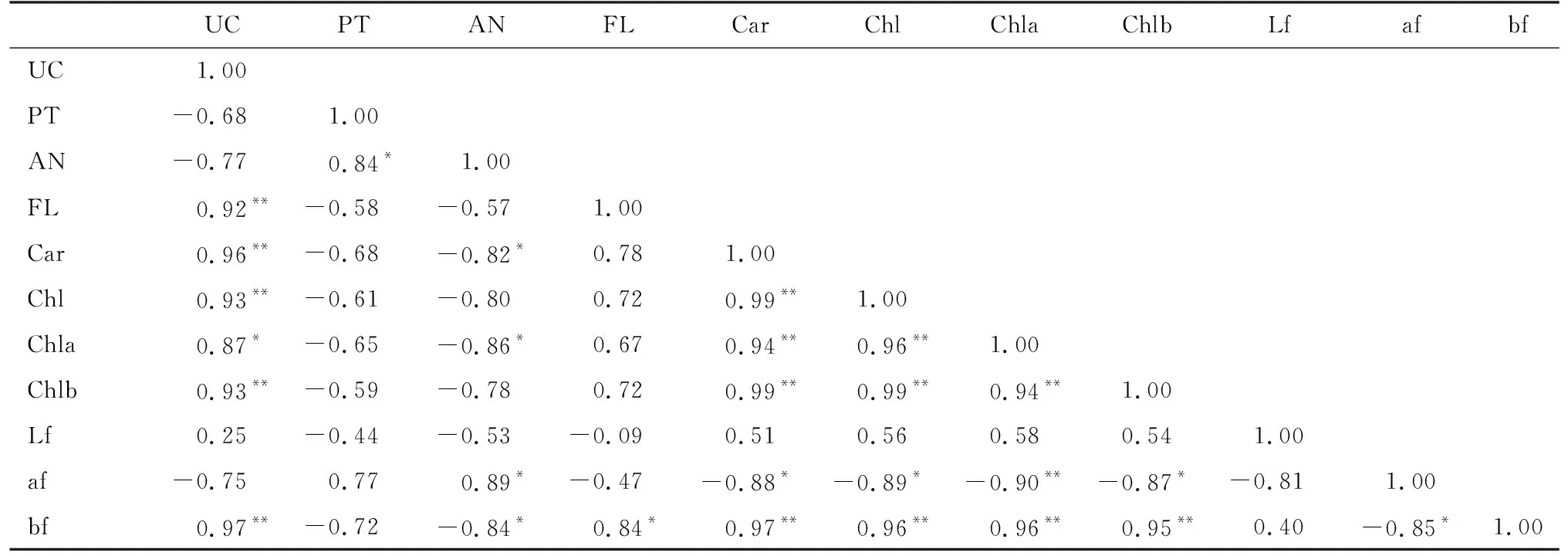
表2 花瓣发育过程中各指标与近轴面花色的相关分析Tab.2 Correlation coefficients among different physiological and biochemical indexes of back petals

表3 花瓣发育过程中各指标与远轴面花色的相关分析Tab.3 Correlation coefficients among different physiological and biochemical indexes of front petals
3 讨 论
3.1 花色与花瓣结构的关系
该研究发现藤本月季‘安吉拉’花色随花瓣发育上表皮、下表皮细胞形态及色素分布发生相应变化:小蕾期和大蕾期花瓣上表皮平整光滑,表皮细胞体积较小,边缘出现波纹状条纹,可反射更多光线,上表皮、下表皮均无明显的色素分布,花瓣亮度较高,L*值显著高于其他时期;露色期和初开期花瓣上表皮细胞体积和厚度逐渐增大,向外的凸起伸长呈乳突状,下表皮细胞向外形成网状突起,并布满条状褶皱,上表皮、下表皮有明显的色素分布,且上表皮色素积累多于下表皮,可吸收更多的入射光线,从而使花瓣颜色加深,此时a*值显著高于其他时期,颜色为深粉色;盛开期和凋花期花瓣上表皮、下表皮细胞凸起降低,下表皮细胞近扁平,上表皮、下表皮色素分布不明显,且花瓣海绵细胞出现色素,此时a*值逐渐下降,颜色为浅粉色。
花瓣色素的分布影响花色的变化,花瓣色素一般存在于上表皮、下表皮细胞,不同植物花瓣的色素分布存在明显差异[12]。陈建等[13]研究发现非洲菊花色素主要分布在花瓣上表皮细胞、下表皮细胞和栅栏组织;岳娟[14]发现色素主要分布在花瓣表皮和栅栏组织,认为花瓣中色素的分布位置对花色的形成和呈现产生影响;程怡等[8]发现色素集中分布在月季 ‘仙境’上表皮和栅栏组织的上部,且上表皮颜色较下表皮深,与该试验中色素分布规律相似。
花瓣上表皮、下表皮细胞的形状及数目影响花色的变化,刘石泉等[15]认为当花瓣上表皮细胞向外呈乳突状时可促进入射光的吸收,从而使花色加深,形成红色;下表皮细胞呈扁平状,可反射入射光,使花色变浅。陈建等[13]发现非洲菊花瓣上表皮细胞圆锥形结构表面反射入射光对花色的影响随着色素含量的增加而增大;岳娟[14]发现花瓣上表皮细胞尖锥形凸起使花色更深;NODA等[16]通过Myb基因组调控表皮细胞形状,从而改变金鱼草花色深浅。YOSHIDA等[17]发现花菖蒲紫色会随花瓣表皮细胞的长度以及排列顺序而发生变化。安田齐[4]发现红色蔷薇上表皮、下表皮变化可改其花色深浅,与该研究结果相似。
3.2 花色与色素种类及含量的关系
花色素是影响花色变化的主要因素,由类黄酮(含黄酮、黄酮醇、查尔酮和花色苷)、类胡萝卜素和生物碱决定。藤本月季‘安吉拉’花色受到不同色素种类和含量的影响,小蕾期及大蕾期花色主要呈黄绿色,类黄酮、叶绿素和类胡萝卜素显著高于其他时期;进入露色期后,花瓣开始变红,花色苷显著增加,类黄酮、叶绿素和类胡萝卜素含量开始下降;初开期后,花色苷含量达到最高,随后花瓣红色逐渐减退。盛开期和凋花期后,花色苷、类黄酮、类胡萝卜素和叶绿素含量均呈逐渐下降趋势。花瓣黄绿程度与类黄酮、类胡萝卜素和叶绿素含量呈显著正相关,花瓣红色程度与花色苷含量呈显著正相关。
花色苷是花色素组成成分之一,在花瓣中含量较少,主要控制红色系花色的形成,随花色苷的增加,花色逐渐由红色向紫色和黑色转变[4, 17]。程怡等[8]对月季‘仙境’花色变化进行研究,发现花色苷是近轴面花色的主要决定因素。陈小红等[18]证明花色苷是影响鸳鸯茉莉花色变化的决定性代谢产物。与该研究中花色苷与花瓣近轴面a*值具有极显著的相关关系结果相符。
类黄酮是组成花色素的重要成分,主要包括黄酮、查尔酮及橙酮,是影响黄色系花形成的原因之一[4],类黄酮类化合物可通过共色作用与花色苷一起呈现增色效应及红移现象[19]。钟培星等[20]发现芍药开花过程中黄酮含量升高,花青苷含量减少是花瓣红色减退的主要原因。张杨青慧等[21]发现菊花花瓣颜色在未变红时,花瓣中仅检测出类黄酮化合物特征吸收峰,说明菊花花瓣黄色由类黄酮决定,这与该研究中b*值与类黄酮呈正相关关系相符。
类胡萝卜素主要决定花的黄色和橙色[22],叶绿素参与植物光合作用,主要使叶片呈绿色[23]。类胡萝卜素的颜色常被叶绿素所掩盖,但在植物发育的后期,其色彩逐渐显现,可增强花瓣颜色[24]。类胡萝卜素积累能改变桂花花瓣的a*值[25],同时是黄色菊花的主要显色物质[26],通过调节类胡萝卜素异构酶能够有效改变金盏花花瓣颜色[27]。该试验中类胡萝卜素和叶绿素和b*值有显著相关关系,说明类胡萝卜素和叶绿素对‘安吉拉’小蕾期花瓣黄绿色有显著影响,与前人研究相符。
月季开花过程中花色变化十分复杂,不仅与花色素的种类、积累和分布、花瓣结构的变化有相关关系,还会受到细胞pH、环境变化和基因调控等因素的影响,有关月季的花色形成机制及相关影响因子还有待进一步研究。
