脂蛋白相关磷脂酶A2对老年颈动脉粥样硬化患者斑块稳定性的预测价值
2022-03-10任莉张倩莹李绍东
任莉,张倩莹,李绍东
1. 徐州医科大学医学影像学院,江苏徐州221004;2. 江苏省荣军医院超声科,江苏无锡214035;3. 徐州医科大学附属医院医学影像科,江苏徐州221004
动脉粥样硬化性心血管疾病是老年人致死率、致残率升高的主要原因,严重影响患者的生活质量。脱落后的不稳定斑块可阻塞血管,进而诱发急性脑梗死[1-2]。近年来急性脑梗死的发生率居高不下,因此临床上急需寻找一种判断颈动脉粥样硬化斑块稳定性的特异性标志物。脂蛋白相关磷脂酶A2 (lipoprotein associated phospholipase A2, Lp-PLA2)由巨噬细胞和淋巴细胞合成,与动脉粥样硬化的发生与发展密切相关[3]。目前血清Lp-PLA2 对老年颈动脉粥样硬化患者斑块稳定性的预测价值尚不明确,本研究旨在探讨老年颈动脉粥样硬化患者斑块稳定性与血清Lp-PLA2 的相关性。
1 对象与方法
1.1 研究对象
将2016年6月—2021年5月江苏省荣军医院收治的老年颈动脉粥样硬化患者作为研究对象进行回顾性研究。纳入标准:(1)年龄>60 岁;(2)符合颈动脉粥样硬化诊断标准[4];(3)颈动脉超声检查显示颈动脉内 中膜厚 度(intima-media thickness, IMT) ≥1. 5 mm;(4)既往无脑梗死病史,且入院前未接受任何治疗;(5)临床资料完整、清晰。排除标准:(1)免疫功能异常者;(2)合并颅内肿瘤或其他恶性肿瘤者;(3)合并血液系统疾病者;(4)存在精神、认知或沟通障碍者。研究经过医院伦理委员会审批通过(2016022)。
1.2 临床资料采集
(1)一般资料:性别、年龄和体质量指数(body mass index,BMI)等;(2)实验室有关指标:总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)及C 反应蛋白(C reactive protein,CRP)。
1.3 颈动脉超声检查
由2 位高年资医师通过彩色多普勒超声诊断仪(飞利浦,EPIQ5)进行颈动脉超声检查,若存在争议经讨论后达成一致意见。患者仰卧位,依次检查颈总动脉、颈内动脉与颈外动脉分支,并测定IMT。斑块积分通过双侧孤立的粥样硬化斑块最大厚度之和计算[5]。
依据斑块性质[6]将患者分为不稳定斑块组和稳定斑块组。稳定斑块组斑块包含纤维斑、钙化斑及硬斑(主要特征为表面光滑、内膜完整,内部回声均匀);不稳定斑块组斑块包含软斑和溃疡斑(主要特征为表面欠光滑、内膜不完整,内部回声不均匀)。
1.4 血清Lp-PLA2 检测
所有患者入院时采集外周静脉血5 mL,离心后分离血清,-20℃保存待测。上转发光法测定血清Lp-PLA2 水平,试剂盒(批号:20201103)购自北京热景生物技术有限公司。
1.5 统计学分析
采用SPSS20.0 进行统计学分析,正态分布的计量资料通过均数±标准差(±s)描述,组间比较采用独立样本t检验;计数资料以例数(%)描述,采用x2检验。Logistic 回归分析探讨影响斑块稳定性的相关因素;绘制受试者操作特征(receiver operating characteristic, ROC)曲线,以曲线下面积(area under the curve, AUC)评价血清Lp-PLA2 对不稳定性斑块的预测价值,P<0.05 为差异有统计学意义。
2 结果
2.1 2 组一般资料比较
研究共纳入82 例老年颈动脉粥样硬化患者,年龄61~82 岁,平均(71.1 ±8.3)岁,其中不稳定板块组49 例、稳定斑块组33 例。见图1。
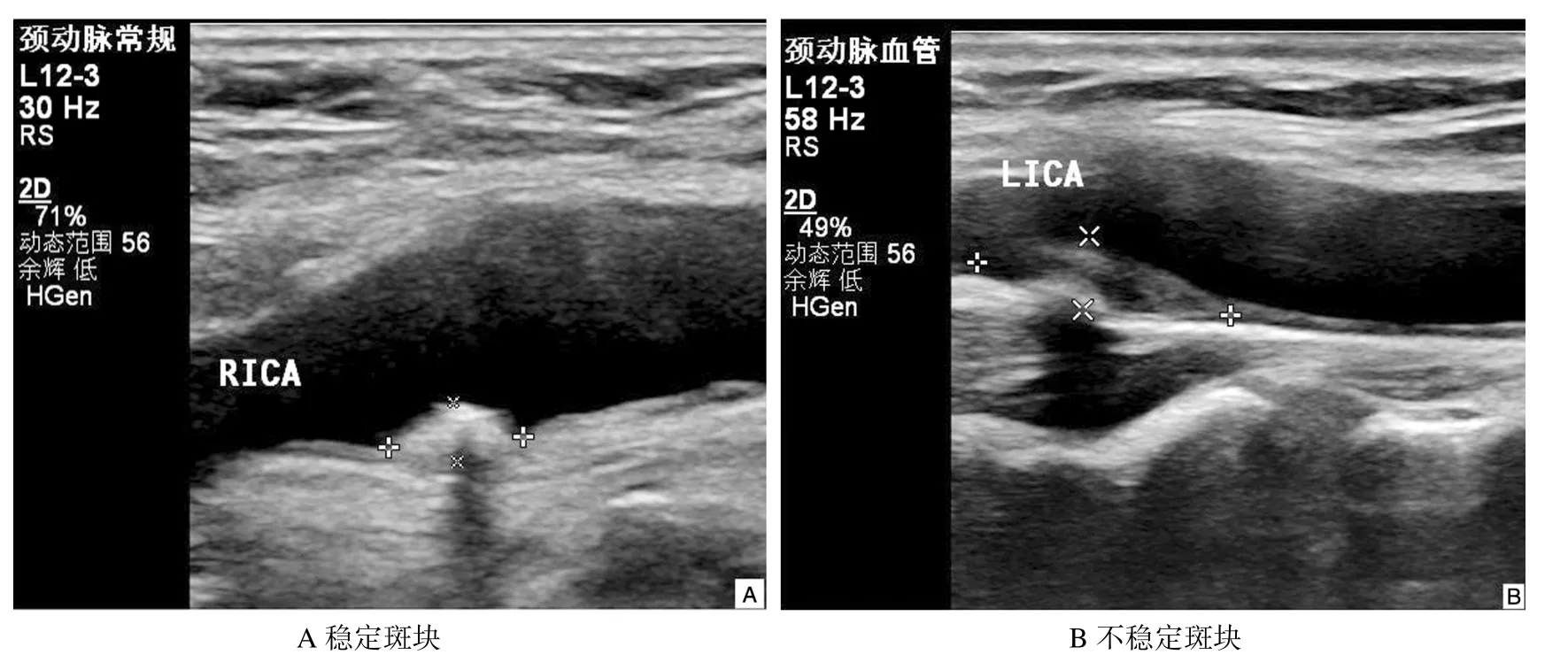
图1 稳定斑块与不稳定斑块超声图
2 组高脂血症史、脑梗死家族史、CRP、斑块积分、IMT 及血清Lp-PLA2 水平差异均有统计学意义,余临床资料差异均无统计学意义(均P>0.05)。见表1。
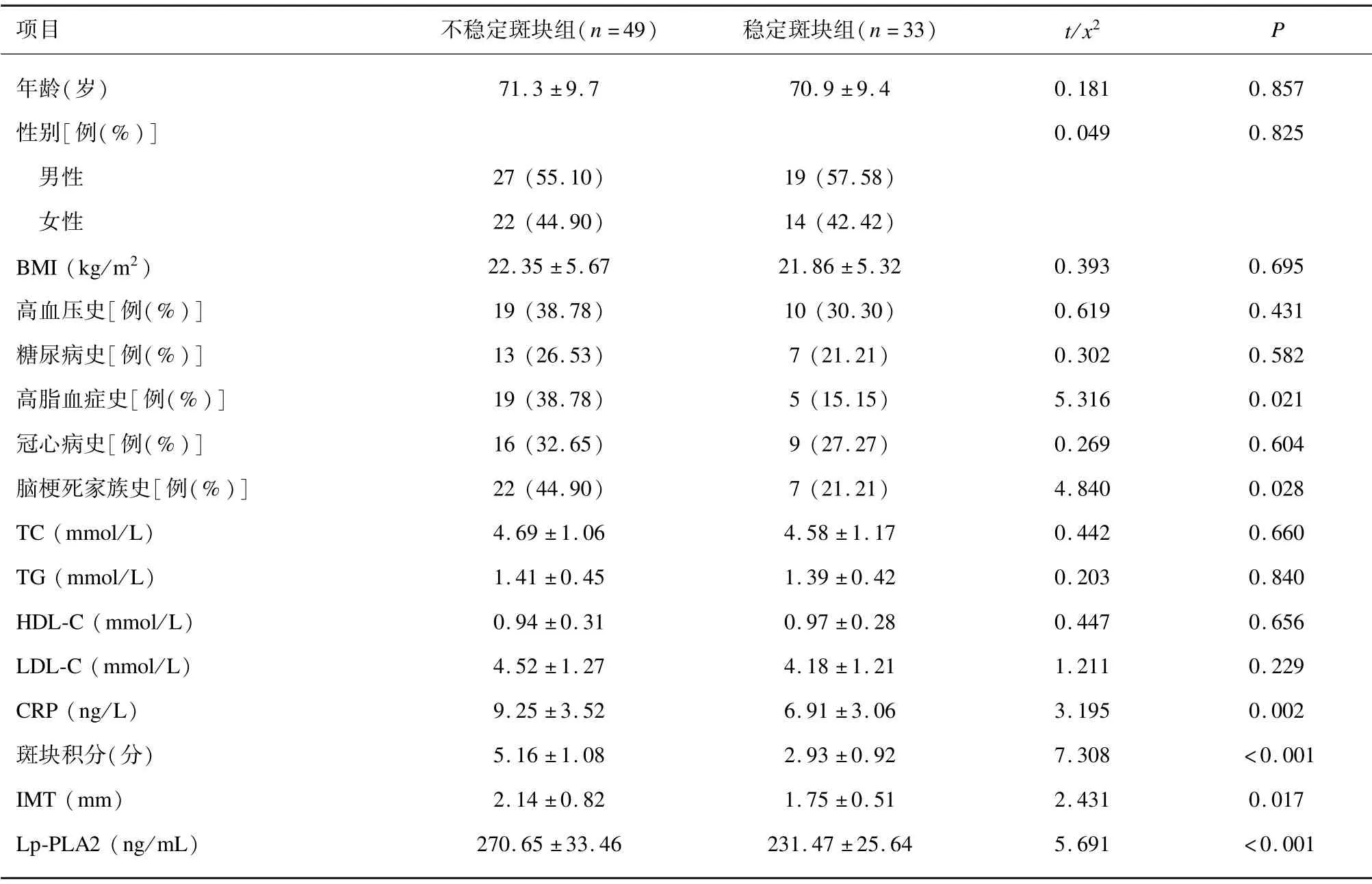
表1 2 组一般资料比较
2.2 斑块稳定性的多因素分析
以斑块稳定性为因变量,以高脂血症、脑梗死家族史、斑块积分、CRP、IMT 及血清Lp-PLA2 为自变量进行Logistic 回归分析。结果显示,斑块积分及血清Lp-PLA2 是老年颈动脉粥样硬化患者斑块稳定性的危险因素。见表2。
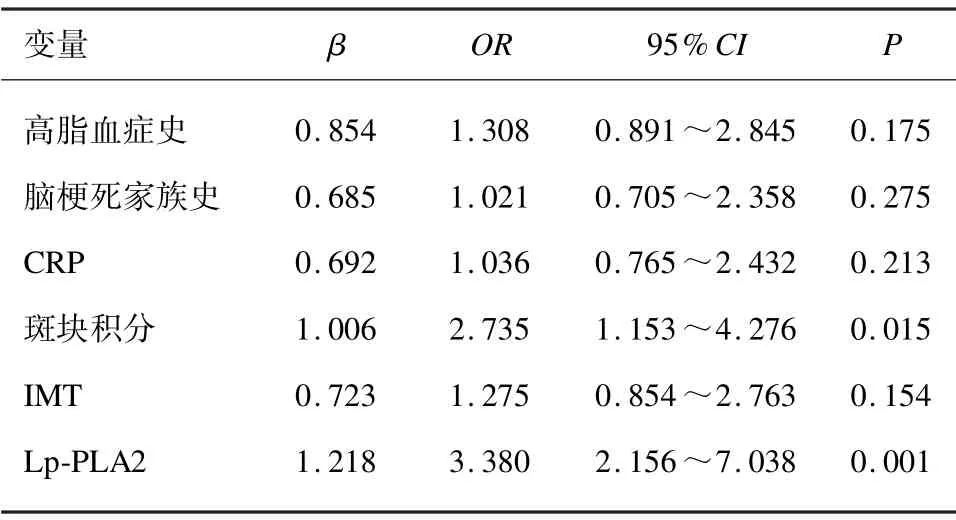
表2 老年颈动脉粥样硬化患者斑块稳定性的多因素分析
2.3 血清Lp-PLA2 对不稳定性斑块的预测价值
ROC 曲线显示,血清Lp-PLA2 对老年颈动脉粥样硬化患者不稳定性斑块进行预测的最佳截断点为251.42 ng/mL,敏感度和特异度分别为83. 67%(41/49)和66.67%(22/33),AUC 为0. 842 (95%CI:0.745 ~0.913)。见图1。
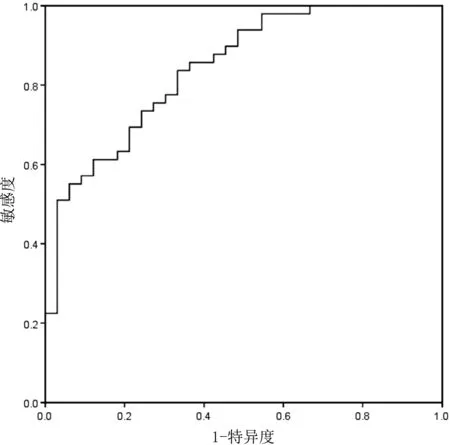
图2 血清Lp-PLA2 对老年颈动脉粥样硬化患者不稳定性斑块预测的ROC 曲线
3 讨论
动脉粥样硬化是引发缺血性脑卒中的重要原因之一[7-9]。研究显示[10],血 清Lp-PLA2 与动脉粥样硬化的发生发展存在一定的相关性。但Lp-PLA2 与颈动脉粥样硬化患者斑块稳定性的关系尚不明确,探讨老年颈动脉粥样硬化患者斑块稳定性与血清Lp-PLA2 的相关性,有助于临床上评估患者斑块的稳定性。
本组82 例老年颈动脉粥样硬化患者59.76%为稳定斑块(49/82),40.24%为不稳定斑块(33/82),与既往Di 等[11]的研究结果接近。与稳定斑块组比较,不稳定斑块组患者高脂血症史和脑梗死家族史占比增多、IMT 增厚,CRP、斑块积分和血清Lp-PLA2 水平升高。进一步研究显示,斑块积分和血清Lp-PLA2 评分是老年颈动脉粥样硬化患者斑块稳定性的危险因素,因此临床上需对上述因素逐一防控。本研究结果与Cao 等[12]的研究结果相符。
斑块积分能在一定程度上反映斑块的性质,积分越高提示斑块越不稳定。斑块的稳定性和斑块破裂等因素均能影响患者的预后[13]。作为新型炎性生物标志物,Lp-PLA2 与血管炎症和脑卒中密切相关,能够诱导单核细胞沉积于血管内膜转变为巨噬细胞,而巨噬细胞凋亡会增加IMT,近而导致动脉粥样硬化斑块和局部血栓形成[14-15]。而根据此次研究,ROC 曲线显示血清Lp-PLA2 预测老年颈动脉粥样硬化患者不稳定性斑块的最佳截断点为251.42 ng/mL,AUC 为0.842,可见血清Lp-PLA2 对老年颈动脉粥样硬化患者不稳定性斑块的预测价值较高。已知血清Lp-PLA2在淋巴细胞和成熟巨噬细胞中合成、分泌,能够与LDL-C 结合促进炎性物质产生,进而作用于动脉粥硬化炎性反应的各阶段,加速斑块形成,引发斑块破裂[16-17]。Lp-PLA2 对斑块稳定性预测的机制可能为:正常情况下LDL-C 不易被氧化,血管壁若发生破裂可能会引起血管内皮细胞通透性增加,从而释放大量氧自由基,将LDL-C 氧化为氧化低密度脂蛋白[18-19],继而聚集于内皮下激活树突细胞和内皮细胞等,引发一系列炎症反应及应激反应。氧化低密度脂蛋白则可通过促使上皮细胞脱落、抑制巨噬细胞游离等过程加速内皮病变,释放Lp-PLA2 等细胞因子,影响斑块稳定性,致使血管斑块破裂[20]。
综上所述,血清Lp-PLA2 对老年颈动脉粥样硬化患者不稳定性斑块的预测价值较高,应定期监测老年颈动脉粥样硬化患者血清Lp-PLA2 水平。研究的不足之处在于病例数较少,今后还需联合多中心、扩大样本量进行深入研究。
