饲料源Cu(Ⅱ)在生物絮团水产养殖系统中的积累及其对氨氧化的影响
2022-03-10刘文畅谭洪新罗国芝万玉美姚妙兰
徐 波,刘文畅,2,谭洪新,2,罗国芝,2,万玉美,3,姚妙兰
(1 上海水产养殖工程技术研究中心(上海海洋大学),上海 201306;2 水产动物良种创制与绿色养殖协同创新中心(上海海洋大学),上海 201306;3 河北农业大学海洋学院,河北秦皇岛 066000)
生物絮团技术(Biofloc Technology,BFT)是基于活性污泥法发展而来的一种水产养殖水处理技术,该技术作为一种环境友好型养殖模式得以快速发展[1-2]。其基本原理是通过调节水体中的碳氮比(C/N),并给予其足够的搅拌强度,细菌主要通过同化作用等生化过程转化水体中的氨氮等物质,控制养殖系统中的氨氮和亚硝酸盐等有害物质[3-4]。近年,重点利用氨氧化等作用的硝化型BFT水产养殖系统逐步成为BFT的主要应用模式之一[5-6]。在BFT水产养殖系统中,溶氧、pH和温度等因素会影响硝化细菌的氨氧化能力[7-8]。
重金属是生态环境方面不可忽视的毒性污染物,对水产养殖环境、水产养殖对象以及水产品消费者都有着相应的影响。一方面,部分重金属是生物体不可或缺的微量元素;另一方面,当其超过生物耐受限度时又会引起生物体中毒反应[9]。为了满足养殖动物对矿物质的营养需求,水产饲料会添加铜(Cu)等重金属物质,并且这些重金属物质会在不换水和少换水的养殖系统中不断积累[10-11]。重金属影响着不同生态系统中硝化细菌的硝化水平[12-14],翁永根等[15]探究了Cu(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ) 3种重金属离子对海水中氨氧化、硝化作用的影响,发现当Cu(Ⅱ)质量浓度大于100 μg/L就会显著地抑制海水条件下硝化细菌的氨氧化功能,并且Cu(Ⅱ)对海水条件的硝化作用产生抑制后,其硝化功能很难得到恢复。而在淡水条件下,重金属对硝化过程的影响研究主要集中在活性污泥废水处理、脱氮除磷反应器等方面,且质量浓度一般较高[16-17]。
为了生物絮团技术更加安全、有效地应用,对生物絮团水产养殖系统中铜积累进行了探索,并研究其对氨氧化的影响。
1 材料和方法
1.1 材料
探究生物絮团水产养殖系统中Cu(Ⅱ)积累部分:所用装置为有效工作体积为200 L的圆柱形塑料养殖桶(直径62 cm,高83 cm),该阶段设置3个平行,3个养殖桶均由1台功率为370 W的旋涡鼓风机提供溶氧和水体混合。试验鱼为同一批次孵化的吉富罗非鱼(GIFTOreochromisniloticus),体质量为(0.53±0.08) g,体质健康,购自广东省广州市猛虎水产有限公司。所用试验饲料为广东省中山市统一企业有限公司生产的罗非鱼饲料,其产品成分为:粗蛋白≥32.0%,粗脂肪≥2.0%,粗纤维≤8.0%,粗灰分≤12.0%,钙≥2.0%,0.6%≤总磷≤3.5%,水分≤12.0%,赖氨酸≥1.4% (数据由厂家提供)。饲料中Cu(Ⅱ)含量为19 μg/g(数据为实际检测结果)。
探究Cu(Ⅱ)对生物絮团氨氧化影响部分:所用装置为有效工作体积为500 mL的透明玻璃锥形瓶,置于恒温摇床(Innova 43R)中进行反应。
1.2 试验设计

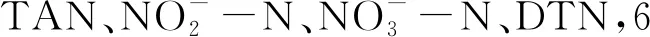
1.3 测定指标和方法
水中溶解性Cu(Ⅱ)用原子吸收光谱仪(pinaacie 900T)测定。生物絮团中的Cu(Ⅱ)测定时将絮体收集后65℃烘箱烘干、研磨、100目筛网过筛,然后称取0.1 g置于消解管中,并一次性加入3 mL HCl、1 mL HNO3、1 mL HF(3种酸均为优级纯,质量浓度分别为:36%~38%、65%~68%、45%~48%),再将消解管置于无线遥控智能消解仪(Labotery XJS36-42W)中按照下述消解程序消解:15 min之内升温到120℃,保持120 min,并每30 min轻微震荡一次,冷却至室温。最后将消解后的样品稀释一定倍数后用原子吸收光谱仪测定。絮团中Cu(Ⅱ)含量按(1)式计算:
(1)
式中:ω为絮团中Cu(Ⅱ)含量,μg/g;ρ为絮团烘干消解定容稀释后测定质量浓度,μg/L;n为稀释倍数;V为消解后的溶液体积,L;m为絮团消解所取质量,g。
(2)
式中:R为氨氮氧化速率,mg/(L·h);Ai表示TAN初始质量浓度,mg/L;At表示TAN终末质量浓度,mg/L;t表示反应时间,h。
1.4 数据分析
试验数据采用Excel软件进行结果统计,由Origin软件进行相关图表的绘制。试验数值用平均值±标准差(X±SD)形式表示,采用SPSS 19.0统计软件对数据进行配对T检验或单因素方差分析显著性,P<0.05为差异性显著。
2 结果与讨论
2.1 生物絮团对水质的控制
生物絮团养殖系统水质情况如图1所示。
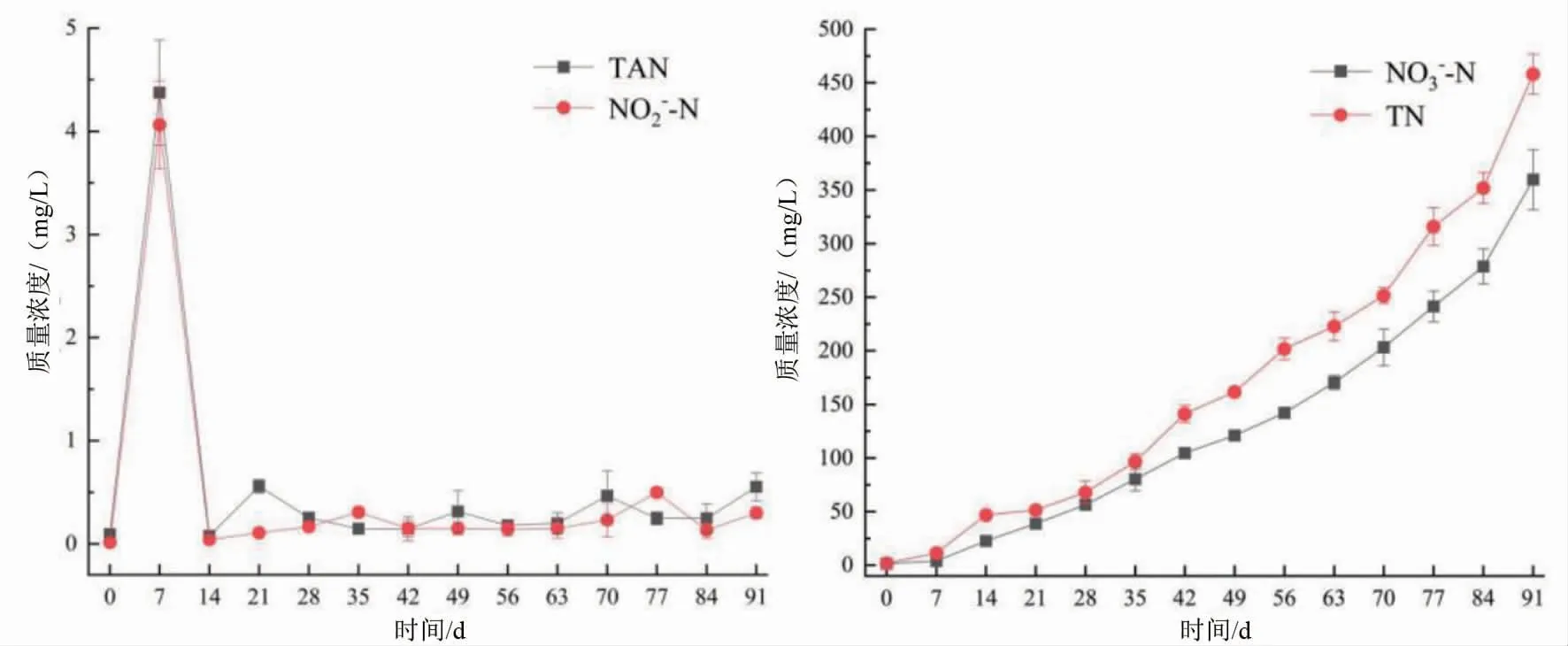
图1 养殖系统水质的动态变化
2.2 生物絮团水产养殖系统中Cu(Ⅱ)的积累
本试验养殖持续91 d,养殖系统絮团中Cu(Ⅱ)含量初始值和终末值分别是(160.67±7.33) μg/g和(156.17±4.12) μg/g,采用配对样本T检验对养殖前后系统中絮团的Cu(Ⅱ)含量进行分析,结果显示养殖前后絮团中Cu(Ⅱ)含量无显著性差异(P>0.05)。絮团中的Cu(Ⅱ)含量取决于系统中流入Cu(Ⅱ)的总量、絮团对Cu(Ⅱ)的吸收能力以及系统的总悬浮固体颗粒物(Total suspended solids,TSS),从絮团的长期使用和重复使用考虑,随着流入Cu(Ⅱ)的不断增加,由于絮团对Cu(Ⅱ)吸收能力的限制,以及系统TSS水平,絮团中Cu(Ⅱ)含量未增加,但是水体中作为絮团的TSS增加了。
图2是生物絮团养殖系统养殖期间水中溶解性Cu(Ⅱ)含量和系统TSS的变化情况。生物絮团养殖系统中水中溶解性Cu(Ⅱ)含量持续积累,在试验结束时已经达到(18.34±0.77) μg/L,未出现峰值,TSS的变化趋势可以看出,在生物絮团养殖系统中,通过投喂等方式流入系统的Cu(Ⅱ)主要是通过系统中溶解性Cu(Ⅱ)的积累和系统TSS的持续增长得以容纳。
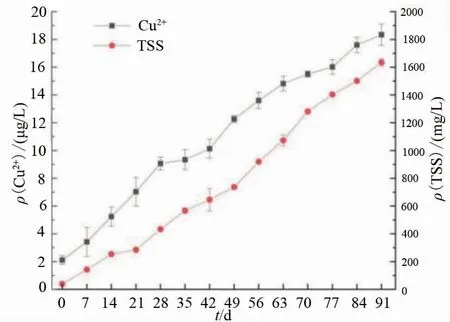
图2 养殖期间溶解性Cu(Ⅱ)质量浓度和系统TSS动态变化
研究表明,水产动物呼吸作用、摄食行为以及水体的渗透交换作用都会吸收水体中的重金属[22]。同时,在生物絮团系统中,养殖对象会直接对絮团进行摄食[23]。
而本试验中水中溶解性Cu(Ⅱ)质量浓度在养殖第42天便高于10 μg/g,并在此后的养殖过程仍不断积累,南旭阳[24]的研究发现,当水体中Cu(Ⅱ)质量浓度为12 μg/g及以上时,在水体中生存8 d以上鲫鱼的红细胞和血红蛋白量均急骤下降,显著地影响了鲫鱼的代谢功能,其影响程度有较为明显的剂量效应和时间效应。同时,GB 11607—89《渔业水质标准》[25]中要求为ρCu(Ⅱ)≤10 μg/g,水产动物长期生存在该条件的水体,有Cu(Ⅱ)在体内高度富集的风险,而Cu(Ⅱ)不仅危害水产动物自身的相关生理机能,同时从食品安全的角度出发,对人体健康也构成了相应的风险[26-27]。
2.3 Cu(Ⅱ)对生物絮团氨氧化的影响
图3、图4是Cu(Ⅱ)对生物絮团氨氧化影响的氮转化情况。
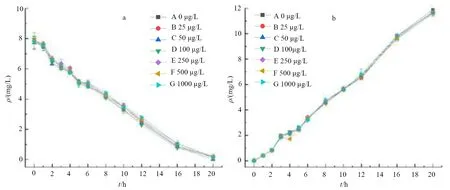
图3 氨氧化反应TAN(a)和含量变化
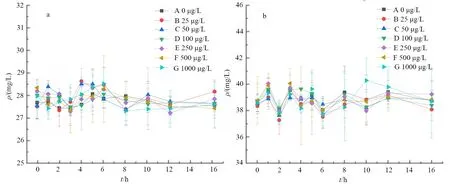
图4 氨氧化反应和TAN(b)含量变化
表1是氨氧化速率和氨氮去除率。在加入反应物NH4Cl后,各组TAN均逐步降低,前4 h氨氧化速率均高于0.44 mg/(L·h)。反应20 h后,各组氨氮均降至0.2 mg/L以下,氨氮去除率均高于97%。各组在氨氧化速率和TAN转化水平均无显著性差异(P>0.05)。

表1 氨氧化速率和氨氮去除率
重金属可以显著地对细菌产生毒性作用,其毒性可以使细菌的酶蛋白活性大幅降低从而使细菌失活[28],Cu(Ⅱ)对氨氧化的影响其实质是其对氨氧化细菌的毒性作用[29],王瑶[30]也认为Cu(Ⅱ)会影响微生物的新陈代谢,进而对氨氮的去除率产生一定的抑制作用。本试验中的Cu(Ⅱ)质量浓度在1 000 μg/g条件下对絮团作用了20 h,没有显著抑制絮团的氨氧化功能,这可能是由于作用时间较短的缘故,而利用生物絮团进行水产养殖是个长期活动,所以存在Cu(Ⅱ)对絮团氨氧化能力产生抑制的潜在风险,这样就会在一定程度上降低BFT的优势。
3 结论
在生物絮团水产养殖系统中,通过饲料输入养殖系统中的Cu(Ⅱ)主要以水体中溶解性Cu(Ⅱ)的积累和TSS增长的方式所容纳。溶解性Cu(Ⅱ)随着养殖时间的延长而不断积累,可在养殖的第42天达到10 μg/g以上,高于渔业水质标准。但是,絮团中Cu(Ⅱ)含量在短期养殖前后没有显著性差异。在硝化型生物絮团养殖系统中,即使系统中的Cu(Ⅱ)达到1 000 μg/g,也不会对氨氧化效果产生显著影响。
□
