中药基于PPARγ抗炎防治动脉粥样硬化的研究进展
2022-03-09张晓璐南亚昀姜希娟曾文赟张悦王双翠张文澜王一婧
张晓璐 南亚昀 姜希娟 曾文赟 张悦 王双翠 张文澜 王一婧
(1天津中医药大学中西医结合学院,天津 301617;2宁夏回族自治区人民医院宁夏老年疾病临床医学研究中心;3天津中医药大学护理学院)
2016年,心血管病死亡率仍居高不下,农村和城市心血管病死亡占全部死因的比率分别为45.50%和43.16%〔1〕。心血管疾病的主要病理基础是动脉粥样硬化(AS),其基本病变为动脉内膜脂质沉积、平滑肌增殖迁移、纤维斑块和粥样斑块形成。后期的斑块结构复杂、易损,斑块破裂继发血栓形成,易引起急性临床事件,甚至危及生命。AS发病机制复杂,涉及脂质浸润学说、内皮损伤学说、炎症反应学说及血栓形成学说等,其中慢性炎症被认为贯穿于AS始终。近期大量研究表明,过氧化物酶体增殖物激活受体(PPAR)γ可通过抑制炎症反应、改善内皮功能、调控平滑肌增殖和迁移、促进胆固醇逆向运转等多靶点发挥抗AS作用〔2,3〕,尤其对炎症反应发挥了广泛的调节作用,被认为是调控炎症反应的关键点。中草药是不良反应较小的活性天然产物,具有广泛生理功能并且能够通过多种信号通路综合效应系统治疗疾病,是抗AS理想后备药物〔4〕。近10年来,在对中药不断深入的研究中发现多种中药复方及其单体可作为PPARγ激动剂,发挥抗炎效应从而防治AS。本文对中药基于PPARγ抗炎防治AS的研究进展进行综述。
1 炎症在AS中的作用
AS被广泛认为是由低密度脂蛋白(LDL)在血管内沉积、氧化进而引发的慢性炎症性疾病。在AS发生发展中,血管局部炎症反应及相关炎症因子的释放发挥关键作用〔5,6〕。AS血管病变特征是局部有大量单核细胞募集、迁移并分化为巨噬细胞。巨噬细胞不断吞噬氧化型(ox)-LDL从而使脂肪细胞变成泡沫细胞,并释放炎症因子,促进淋巴细胞斑块内聚集。此外,AS的进一步加重还与M1型巨噬细胞和泡沫细胞等炎细胞的聚集及促炎因子,如白细胞介素(IL)-17A、肿瘤坏死因子(TNF)-α、IL-6、单核细胞趋化蛋白(MCP)-1和活性氧的产生等有密切联系〔7〕。IL-17A可通过促进单核/巨噬细胞、中性粒细胞募集到主动脉壁从而发挥促AS炎症的作用〔8〕。此外,张程美等〔9〕研究结果显示ox-LDL介导的单核巨噬细胞(THP)-1能提高M1型巨噬细胞重要标志性炎症因子,如IL-6、TNF-α、IL-1β的 mRNA表达水平。因此,可通过抑制ox-LDL的产生减弱M1型巨噬细胞释放促炎因子或促进M1型向M2型巨噬细胞转变,进而发挥抗炎功能,减慢AS慢性炎症发展过程并延缓脂质斑块形成时间。由此可见,炎症反应在脂质斑块的形成和进展中起着中心作用。
2 PPARγ的抗炎、防治AS作用
PPARγ是核激素受体家族中的配体激活受体,有PPARγ1、PPARγ2、PPARγ3和PPARγ4 4种亚型。PPARγ3、PPARγ4与PPARγ1编码的蛋白相同,在内皮细胞、血管平滑肌细胞、巨噬细胞及心肌细胞中广泛表达,而PPARγ2则在脂肪细胞中广泛存在〔10,11〕。PPARγ与配体结合后可同时调节炎性反应和脂质代谢,是连接炎症和脂质代谢的关键分子,在各种炎症基因的RNA聚合酶结合位点与其他核转录因子发生交联反应,进而调节炎症反应。有研究证实〔12〕,PPARγ通过抑制炎症反应、促进血管内皮功能、调控平滑肌增殖和迁移及促进胆固醇逆转等,发挥稳定AS斑块的作用。研究表明〔13〕,在AS早期和晚期,PPARγ在淋巴细胞、单核细胞分化的巨噬细胞及巨噬细胞源性泡沫细胞中均低表达〔13〕。在AS早期阶段,PPARγ被激活后,IL-1β、TNF-α介导的血凝素样氧化LDL受体(LOX)-1表达降低及单核细胞的黏附聚集减少,从而抑制炎症反应。在巨噬细胞中,特异性敲除PPARγ后,大量炎症基因表达以致加重炎症反应〔14〕。Liu等〔15〕研究证实,高脂饮食诱导大鼠糖尿病模型中,PPARγ抑制剂GW9662进行干预后,大鼠主动脉TNF-α、IL-1β和IL-6的蛋白表达量明显升高,表明PPARγ具有明确的抗炎作用。
3 PPARγ通过多通路发挥抗炎作用
在炎症反应中,PPARγ可通过抑制炎症信号传导途径和炎症因子的产生而达到抗炎作用。相关炎症信号通路包括核因子(NF)-κB信号通路、蛋白酪氨酸激酶(JAK)-信号转导和转录激活因子(STAT)信号通路和激活蛋白酶(AP)-1信号通路等(图1)。 其中,NF-κB和JAK-STAT信号通路介导的炎症反应可诱导大量炎症因子如TNF-α、IL-6和IL-8释放〔16〕,在AS斑块发展中起促进作用。
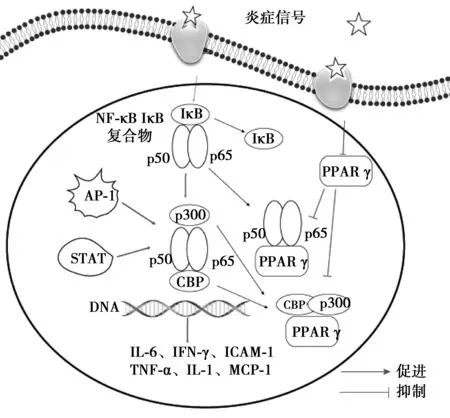
图1 炎症信号转导通路
3.1PPARγ-NF-κB信号通路 NF-κB包含p50和p65 2个亚基。在静息状态下,NF-κB与抑制蛋白单体IκB结合,以非活性的异二聚体形式存在于细胞质中;在炎症信号刺激下,NF-κB p50/p65异源二聚体与IκB解离,p50/p65转位入核并与协同活化因子p300和环磷腺苷效应元件结合蛋白(CREB)的结合蛋白(CBP)结合,进而与靶基因上的特定κB序列结合,激活下游IL-1β、TNF-α、IL-6等靶基因的转录〔17,18〕。近期研究发现,PPARγ是NF-κB的上游调控信号,可抑制NF-κB介导的炎症反应〔19〕。PPARγ激活后可直接与二聚体p65/p50结合,形成转录抑制复合物,抑制NF-κB信号传导及DNA合成〔20〕,降低IL-1β、TNF-α等炎症因子的表达,抑制血管炎症反应。PPARγ可通过竞争结合p300和CBP而抑制NF-κB的转录〔21〕。此外,PPARγ还可通过调控NF-κB信号通路,抑制基质金属蛋白酶和黏附分子等炎症因子表达从而防治AS〔22〕。
3.2PPARγ-JAK-STAT信号通路 JAK-1通过交互自身磷酸化激活,继而JAK-1分别激活STAT1和 STAT2。STAT1形成同源二聚体后与协同活化因子CBP或p300结合,在细胞核内可形成炎症信号通路,从而调控下游细胞间黏附分子(ICAM)-1等炎症因子表达〔23〕。有研究表明,ICAM-1是内皮活化的表面标志物,在促炎症反应过程中起关键作用,其表达与AS发生发展有密切关系〔17〕。当PPARγ与配体结合并被激活后,PPARγ-类视黄醇X受体(RXR)异二聚体可与STAT1竞争性结合CBP及p300,从而使STAT1的活化受阻,抑制ICAM-1、IL-1β、IL-6、TNF-α,干扰素(IFN)-γ等促炎因子的合成与释放。此外,相关研究表明IFN-γ高表达可活化JAK-STAT通路,并诱导TNF-α分泌。PPARγ通过抑制JAK-STAT通路,阻断IFN-γ的表达,切断恶性循环,从而抑制炎症反应〔20〕。
3.3PPARγ-AP-1信号通路 AP-1是一种核转录因子。在炎症反应中,AP-1可促进细胞因子和黏附因子等炎症因子的合成。PPARγ可通过与AP-1竞争结合协同活化因子CBP和p300,抑制AP-1信号通路,这一过程与PPARγ-JAK-STAT炎症信号转导通路相似〔24〕。研究发现,TNF-α可激活AP-1并产生一系列炎症因子,而PPARγ的抑制剂GW6471则可逆转这一作用〔25〕,提示PPARγ可通过抑制AP-1信号通路减少炎症因子表达,从而达到抗炎、抗AS的作用。
4 PPARγ的中医药干预
传统中医并无AS之名,其属于“真心痛”“心悸”“胸痹”“眩晕”“中风”等范畴。因此该病为本虚标实之证,以脾肾亏虚为本,痰瘀毒互结为标。益气活血、清热解毒为其主要治则。现代医学的抗炎与传统医学的清热解毒殊途同归。许多学者对大量中药进行研究,以探讨PPARγ通过抗炎作用达到抗AS的作用〔26〕,中药有许多活性成分、单体及中药复方汤剂能够激活或上调各种组织的PPARγ基因表达,从而抑制免疫炎症反应。通过中药对PPARγ信号传导通路的作用达到抗AS的作用机制取得了较大进展。本文将近10年基于PPARγ靶标改善炎症的中药单体或复方等进行总结(图2)。发现中药复方及其单体干预的动物模型主要集中于ApoE-/-小鼠AS模型、糖尿病动物模型和泡沫细胞和脂肪细胞等细胞模型;干预靶点主要集中于PPARγ及与之相关的NF-κB、TNF-α、IL-6,此外还包括MCP-1、ATP结合盒转运体(ABC)A1、肝X受体(LXR)α、脂联素、IL-1、IL-1β、IL-2、腺苷酸激活蛋激酶(AMPK)等。
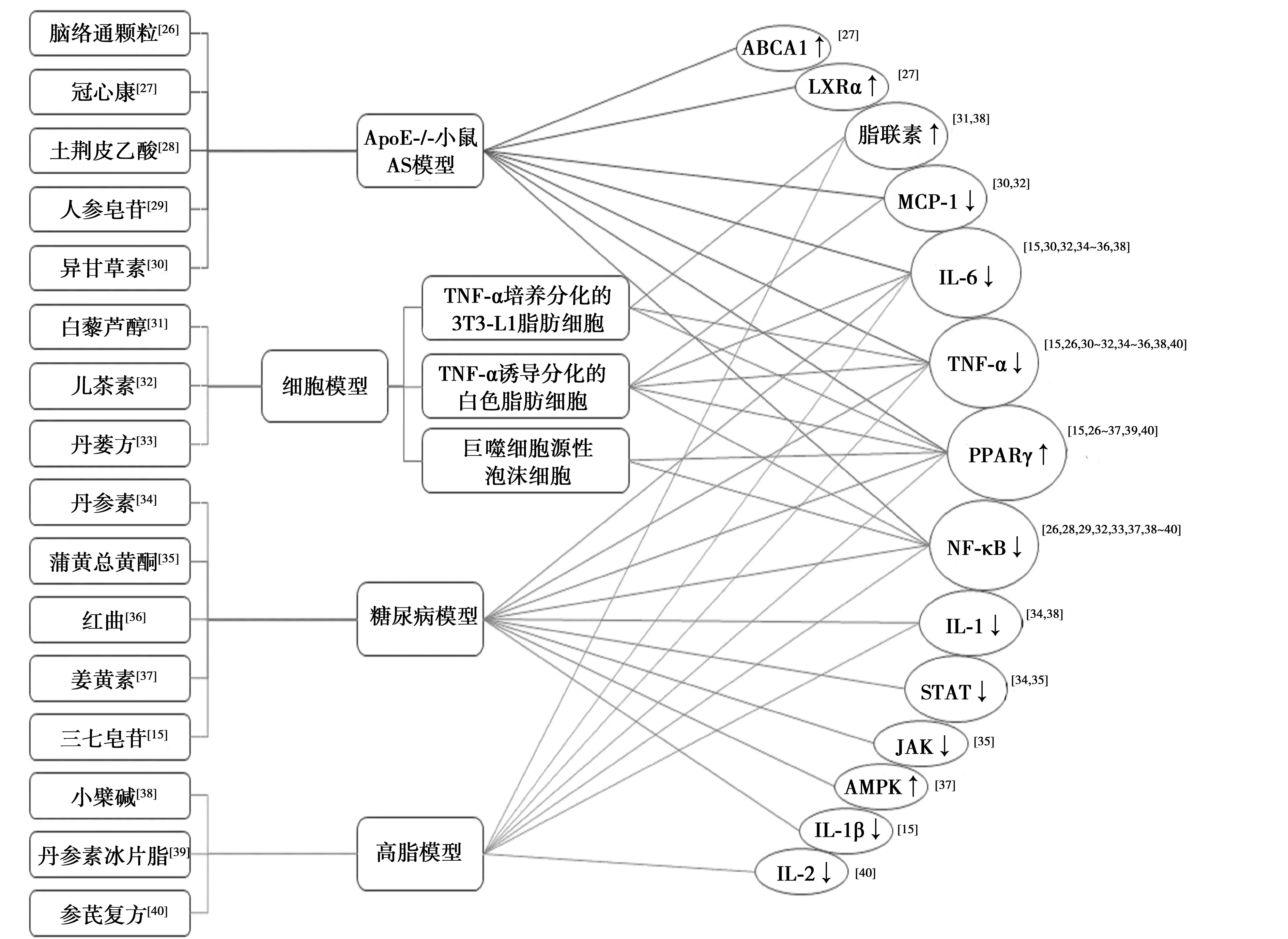
图2 中药单体/复方基于PPARγ靶标改善炎症、抗AS的模型及靶点
综上,AS发病机制复杂,其致病因素尚不明确。通过对其多水平、多层次研究的梳理,发现可通过上调PPARγ的表达,调控NF-κB、JAK-STAT及AP-1等相应炎症信号通路,进而干预多种促炎因子,如TNF-α、IL-6和IL-8等的基因表达,控制炎症反应程度,发挥抗AS作用。基于PPARγ发现抗AS的理想药物,还需将目前相关研究进一步细化和深入研究。
