胃癌病人化疗所致恶心呕吐危险因素分析及列线图预测模型构建
2022-03-09黄桂玲刘燕珍
黄桂玲,林 慧,刘燕珍
世界范围内胃癌发病率在所有恶性肿瘤中位居第5位,死亡率位居第3位[1]。随着分子靶向治疗、免疫治疗快速发展,胃癌的综合治疗水平取得重大进步,但化疗仍是主要的治疗方法[2]。化疗所致恶心呕吐(chemotherapy-induced nausea and vomiting,CINV)是化疗过程中最令人痛苦和担忧的副作用之一,导致食欲缺乏、体重减轻、社交活动减少,对病人的生活质量造成严重负面影响,甚至引起脱水和死亡等严重后果;同时使得病人延迟给药、剂量减少、中止化疗,从而降低抗肿瘤的疗效[3-4]。日本临床肿瘤学会(Japan Society of Clinical Oncology,JSCO)、美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)根据化疗药物催吐风险分为高度、中度、低度和轻微4个等级,并推荐使用相应的止吐药物。然而,即使严格按照指南进行预防,但高达40%~70%的化疗病人未能完全控制恶心呕吐[5-6]。本研究评估在标准的止吐方案下胃癌化疗病人CINV发生率和风险因素,建立可靠的列线图预测模型,为临床医护人员对预防CINV的决策提供重要借鉴。
1 资料与方法
1.1 一般资料 选取2019年4月—2020年12月福建省肿瘤医院的189例胃癌病人作为研究对象。纳入标准:①明确诊断为胃腺癌;②采用Folfox方案(奥沙利铂+5-氟尿嘧啶)或TF化疗方案(紫杉醇类+5-氟尿嘧啶);③所有病人按照JSCO、NCCN制定的指南使用止吐药物;④预计生存时间>3个月。排除标准:①肠梗阻;②既往腹部放疗史;③精神障碍;④使用阿片类药物等致吐药物。
1.2 CINV的防护措施 ①健康宣教:入院时向病人解释化疗的目的及CINV等相关副作用,使病人掌握相关知识并做好心理准备。②心理辅导:入院时常规评估心理状况,对出现的抑郁、焦虑症状等心理问题进行疏导。③药物治疗:化疗药物给药后24 h出现恶心呕吐称为急性CINV,24 h到5 d出现称为“延迟性CINV”[7]。本研究中的胃癌化疗药物均属于中度呕吐风险,根据JSCO和NCCN指南[8-9]的建议,急性期使用地塞米松联合5-羟色胺受体拮抗剂,延迟期使用地塞米松单一治疗。④生活指导:培养良好的作息时间,劳逸结合,避免过度劳累;戒烟限酒,清淡饮食,鼓励多摄入新鲜蔬菜、水果[10]。
1.3 CINV资料收集方式 恶心表现为上腹部不适、紧迫欲吐的主观感觉。呕吐是胃内容物通过口腔排出的客观事实。化疗前发放表格,要求病人根据自身出现恶心呕吐的时间及次数进行记录。从化疗当天开始记录,连续5 d。住院期间由责任护士每日查看表格并询问病人再次确认。添加病人微信,病人出院后继续记录恶心呕吐的数据,通过微信将记录内容发送研究人员。
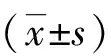
2 结果
2.1 CINV的危险因素分析 共有37.6 %(71/189)病人出现CINV。Logistic单因素分析表明,CINV与婚姻状况、职业、吸烟史、体质指数(BMI)、既往CINV病史、高血压、糖尿病、贫血、低白蛋白血症、手术治疗、肿瘤分期、合用靶向药物以及化疗方案无关(P>0.05),与年龄、性别、饮酒史、晕动症史、化疗次数有关(P<0.05)。见表1。将单因素分析中有统计学意义的因素纳入多因素分析。多因素分析表明年龄、性别、饮酒史、晕动症史、化疗次数是CINV的独立危险因素(P<0.05)。见表2。
(续表)
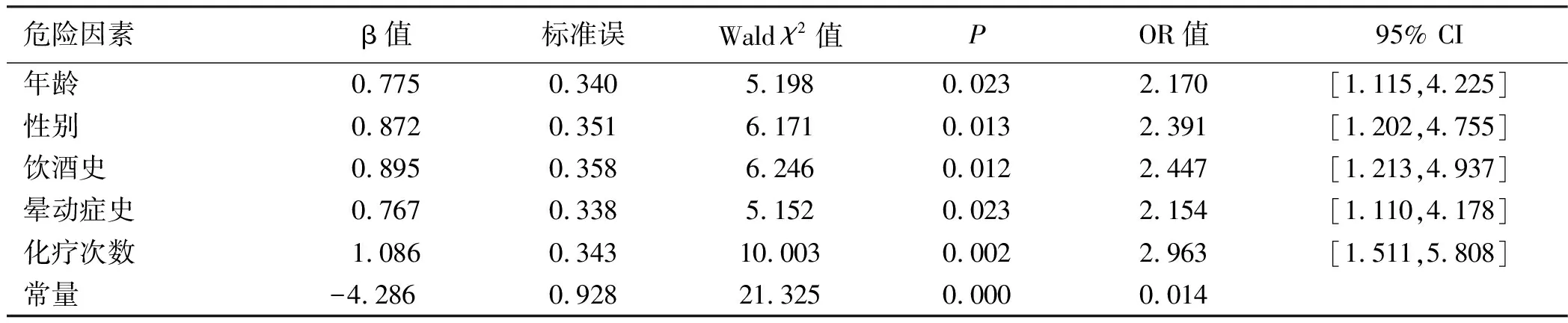
表2 影响胃癌化疗病人CINV的多因素分析
2.2 CINV列线图风险模型的建立 将年龄、性别、饮酒史、晕动症史、化疗次数的独立危险因素构建列线图风险模型(见图1),计算模型的C指数为0.776(95% CI[0.704,0.849]),绘制ROC曲线下面积为0.759(95% CI[0.688,0.830]),敏感度为68.6%,特异度为69.0%,见图2。Hosmer-Lemeshow 检验结果显示χ2=1.734,P=0.988。使用Bootstrap进行内部验证,B=1000进行重复抽样,结果显示预测模型与实际情况一致性较好,见图3。
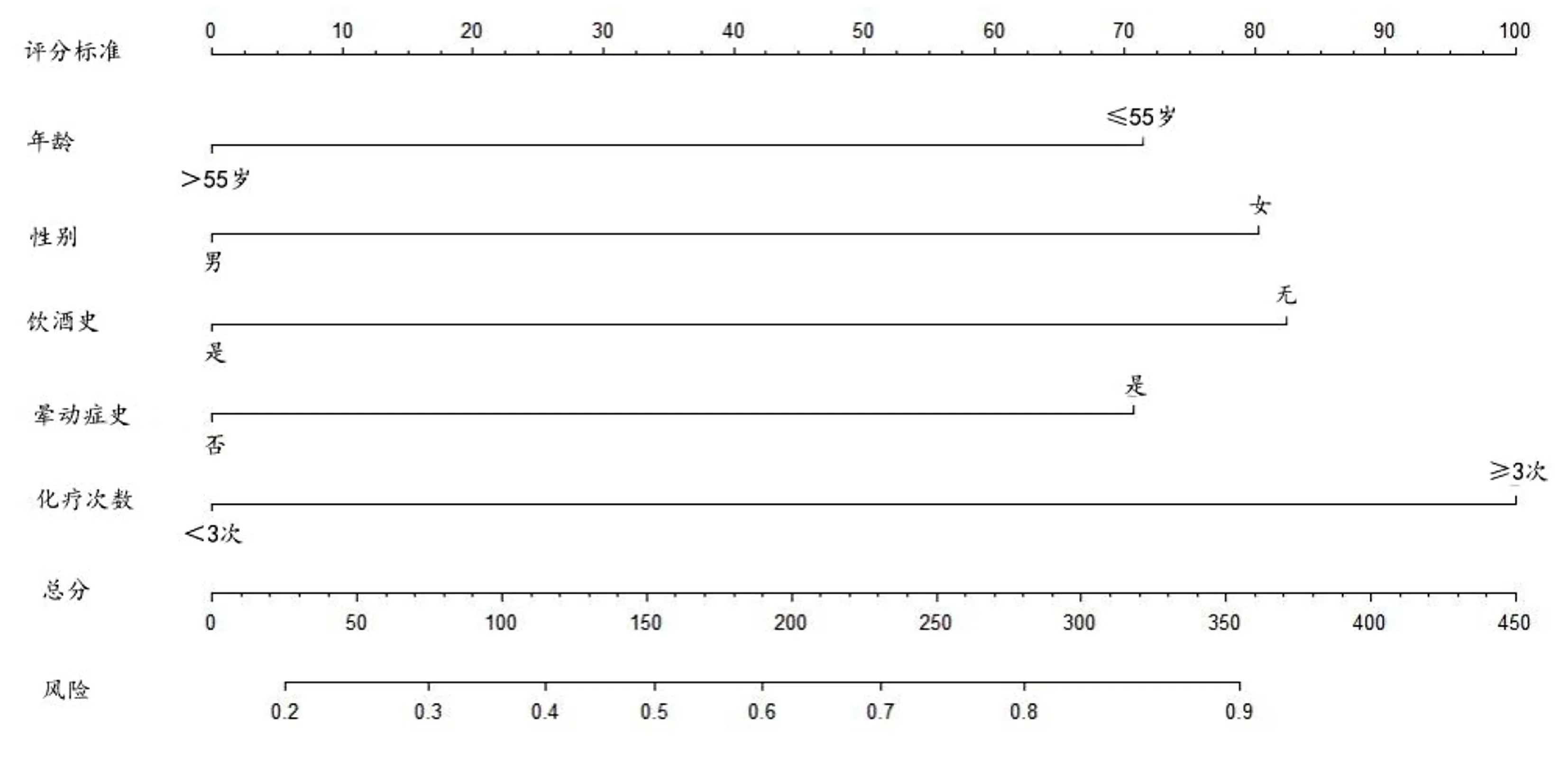
图1 胃癌化疗病人CINV列线图风险模型
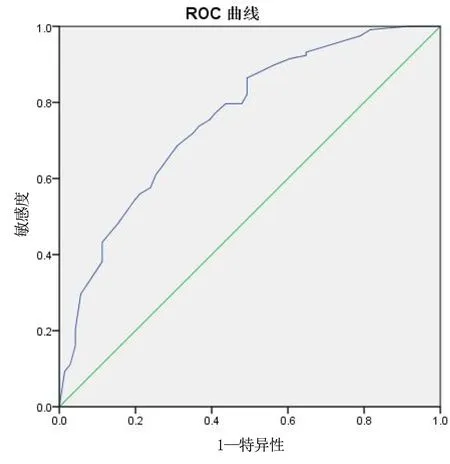
图2 列线图模型的ROC曲线验证
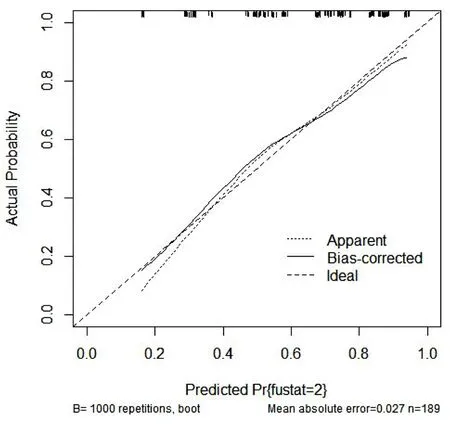
图3 列线图模型的校准曲线验证
3 讨论
CINV的发生机制非常复杂,涉及多个递质和受体[11]。在过去10年,预防性止吐药物(如5-羟色胺拮抗剂和NK-1拮抗剂等)取得重大进展,CINV的预防策略已发生革命性的进步。基于指南的止吐药物可预防多数病人的CINV,但仍有部分病人无法缓解[12]。本研究中胃癌化疗药物均属于中度呕吐风险,使用地塞米松联合5-羟色胺受体拮抗剂后CINV的发生率仍高达37.6%。NCCN指南对高度呕吐风险的病人推荐在中度呕吐风险止吐药物基础上加用神经激肽1受体拮抗剂[8]。CINV管理的重点在于预防,由于神经激肽1受体拮抗剂费用昂贵,需要预测胃癌化疗病人出现CINV的风险,对高危人群选择性加强使用神经激肽1受体拮抗剂进行管理。
先前已有研究证实多个因素与CINV有关[13],本研究绘制列线图具有直观简洁、可视便捷的优点,有利于为临床医师提供简便、快捷的预测工具。本研究使用Bootstrap自抽法对CINV高危因素建立的列线图预测模型进行内部验证,C指数为0.776(95% CI[0.704,0.849]),表明区分度良好。校准曲线结果显示预测模型与实际观测结果一致性较好,表明模型具有预测效能准确。Hosmer-Lemeshow检验结果显示χ2=1.734,P=0.988,表明拟合优度良好。绘制ROC曲线下面积为0.759(95% CI[0.688,0.830]),也证实列线图的有效性。
本研究中年轻病人比高龄病人更容易出现CINV。原因考虑为恶性肿瘤对人体是重大创伤源,年轻病人社会阅历浅,心理承受能力弱,更容易出现伤感、沮丧、好哭泣、焦虑、恐惧等情感障碍,躯体上表现为食欲减退、恶心呕吐等症状。多项研究证实,年轻病人出现CINV的风险更高[14-17]。本研究中女性出现CINV的风险高于男性。有研究将17项研究进行荟萃分析表明女性出现CINV的发生率是男性2.79倍(95% CI [2.26,3.44])[14]。化疗药物对卵巢功能造成严重不良影响,引起卵巢功能减退、早衰、药物性闭经,使体内雌激素水平严重下降,内分泌功能紊乱,加重病人恶心呕吐的症状[18]。本研究中有饮酒史病人CINV的发生率比未饮酒病人更低。人体摄入乙醇后消化道直接吸收乙醇,运输到肝脏中分解,乙醇刺激大脑的呕吐中枢。长期饮酒后大脑对外界的刺激形成耐受,对包括化疗药物在内的应激源不易形成呕吐反射。化疗药物无差别抑制快速分裂的癌细胞和正常细胞,造成消化道黏膜损伤、肝功能受损等副作用。化疗期间饮酒进一步损害胃肠道黏膜,同时乙醇需要在肝脏内代谢,对肝脏造成极大负担。因此,即使饮酒史是CINV的保护因素,但整个化疗期间仍需限制乙醇的摄入。本研究中有晕动症史是CINV的独立危险因素。有研究通过多中心、前瞻性、观察性研究分析190例接受中度呕吐风险的化疗药物病人发现晕动史是CINV的显著独立危险因素(OR:3.89,95% CI[1.49,10.19])[19]。晕动症病人容易受外界的摇摆、颠簸、加速运动等刺激出现恶心呕吐。因此,晕动症病人也容易受到化疗药物的影响。化疗次数>3次的病人出现CINV是化疗次数≤3次的2.963倍。化疗药物属于剂量限制性毒性,药物的毒副作用随着剂量的增多而蓄积体内。
本研究不足之处:①单中心研究且病例相对较少,可能存在选择偏差;②未进行外部验证,特别是由不同研究中心进行验证。
总之,即使在标准止吐方案下胃癌化疗病人中CINV的发生率高且严重影响病人的生活质量。年龄、性别、饮酒史、晕动症史、化疗次数是CINV的独立危险因素,所构建的列线图风险模型具有良好的可靠性和准确性,为临床医护人员给病人提供个体化、精准的治疗提供重要的参考。
