茎瘤芥异戊烯基转移酶家族基因全基因组鉴定及表达分析
2022-03-09蔡兆明程春红廖静静王殿东
蔡兆明,程春红,廖静静,王殿东
(长江师范学院 生命科学与技术学院, 重庆 408100)
细胞分裂素是一种重要的植物激素,可调控植物细胞分裂、蛋白合成、愈伤组织形成、分枝数目、响应逆境胁迫等多个过程[1-5],同时细胞分裂素在提高植物产量和结实率方面具有很大潜力[6-8]。异戊烯基转移酶(isopentenyl transferases,IPT)是合成细胞分裂素的关键限速酶,可分为两类,一类以ATP/ADP为底物催化产生异戊烯基腺嘌呤(isopentenyladenine,iP)和反式玉米素(trans-zeatin),另一类以tRNA为底物合成顺式玉米素(cis-zeatin)[9]。在拟南芥中,共鉴定到9个AtIPT蛋白,其中AtIPT1和AtIPT3-8以ATP/ADP为原料合成细胞分裂素,AtIPT2和AtIPT9则以tRNA为原料合成细胞分裂素[10]。IPT基因在调控植物生长发育和抵御逆境胁迫过程中具有重要功能。在小麦中异源过表达来源于根癌农杆菌(Agrobacteriumtumefaciens)的IPT基因后,可显著减少干旱胁迫造成的产量损失[11],而将该基因在烟草中过表达后,转基因植株则表现为叶片衰老延缓的表型[12]。
目前,已在多个物种中克隆出了IPT基因,如在北沙参(Glehnialittoralis)中,GlIPT1基因被克隆并发现该基因在花中表达水平很高[13]。在杭菊(Chrysanthemummorifolium)中,CmIPT1被克隆出来并发现过表达该基因可增加拟南芥的分枝[14]。在苜蓿(Medicagotruncatula)中,有21个IPT基因被鉴定出来,并发现MtIPT3可能参与根瘤数目调控过程[15]。在与苜蓿同为豆科植物的大豆(Glycinmax)中,有17个IPT基因被鉴定出来,并发现GmIPT3和GmIPT15参与对土壤氮元素的响应[16]。这些研究为后续解析IPT基因在不同物种中的功能奠定了基础。
茎瘤芥(Brassicajunceavar.tumida)是重庆地区主栽的经济作物之一,其茎部发生膨大(又名青菜头),是制作榨菜的主要原料,具有很高的经济价值。基于细胞分裂素在调控植物细胞分裂和抵抗逆境胁迫方面的功能,对细胞分裂素合成基因IPT家族成员进行研究可为提高茎瘤芥的瘤茎产量和培育优质抗逆栽培品种提供依据。本研究在全基因组水平对茎瘤芥IPT家族成员进行了鉴定,并分析了它们的基因和蛋白结构特性、系统进化情况,以及在不同组织器官和主要逆境条件下的表达模式,以期为后续的功能研究奠定基础。
1 材料和方法
1.1 材料与处理
为了检测IPT基因在茎瘤芥不同器官中的表达水平,将栽培品种‘永安小叶’的种子播种在含有培养基质(蛭石∶营养土=3∶1)的7 cm直径的花盆中,置于培养室中进行光照培养,温度为22 ℃,光照时间16 h,黑暗8 h。对培养至生殖生长期植株的根、茎、叶、花和种荚进行取样。每个器官取3株样品的混合材料包于锡箔纸中,立即用液氮速冻后放入超低温冰箱中保存,用于后续总RNA提取及PCR检测。
为检测IPT基因在盐胁迫条件下的基因表达模式,利用上述培养方法将‘永安小叶’培养2周,将200 mmol/L NaCl溶液50 mL浇至植株根部,分别在处理6、12、24和48 h后对植株根系进行取样,0 h对照为浇灌50 mL蒸馏水后立即进行根系取样,取样方法同上。该取样进行3次生物学重复。
为检测IPT基因在根肿菌胁迫条件下的基因表达模式,以5 mLOD600为0.07的根肿菌休眠孢子提取液浇灌培养2周大的茎瘤芥幼苗根周,于处理后12、24、36和72 h对植株根系进行取样,0 h为对照,取样方法同上。该取样进行3次生物学重复。
1.2 方 法
1.2.1 生物信息学分析在拟南芥基因资源库(https://www.arabidopsis.org/)下载拟南芥IPT家族基因的蛋白序列,其基因ID见表1。以拟南芥IPT蛋白序列为搜索条件,在芸薹属网站(http://brassicadb.org/brad/)中的茎瘤芥全基因组(chromosome V1.5)中搜索与其序列一致性较高的蛋白,参数设置为E< 1e-10, 一致性> 70%,覆盖度> 95%,其他参数选择默认。采用在线分析软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对获得序列的蛋白结构域进行预测,去除冗余序列和不含腺苷酸异戊烯基转移酶或转运RNA二甲丙烯基转移酶结构域的序列。利用在线分析工具(https://web.expasy.org/compute_pi/)计算各蛋白的分子量和等电点。采用在线分析软件(http://gsds.cbi.pku.edu.cn/)绘制基因结构。使用MEGA5软件构建茎瘤芥IPT蛋白系统进化树,选择邻接树算法,p距离模型,插入缺失处理方式选择配对删除,靴带值(bootstrap)选择1 000次重复。
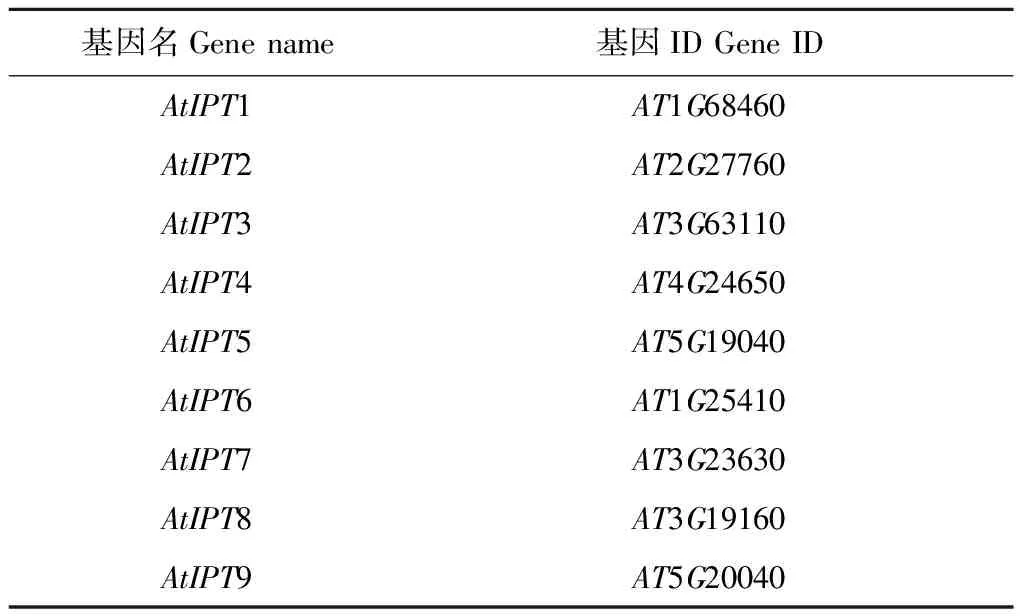
表1 拟南芥IPT基因名和ID
1.2.2 茎瘤芥总RNA提取及荧光定量PCR检测采用SimGEN公司(杭州,中国)的植物总RNA提取试剂盒进行总RNA提取,使用全式金公司(北京,中国)的TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒将总RNA反转录为cDNA,反转录加入模板RNA的用量为500 ng,并将cDNA稀释10倍用于qRT-PCR检测。采用罗氏(Roche)Light Cycler 480 Ⅱ 荧光定量PCR仪进行qRT-PCR分析,使用全式金公司TransStart®Tip Green qPCR SuperMix试剂盒配制10 μL反应体系:2×TransStart Tip Green qPCR SuperMix 5 μL,cDNA 0.5 μL,正、反向引物各0.5 μL,ddH2O 3.5 μL。反应程序为:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 15 s,72 ℃ 15 s,40个循环。内参基因为茎瘤芥Bju18SrRNA(BjuA046942),所用引物序列见表2。

表2 荧光定量PCR引物
1.2.3 数据统计分析采用2-ΔΔCt方法对qRT-PCR结果数据进行分析,计算各基因相对于内参基因的表达量。使用Heml软件对IPT基因在茎瘤芥不同组织中的表达进行热图分析,利用SigmaPlot 10.0软件对盐胁迫和根肿菌胁迫条件下IPT基因表达检测结果进行分析并作图,使用SPSS 16.0软件,选则one-way ANOVA的单因素方差分析(LSD)检验基因表达差异显著性。
2 结果与分析
2.1 茎瘤芥IPT基因鉴定及特性分析
通过序列比对和筛选,在茎瘤芥基因组中共鉴定到27个IPT家族基因(表3),它们的基因长度在996 bp(BjuA041428)~5 326 bp(BjuA041927)之间,基因编码序列(CDS)长度在942 bp(BjuB010173)~2 172 bp(BjuB041047)之间,蛋白序列长度在313 aa(BjuB010173)~723 aa(BjuB041047)之间。等电点和分子量分析结果表明,茎瘤芥IPT蛋白等电点在5.46(BjuB010173)~9.41(BjuB000734)之间,分子量在37.12 kD(BjuB007803)~81.67 kD(BjuB041047)之间(表3)。
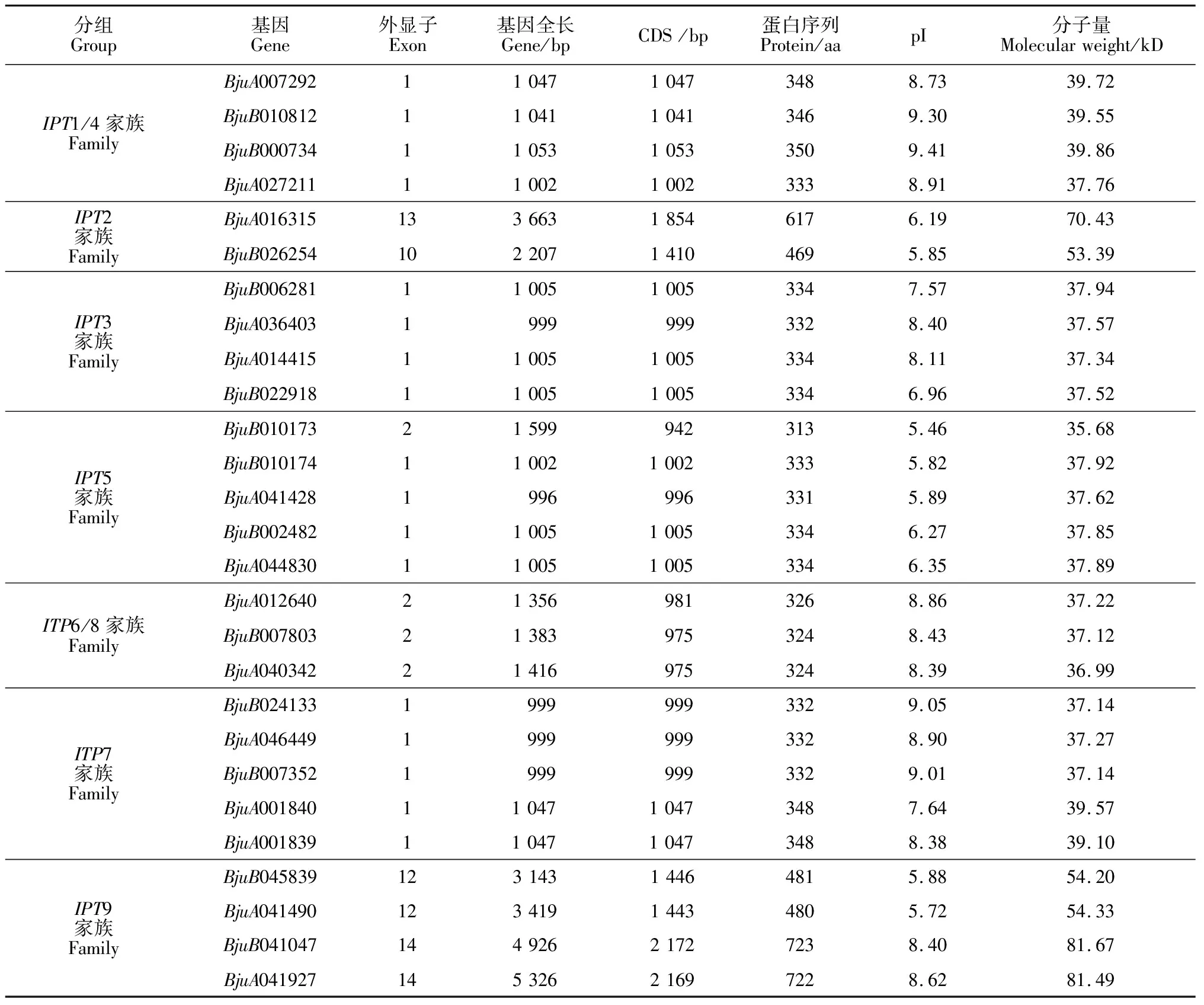
表3 茎瘤芥IPT基因的基本信息
2.2 茎瘤芥IPT基因结构及系统进化分析
进化分析结果显示,9个拟南芥IPT蛋白和27个茎瘤芥IPT蛋白在系统进化树上可聚类为7个分支,IPT1/4分支包含拟南芥AtIPT1、AtIPT4和4个茎瘤芥IPT蛋白;IPT6/8分支包含拟南芥AtIPT6、AtIPT8和3个茎瘤芥IPT蛋白;IPT3分支包含拟南芥AtIPT3和4个茎瘤芥IPT蛋白;IPT5分支包含拟南芥AtIPT5和5个茎瘤芥IPT蛋白;IPT7分支包含拟南芥AtIPT7和5个茎瘤芥IPT蛋白;IPT2分支包含拟南芥AtIPT2和2个茎瘤芥IPT蛋白;IPT9分支包含拟南芥AtIPT9和4个茎瘤芥IPT蛋白(图1)。
基因结构分析结果表明,IPT1/4、IPT3和IPT7三个分支中的基因只含一个外显子;在IPT6/8分支中的4个茎瘤芥IPT基因含有2个外显子和1个内含子,与拟南芥AtIPT8的基因结构相同。在IPT5分支中除BjuB010173外(2个外显子),其余4个基因仅含1个外显子。在IPT2分支中,BjuB026254与AtIPT2均含有10个外显子,而BjuA016315则含有13个外显子(图1)。在IPT9分支中,BjuB045839与BjuA041490均含有12个外显子,而BjuB041047与BjuA041927含有14个外显子,它们的基因结构与AtIPT9(11个外显子)有较大差异(图1)。
2.3 茎瘤芥IPT基因染色体定位分析
染色体定位分析结果表明,茎瘤芥IPT基因在全基因组18条染色体中的14条染色体上均有分布,其中A05、A06、A08和B04染色体上不含IPT基因(表 4)。B05染色体上含有的IPT基因数目最多(4个),其次在A01和A02染色体上各含有3个IPT基因。茎瘤芥A染色体组中共含有14个IPT基因,B染色体组含有13个IPT基因,IPT基因在两个染色体组中的数目近似均等。
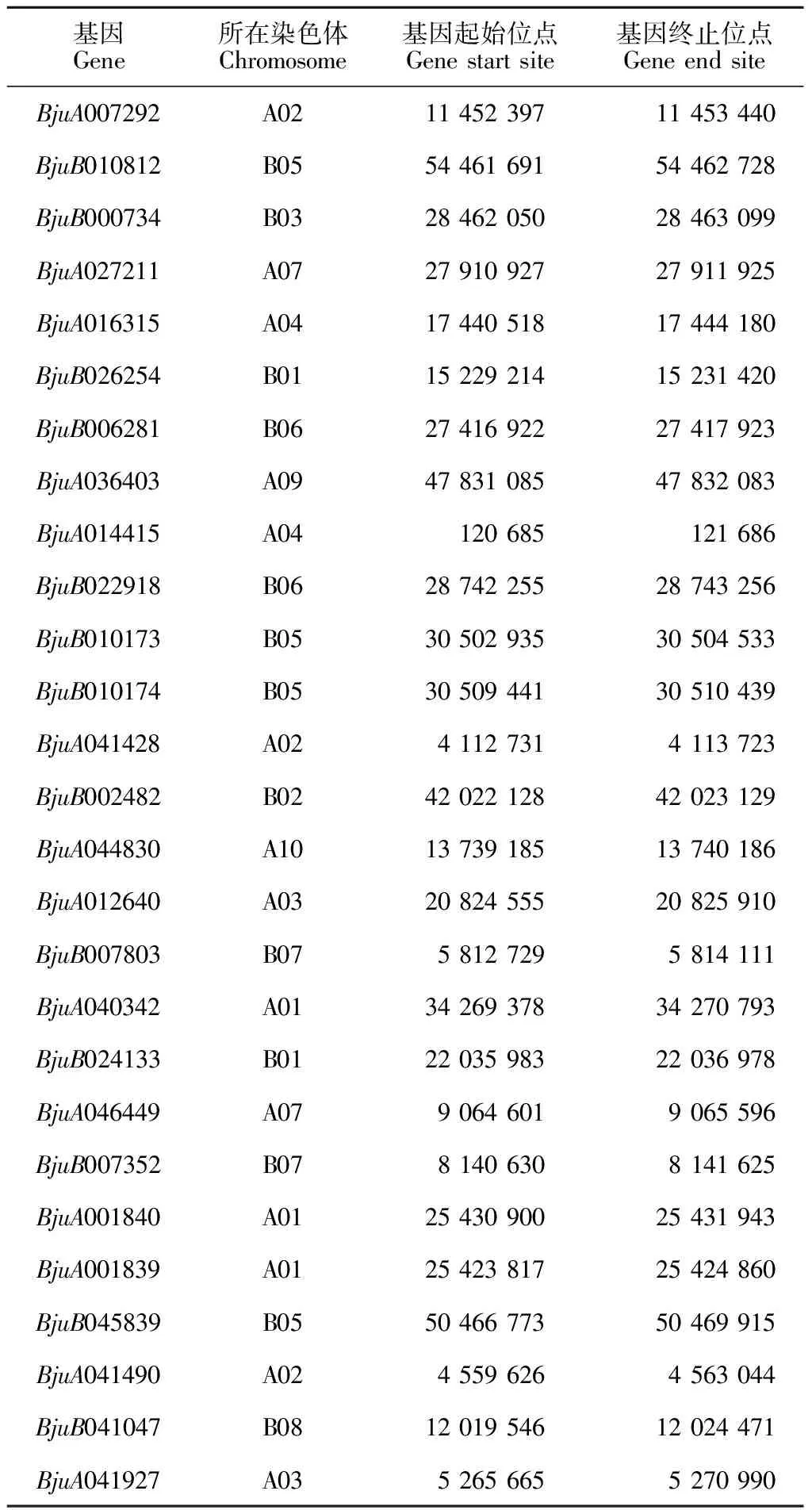
表4 茎瘤芥IPT家族基因染色体定位信息
2.4 茎瘤芥IPT家族蛋白保守结构域分析
蛋白保守结构域分析结果表明,IPT1/4、IPT3、IPT5、IPT6/8和IPT7家族蛋白均含有一个PLN02165结构域(图2),为腺苷酸异戊烯基转移酶(adenylate isopentenyl transferase)的典型结构域,该结构对于以ATP/ADP为底物和合成细胞分裂素的ADP/ATP型IPTs发挥功能十分重要。IPT2和IPT9家族蛋白均含有一个PLN02748结构域,该结构域为tRNA二甲丙烯基转移酶(tRNA dimethylallyl transferase)的典型结构域。依据所含的主要保守结构域可以判断,在茎瘤芥中,IPT1/4、IPT3、IPT5、IPT6/8和IPT7家族蛋白全部成员为ADP/ATP型IPT,IPT2和IPT9家族蛋白全部成员为tRNA型IPT。此外,IPT2分支中的BjuA016315还含有一个transcrip_act结构域,推测该蛋白可能同时具有转录激活活性。
2.5 茎瘤芥IPT家族基因在不同器官中的表达分析
为分析IPT家族基因在茎瘤芥不同组织中的表达模式,采用qRT-PCR的方法对不同器官中IPT家族基因表达水平进行了检测。结果表明,BjuB006281在各个器官中的表达水平均相对较高(图3),且在茎中的表达水平最高,说明该基因可能在调控瘤茎发育过程中发挥功能。相比于其他组织,BjuA027211、BjuB010173、BjuB010174和BjuA001839在根中的表达水平较高,推测它们主要对根的相关功能进行调控;BjuA014415、BjuB022918、BjuA041428、BjuA044830、BjuA046449和BjuB007352主要在根和茎中表达。在叶和花中特异表达的IPT基因较少,仅BjuB041047在叶中表达高于其他组织;虽然在各器官中BjuA012640在花中的表达水平高于其他组织,但相比于内参基因其表达量仍旧很低,推测在茎瘤芥中IPT对叶和花器官的调控作用可能较小。
2.6 茎瘤芥IPT基因在盐胁迫条件下的表达分析
为鉴定出响应盐胁迫的茎瘤芥IPT基因,选择了18个在根中表达水平相对较高的IPT成员,并对它们在200 mmol/L NaCl胁迫处理不同时间点的根中的表达水平进行了检测。结果(图4)表明,大部分的IPT基因均受盐胁迫的下调表达。其中,BjuB006281、BjuA036403、BjuB010173、BjuB026254在盐胁迫处理12~48 h显著下调表达;BjuB022918和BjuB007352则在盐处理24~48 h显著下调表达;BjuA041428、BjuA044830、BjuA016315的表达水平在盐胁迫处理6~24 h就受到显著的抑制,说明它们可能在盐胁迫早期即参与植物的响应过程。与其他基因不同,BjuA014415在盐处理6和12 h受到显著的诱导表达,推测该基因与其他基因在茎瘤芥相应盐胁迫过程中的功能不同。
2.7 茎瘤芥IPT基因在根肿菌胁迫下的表达分析
基于细胞分裂素在植物抗病方面的作用,为挖掘调控茎瘤芥在抗根肿病中可能发挥功能的IPT基因,选择了18个在根中表达水平相对较高的IPT成员,检测它们在根肿菌处理后茎瘤芥根中的表达变化。结果表明,大部分茎瘤芥IPT基因在12 h受到根肿菌侵染的显著诱导,如BjuB006281、BjuA036403、BjuA014415、BjuB022918、BjuB002482、BjuB024133、BjuA046449、BjuB007352、BjuA001840、BjuA001839、BjuA016315和BjuB026254,说明这些IPT基因可对根肿菌侵染做出快速反应;同时也有一些基因在侵染24~72 h表达水平发生显著变化。如BjuB022918和BjuB007352不仅在12 h被诱导表达,在24 h的表达水平也显著高于对照;而BjuB024133虽然在12 h被显著诱导表达,但在72 h其表达水平则受到抑制(图5),说明该基因参与茎瘤芥对根肿菌侵染的响应过程更为复杂。
3 讨 论
目前已有多个物种的IPT家族基因被鉴定出来,如在水稻(Oryzasativa)[17]、二穗短柄草(Brachypodiumdistachyon)[18]、麻风树(Jatrophacurcas)[19]、苹果(Malusdomestica)[20]、白菜(Brassicarapa)[21]中分别鉴定到9、10、6、12、13个IPT家族成员。在茎瘤芥中鉴定到的IPT家族基因数目约为拟南芥和水稻的3倍,为白菜的2倍有余,这与茎瘤芥及其祖先在进化过程中基因组扩张有关。已有研究报道,在十字花科中,芸薹属植物由拟南芥进化而来后又发生了一次基因组三倍化事件[22],但白菜IPT基因数目远小于拟南芥的3倍,表明基因组三倍化后存在IPT基因的丢失[21],而茎瘤芥作为白菜和黑芥异源杂交的变种在该进化过程中又发生了一次染色体组加倍[23],导致茎瘤芥IPT基因数目进一步增加。此外,茎瘤芥A01染色体含有3个IPT基因,而白菜A01染色体仅含有2个IPT基因,推测基因的串联重复也是导致茎瘤芥IPT基因数目进一步增加的原因。由于不同IPT基因可能在合成细胞分裂素功能上存在冗余,加之茎瘤芥IPT基因的加倍化,后续对它们进行功能研究需要着重考虑基因间功能互补产生的影响。
相比于其他组织,IPT3、IPT5和IPT7分支的绝大部分基因在根中的表达水平最高,可能与细胞分裂素主要在根部合成有关。在拟南芥和白菜中,同样发现了这3个基因在根中的高表达[21, 24],说明这3个亚家族的基因功能十分保守,均是根部细胞分裂素合成过程中的主要成员。
已有研究表明,盐胁迫可导致拟南芥细胞分裂素含量降低,进而增强植株对盐胁迫的耐受性[25]。KNOX基因可以通过IPT3促进细胞分裂素合成,在玉米中,经过盐处理的根中差异表达的ZmKNOX基因绝大多数为下调表达,与本研究中盐处理抑制大部分IPT基因的表达情况一致[26]。在拟南芥中,过表达IPT8后,植株活性氧含量增加,同时对盐胁迫的耐受性降低[27]。在茎瘤芥中,盐胁迫处理后,大部分IPT基因显著下调表达,说明通过抑制IPT的表达来减少植株体内细胞分裂素合成也是茎瘤芥响应盐胁迫的主要方式之一。
已有研究表明内源或外源的细胞分裂素处理可增强植物对病原菌的抗性[28],在拟南芥中过表达IPT1、IPT3、IPT5或IPT7均可以抑制病原菌Pseudomonassyringaepv.tomatoDC3000的生长,此外,过表达IPT3还可使拟南芥在病原菌侵染后积累更多的胼胝体以抵御病原菌的侵害[29]。IPT作为合成细胞分裂素的主要基因同样可能在茎瘤芥抗根肿病方面发挥功能。在检测的茎瘤芥IPT家族基因中,大部分成员均在根肿菌侵染后上调表达,推测茎瘤芥在被侵染早期即可通过迅速增加内源细胞分裂素含量来抵御根肿菌的侵害。研究发现,根肿菌侵染白菜1 d后,根中的BrIPT1可被诱导表达8倍以上,与茎瘤芥大部分基因具有类似的被根肿菌侵染诱导表达的特点一致[30]。然而,茎瘤芥IPT1分支的基因在根中表达水平过低导致很难检测得到,但多个其他分支的IPT基因在根部均受根肿菌侵染的显著诱导,推测这些基因很可能与白菜BrIPT1一样可在抵抗根肿菌侵染过程中发挥作用。
作者贡献:蔡兆明和程春红负责本研究的实验计划与执行,廖静静负责数据和部分结果分析,蔡兆明负责论文初稿写作;王殿东是项目的负责人,指导实验设计、数据分析以及论文的修改。全体作者都阅读并同意最终文本。
