胎儿期与成年期蒙古马骨骼肌肌纤维类型转化研究
2022-03-08丁文淇图格琴任秀娟陶克涛拉希玛贾紫洁安塔娜铁木齐尔阿尔滕齐米克韩海格陶娜拉白东义
丁文淇,图格琴,任秀娟,陶克涛,拉希玛,贾紫洁,安塔娜,铁木齐尔·阿尔滕齐米克,韩海格,陶娜拉,芒 来*,白东义*
(1.内蒙古农业大学动物科学学院,内蒙古自治区马遗传育种与繁殖重点实验室, 农业农村部马属动物遗传育种繁殖科学观测实验站, 内蒙古农业大学马属动物研究中心,呼和浩特 010018; 2.锡林郭勒盟镶黄旗农牧和科技局,镶黄旗 013250)
蒙古马是世界上古老的马品种之一,具有抗严寒、耐粗食、耐力强等优良特性。在长距离比赛中,蒙古马可以连续完成30~100 km的耐力比赛[1]。
骨骼肌作为哺乳动物最大的产能器官系统,为动物运动产生动力。肌纤维作为骨骼肌的基本组成单位,其性状主要包括纤维密度、大小、类型等[2]。在动物出生以后,肌纤维的数目已经确定,其生长发育和类型组成是影响动物机体运动性能的重要因素。根据肌纤维形态特征、生理功能可以进行区分为Ⅰ型(慢收缩氧化型)、Ⅱa型(快收缩氧化型)、Ⅱb型(快收缩酵解型)和Ⅱx型肌纤维(中间型)[3]。不同类型的肌纤维形态特征、收缩性能等生理生化特性存在差异,不同肌纤维类型酶活性的不同决定了其代谢性能的差异。慢肌纤维含有较高活性的有氧代谢酶,线粒体含量高,而ATP酶活性较低,故收缩慢而持久。快肌纤维中含有较高的糖酵解酶和ATP酶,线粒体含量较少,快肌收缩快但不持久[4]。肌纤维类型并不是一成不变的,当机体受到刺激时,骨骼肌能够激活细胞内相关的信号通路,使肌纤维特异性基因表达发生改变[5]。由于骨骼肌具有高度可塑性,从而使肌纤维类型发生改变以适应当前机体需求,不同的生长情况下也可引起不同程度的肌纤维类型的转变[6]。肌纤维类型的转化遵循Ⅰ型 (慢收缩氧化型)↔Ⅱa型 (快收缩氧化型)↔Ⅱx/d型 (中间型)↔Ⅱb型 (快收缩酵解型) 的转化路径[7]。Sakuma等[8]发现,MyOD和Myf5主要在快肌中表达,而MyOG主要在慢肌中表达,进一步研究发现,MyOD通过与MyHCⅡb基因启动子区域的E-box结合,激活了肌肉基因的转录,促进Ⅱb型肌纤维的表达[9]。MyOD也可以通过激活自身、家族成员互相结合来激活肌肉特异性基因表达[10],还受到细胞内信号转导通路的调节,如FGF2-2(成肌细胞生长因子-2)、TGF-β1(转化生长/分化因子-β1),共同来调节肌纤维的生长和转化[11]。在肌肉中超表达MyOD能够使慢肌转化为快肌[12]。敲除MyOD基因后,可以使快肌转化为慢肌[13]。Alapat等[14]研究发现,低水平的MyOG(肌细胞生成素)能自身调节,与生肌因子其他成员相互作用[15],同时还可以调节肌肉特异蛋白如肌钙蛋白、肌球蛋白轻链等促进成肌分化为快肌纤维[16],当表达水平提升时又促进慢肌的形成[14]。类似这种肌纤维类型转化受到多个分子和多种信号通路共同调控,肌纤维类型的这种适应性重塑过程对于机体能量稳态、缓解疲劳、成长发育至关重要。然而这种肌纤维类型转化的分子调节机理在蒙古马上还不是很清楚。
为进一步研究蒙古马肌纤维类型转化的分子机理,本研究对年龄上存在明显差异的蒙古马骨骼肌纤维类型进行探索,选取快、慢肌纤维组成差异较大的4块部位肌肉(长臂三头肌、夹肌、背最长肌、臀中肌)进行RNA-seq,比较胎儿期和成年时期快肌和慢肌类型的转录组差异。
1 材料与方法
1.1 试验动物样品采集
本研究选取3匹年龄为5岁、体型基本一致、孕期时间差距较小的成年雌性蒙古马,以及胎龄为4月 的3匹胎儿进行采样。试验马匹来源于内蒙古农业大学饲养的试验动物,其生活环境相同。从胎儿和成年马身上采集4个具有代表性部位的肌肉组织样本,长臂三头肌(前肢)、夹肌(颈部)、背最长肌(背部)、臀中肌(后肢)4个部位。采集获得的样本一部分立即投入液氮存储后转移至-80 ℃冰箱保存;另一部分用4%的多聚甲醛固定24 h后经过乙醇梯度脱水至100%无水乙醇溶液,-20 ℃低温储存。
1.2 快、慢肌纤维免疫组化染色
本试验采用的是免疫组化染色法,免疫组化染色法是抗原和抗体的专一性结合,通过酶等化学反应中抗体标记显色剂显色,对肌纤维类型的区分是根据肌纤维类型存在差异找到各类型肌纤维所对应的抗体,从而将肌纤维进行区分。
将浸泡在100%乙醇中的组织样品进行石蜡包埋,利用切片机(Leica RM2245)对包埋的石蜡制作成组织完整、无损伤的6 μm厚度的连续组织切片,70 ℃烘30 min后,经数小时晾干,通过二甲苯脱蜡,梯度酒精回水后,进行免疫组织化学染色,试验流程依据UltraSensitiveTM S-P超敏试剂盒说明书制定。切片经过氧化物酶阻断溶液处理,PBS (pH 7.2~7.4) 冲洗后滴加正常非免疫动物血清,室温孵育10 min; PBS冲洗后滴加第一抗体分别为: 1)抗 快速肌球蛋白骨骼重链抗体(兔, 稀释浓度1∶200, Bioss, 中国北京),该抗体与MHC-Ⅱ特异性反应;2)抗肌球蛋白-7抗体(兔, 稀释浓度1∶200, Bioss, 中国北京),该抗体与MHC-Ⅰ特异性反应。4 ℃孵育过夜,PBS冲洗后滴加第二抗体(小鼠,稀释浓度1∶200,福州麦兴),室温孵育10 min,PBS冲洗后滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min;PBS冲洗后,配置新鲜的DAB染色剂,滴加在切片上,显微镜下观察显色,自来水冲洗终止染色;苏木素复染,脱水后用中性树胶封片彻底晾干,放置在切片盒中常温避光保存。
经过免疫组化染色的蒙古马4个部位的肌肉切片置于显微成像系统(Axio Observer D1, ZEISS)进行数字照片检测和测量信号,在连续切片中快、慢肌纤维均呈现出棕色阳性信号,由Image-Pro Plus 6.0图像分析软件选取出AOI (area of interest),在通过软件捕捉得到肌纤维总面积,棕色信号区域和白色区域相比得到快肌和慢肌在肌纤维中的占比。
1.3 骨骼肌RNA文库的构建与测序
3匹胎儿期蒙古马和3匹成年期蒙古马的长臂三头肌、夹肌、背最长肌、臀中肌肌肉样品使用TRIzol试剂(Invitrogen, CA, USA)和动物组织RNA纯化试剂盒TRK1002(LC Science, Houston, TX)提取总RNA,使用Agilent 2100生物分析仪和Agilent RNA 6000纳米试剂盒(Agilent, CA, USA) 对RNA的数量和质量进行分析,然后使用mRNA-Seq样品制备试剂盒(Illumina, San Diego, USA)生成测序文库。文库在Illumina Hiseq 4000平台上测序,生成2×150 bp的配对端reads。
1.4 转录组表达谱数据分析
首先用cutadapt软件对原始数据接头序列和低质量序列进行处理,这些数据通过FastQC(http:// www.bioinformatics.babraham.ac.uk/projects/fastqc/)验证,然后将高质量reads比对到马参考基因组(EquCab3.0),使用Hisat2[17]进行比对,然后使用stringtie[16]得到胎儿期和成年期的基因表达谱。用DEseq2软件[18]进行基因差异表达分析,差异显著标准:| log2(fold change)|>1 &P<0.05。为了比较胎儿期和成年期肌纤维类型的差异基因表达谱,以胎儿期和成年期肌纤维群体作为两组进行后续研究。使用DAVID (https://david.ncifcrf.gov/)在线软件对差异表达基因进行GO 和KEGG富集分析。
1.5 实时荧光定量PCR验证
使用HiScript®II qRT SuperMix for qPCR (Vazyme)从总RNA中生成cDNA。根据转录组测序结果筛选9个与蒙古马肌纤维类型转化相关的差异表达基因,利用NCBI在线引物设计功能设计特异性引物,选择甘油醛-3-磷酸脱氢酶(GAPDH)基因为内参基因,后将设计好的引物送上海生工生物工程公司合成。然后用10对引物(表1)和SYBR®Premix Ex TaqTMII (TaKaRa)在CFX96 Real-Time PCR检测系统(Bio-Rad)上进行qPCR。反应体系如表2所示,选择GAPDH作为内参基因,采用2-△△Ct定量分析方法。荧光定量PCR反应程序:95 ℃ 预变性5 min;95 ℃变性1 min;60 ℃退火30 s; 72 ℃延伸1 min。试验进行12个生物学重复,从而减少外界以及人为操作因素对试验的影响。

表1 骨骼肌相关基因扩增引物序列信息
2 结 果
2.1 胎儿期和成年期蒙古马肌纤维类型差异比较
根据免疫组化染色图像,将纤维分为Ⅰ型(慢型)和Ⅱ型(快型)纤维。本研究共采集了6匹蒙古马长臂三头肌、夹肌、背最长肌、臀中肌共24个样本(6匹*4块肌肉),成年期蒙古马Ⅱ型骨骼肌纤维中,长臂三头肌(72%)、夹肌(56.1%)、背最长肌(70.3%)如图1A和图1B所示、臀中肌(81.5%)。胎儿期蒙古马Ⅱ型骨骼肌纤维中,长臂三头肌(89.1%)、夹肌(78.8%)、背最长肌(93%)如图1C和图1D所示、臀中肌(94.2%)。如图2所示,与成年马肌纤维相比,胎儿马肌纤维形状不规则,肌纤维大小差别较大。胎儿期蒙古马背最长肌、夹肌和长臂三头肌中Ⅱ型肌纤维占比极显著高于成年期蒙古马(P<0.01)。

表2 荧光定量PCR反应体系
2.2 差异表达基因的表达与鉴定
在本研究中,两个年龄阶段4块不同部位的肌肉作为一个整体被比较,区别在于两个时期肌纤维类型存在差异。DESeq2数据分析显示,一些基因在多重对照组中差异表达,结果表明,胎儿期和成年期肌纤维表型和肌纤维类型基因表达存在差异。通过比较胎儿期和成年期骨骼肌的差异基因表达,共鉴定出250个差异表达基因,其中胎儿时期表达上调的基因17个,成年时期表达上调的基因27个,如图3A所示。差异表达基因分层聚类分析发现,ENO3、TNNI2等基因主要表达于胎儿期蒙古马,ATP2A2、TNNT1等基因主要表达于成年期蒙古马(图3B)。
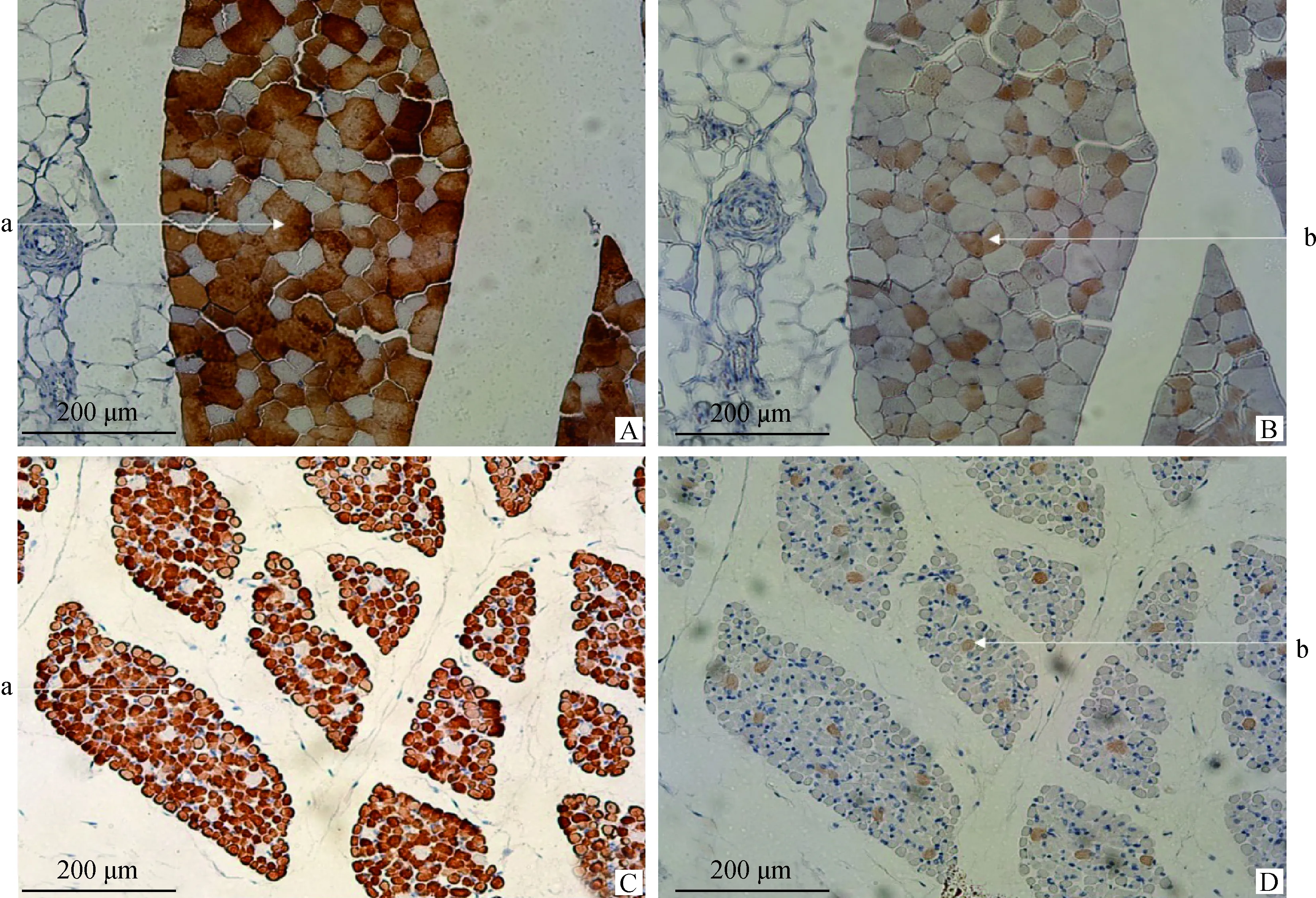
A.成年期蒙古马背最长肌快肌纤维; B. 成年期蒙古马背最长肌慢肌纤维; C. 胎儿期蒙古马背最长肌快肌纤维; D. 胎儿期蒙古马背最长肌慢肌纤维。a.快肌纤维;b.慢肌纤维A. Fast muscle fibers of longissimus dorsi in adult period; B. Slow muscle fibers of longissimus dorsi in adult period; C. Fast muscle fibers of longissimus dorsi in fetal period; D. Slow muscle fibers of longissimus dorsi in fetal period.a.Fast muscle fiber;b.Slow muscle fiber图1 不同部位肌肉快、慢肌纤维分布Fig.1 Distribution of fast and slow muscle fibers in different parts
2.3 差异表达基因的GO富集分析
约有60%的差异表达基因被GO富集注释,主要富集于生物途径。如图4所示,在生物途径中,GO富集显示了胎儿期和成年期主要富集在成年期蒙古马骨骼肌收缩(GO:0003009~skeletal muscle contraction)、肌肉收缩调节(GO:0006937~regulation of muscle contraction)、ATP酶活性调节(GO:0043462~regulation of ATPase activity),这能够调控自身骨骼肌收缩应对外面环境和机体内部因子稳态,为机体运动提供充足的动力。特别明显的是有多个差异表达基因富集在快慢肌纤维类型转化(GO:0014883~transition between fast and slow fiber),暗示在胎儿期和成年期肌纤维类型发生过转化。胎儿期与成年期上调差异表达基因不同,胎儿期上调明显的差异表达基因富集在糖酵解过程(GO:0006096~glycolytic process)和肌肉收缩过程(GO:0006936~muscle contraction),为机体提供生命活动所需要的能量。
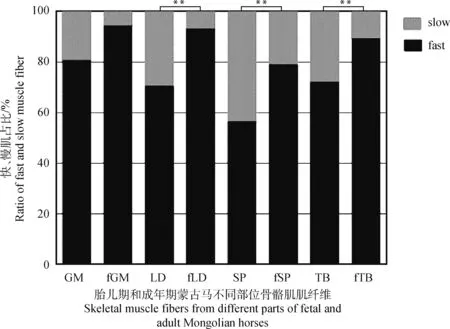
f.胎儿期。GM. 臀中肌;LD. 背最长肌;SP. 夹肌;TB. 长臂三头肌f. Fetus period. GM. Gluteus medius; LD. Longissimus dorsi; SP. Splenius; TB: Triceps brachii图2 蒙古马4个部位快、慢肌占比Fig.2 The ratio of fast and slow muscle fiber in 4 parts of Mongolian horse
2.4 差异表达基因的KEGG途径分析
为了进一步了解成年马和胎儿马之间的分子功能差异,本研究使用KEGG通路的功能注释了差异表达基因。如图5所示,在这些通路中,糖酵解和糖质新生(ecb00010:Glycolysis/Gluconeogenesis)途径是肌纤维快速收缩的关键代谢途径,该通路中基因在胎儿期占有更大比例,且胎儿期占有高比例的快肌纤维。AMPK信号通路(ecb04152:AMPK signaling pathway)是平衡细胞能量的重要调节酶,除对肌肉能量代谢起到调控作用外,AMPK还与肌纤维类型转化密切相关。钙信号通路(ecb04020:Calcium signaling pathway)依赖转运途径使肌纤维类型发生转化。心肌细胞脾、肾上腺素能信号通路(ecb04261:Adrenergic signaling in cardiomyocytes)富集了一些与肌肉转化相关的基因(TNNI1、TNNC1、TPM3)。
2.5 实时荧光定量PCR验证
为了验证差异基因的表达,胎儿期和成年期骨骼肌中,两组间的差异基因(ATP2A2、MYOZ2、MYL1、ENO3、MYBPC1、TMOD4、TNNT1、TNNT3、TNNI2)参与了骨骼肌收缩、快速和缓慢肌纤维之间的转换以及糖酵解代谢。RT-qPCR检测这些mRNA的表达趋势与mRNA-seq数据一致,验证了转录组测序数据结果可信,如图6所示。
3 讨 论
本试验研究了胎儿期和成年期蒙古马肌纤维类型的差异,免疫组化分析发现,胎儿期Ⅱ型纤维比例显著高于成年期蒙古马,可能与胎儿营养物质丰富有关,日粮中的营养物质消化吸收后可参与机体能量代谢,进而影响肌肉发育和肌纤维类型转化[19]。动物早期的生长发育是一个关键阶段,受到了遗传物质基础和母源营养环境的共同影响,最终决定了成年期的表型[20]。动物出生后肌纤维发育肥大,还伴随肌纤维类型转化[21-22]。胎儿到成年时期Ⅱ型(快型)纤维向Ⅰ型(慢型)纤维转化,一般Ⅰ型纤维对于大型哺乳动物维持其体重非常重要。成年时期蒙古马有较高的Ⅰ型纤维比例,在不断生长发育过程中,肌纤维类型的转化随着年龄的增加而不断发生转化,以便适应不同时期体重发生改变的蒙古马[23]。
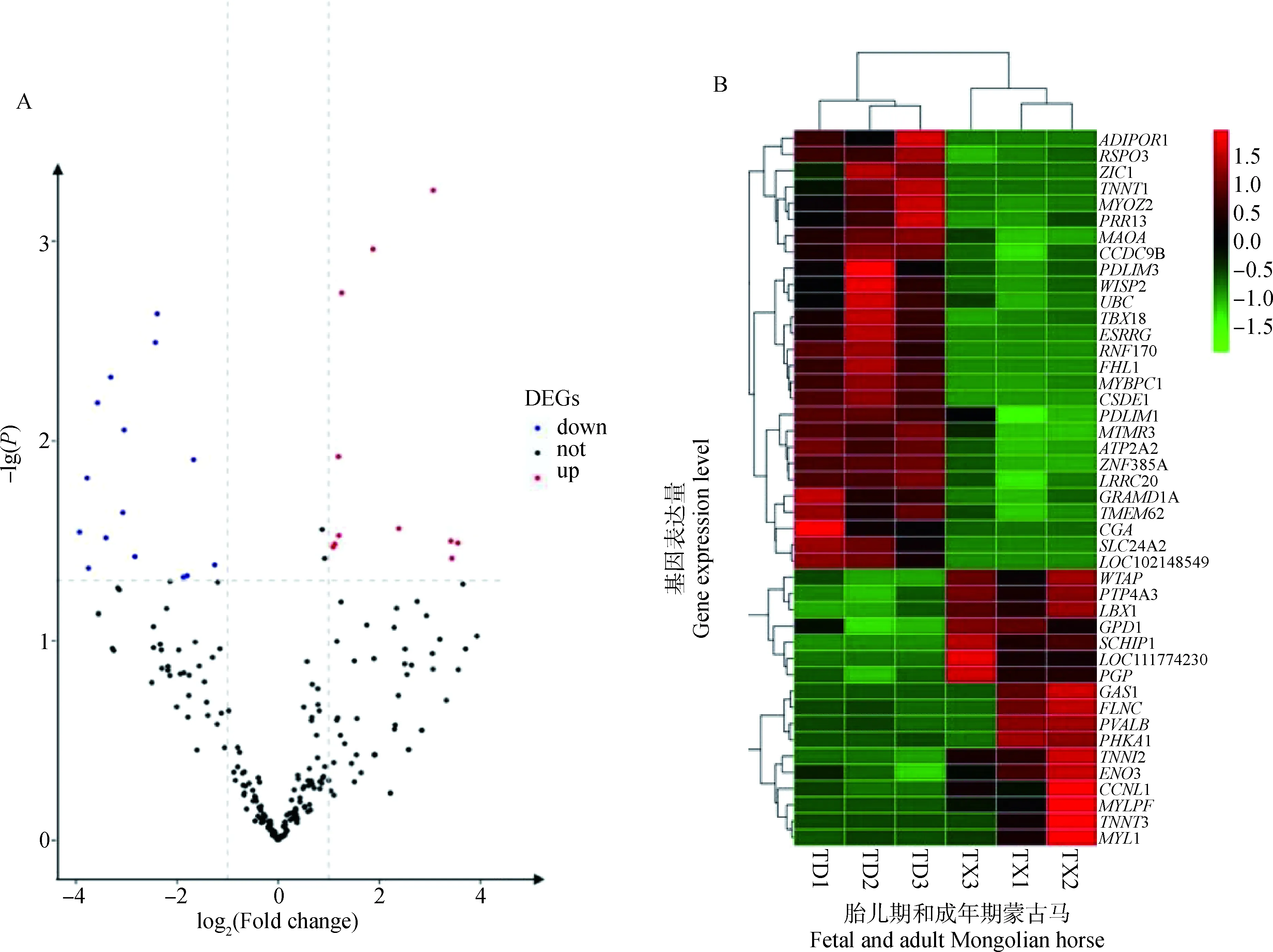
A.红色代表胎儿期蒙古马上调基因,蓝色代表成年期蒙古马上调基因,黑色代表无显著变化基因;B.红色代表上调基因,绿色代表下调基因,TD代表成年期蒙古马,TX代表胎儿期蒙古马A. Red represents the up-regulated genes in fetal Mongolian horse, blue represents up-regulated genes in adult Mongolian horses, black represents genes with no significant change; B. Red represents up-regulated genes, green represents down-regulated genes, TD represents adult Mongolian horse, TX represents fetal Mongolian horse图3 胎儿期与成年期差异表达基因火山图(A)及胎儿期与成年期差异基因分层聚类(B)Fig.3 Volcano map (A) and stratified clustering(B) of differentially expressed genes at fetal and adult stages
肌纤维转化不是从一个极端 (快肌纤维) 跨越到另一个极端 (慢肌纤维),而是在分子水平中逐级过渡转化的, 即肌原纤维蛋白亚型的转变[24]。为了确定和比较胎儿时期和成年时期肌纤维类型,本试验研究了胎儿期和成年期蒙古马具有代表性的4个 部位肌肉(整体)的转录组,功能富集在这两个时期的肌肉之间出现了高度分化。GO富集结果中,在胎儿时期(含有较高的Ⅱ型纤维)中高表达的差异表达基因主要富集于糖酵解代谢相关途径。GO富集结果还表明,Ⅰ型和Ⅱ型纤维在胎儿期和成年期肌纤维类型转化,成年时期Ⅰ型纤维增加,部分基因(TNNT1、TNNC1、ATP2A2)主要在成年时期慢抽搐骨骼肌中表达。早期的生长阶段是肌纤维类型转化的重要阶段,为了适应外界环境的要求和自身条件的需要。调控肌纤维类型的差异基因在不断发生变化,肌纤维类型逐级过度转化,并且这种转化过程处于动态平衡阶段[25]。
肌纤维类型间的相互转化受到复杂的生物学通路调节。转录组是特定组织或细胞在某一生理条件下所表达的所有RNA,是连接蛋白质和基因的桥梁[26]。本研究通过KEGG注释共得到20条信号通路,其中差异表达基因在Ca2+信号通路中富集。Ca2+信号通路依赖钙调神经磷酸酶(calcineurin,CaN)和钙调蛋白激酶(calmodulin kinase,CaMK)进行信号传导,每一条传导途径被激活都能够促进Ⅱ型纤维向Ⅰ型纤维转化[27]。另外还有一条关于肌纤维转化的相关通路,5′-腺苷单磷酸激活蛋白激酶(AMPK)是细胞能量的重要调节酶,不仅对肌肉能量代谢起关键调控作用,还能够参与肌纤维类型转化[28]。研究发现,AMPK激活剂阿卡地新可诱导大鼠趾长伸肌Ⅱb型肌纤维向Ⅱx型肌纤维转化。AMPK在细胞能量代谢时由ATP产生,ATP去磷酸化形成ADP与AMP。而AMP可通过上游激酶增加AMPK磷酸化,通过磷酸酶降低AMPK去磷酸化,AMP还可以变构激活磷酸化AMPK。AMPK经磷酸化激活后会调控其下游通路 PGC-1α,增加线粒体的生物合成,增强线粒体功能,提高氧化代谢能力,从而使Ⅱ型肌纤维向Ⅰ型转化[29]。本研究中,调控AMPK通路的基因主要表达于成年期,可能说明了成年期肌纤维受到了AMPK通路调节,证明了胎儿期到成年期快肌受到机体内部因子调控逐渐向慢肌转化。
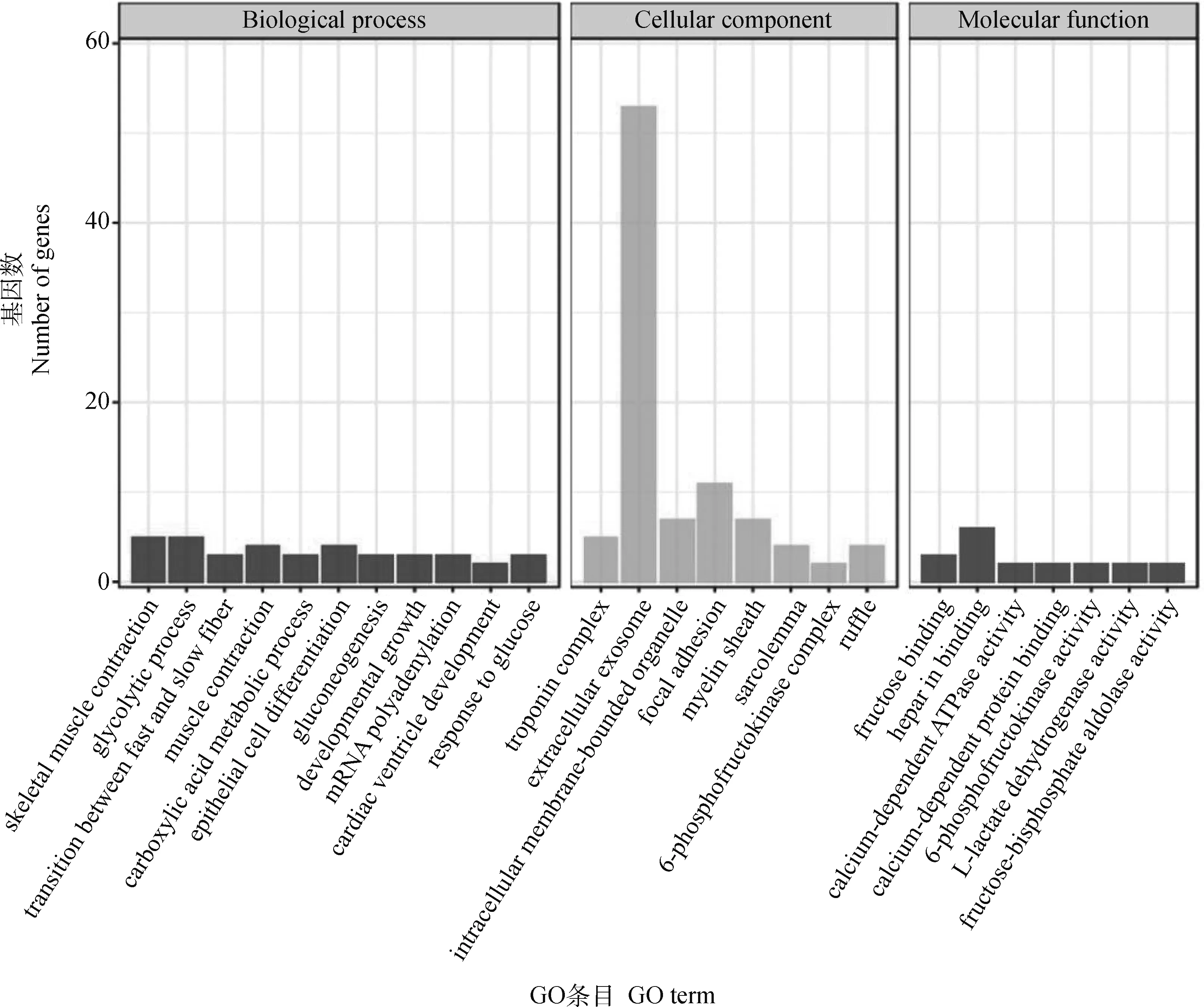
图4 差异表达基因的GO功能富集分析结果Fig.4 The GO enrichment analysis results of differentially expressed genes

图5 胎儿期和成年期差异表达基因KEGG富集分析Fig.5 The KEGG enrichment analysis of differentially expressed genes in fetal and adult stages
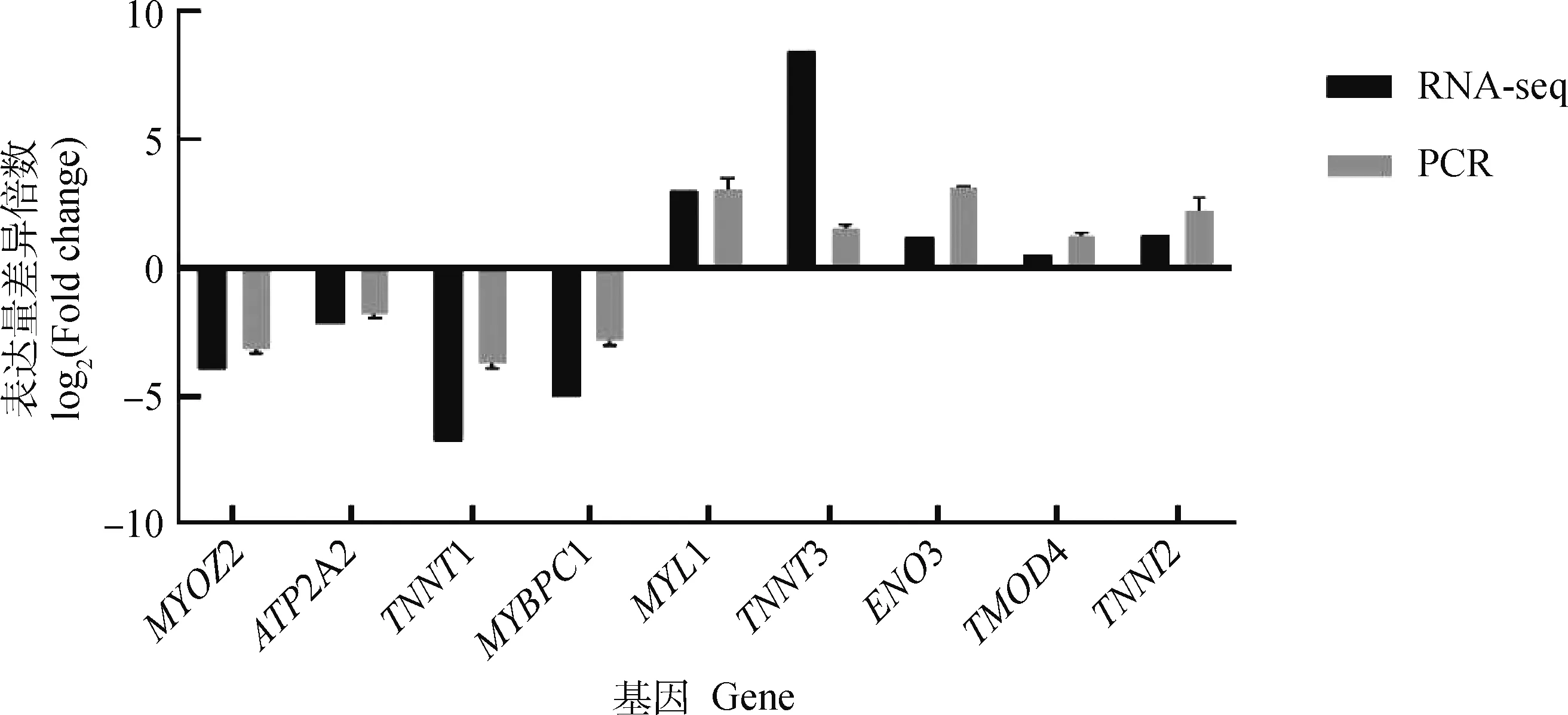
图6 RNA-seq和qRT-PCR验证Fig.6 RNA-seq and qRT-PCR validation
肌纤维是动态学结构,MYDZs家族蛋白对维持Z盘结构稳定有重要意义,已有研究结果表明,MYOZ2是肌肉组织特异性表达蛋白[30],主要在慢肌组织和心肌中表达,可以激活多种肌肉发生相关基因,在肌纤维分化和发育上起重要作用[31]。MYOZ2基因在成年期表达水平明显高于胎儿期,成年期慢收缩肌纤维也显著高于胎儿期。Frey等[32]发现,MYOZ2基因敲除的小鼠中, CaN信号通路的活性显著增强。MYOZ2可以负向调节钙调神经磷酸酶的功能[33],将MYOZ2基因敲除后,钙调磷酸酶活性显著增强,激发了CaN-NFAT信号通路,启动生成慢肌纤维机制。MYOZ2基因对CaN的活性起了抑制作用,进而调节了慢肌纤维的转化[34]。MYOZ2基因在成年马慢肌纤维中表达明显,可能说明MYOZ2基因在成年期调控钙调神经磷酸酶对肌纤维类型产生影响,导致成年期慢肌纤维增加,骨骼肌具有不同收缩程度和代谢特性,从而使肌肉能够进行特定的运动,成年期肌纤维增多可能与长期负重劳作有关,慢肌纤维的增加能够使马匹基础代谢加快,更好地利用氧气,在长时间的运动或者劳作上使马匹的效率得到提高。
骨骼肌是哺乳动物最大的产能器官,是机体糖代谢的重要场所[35]。肌纤维类型经过一个成熟的过程达到稳定的分布模式[36]。近年来通过遗传育种和营养调控多种手段,可以使动物肌纤维类型发生明显转化[37]。早期生长阶段是肌纤维类型转化的重要时期,营养水平是肌肉能够发育转化的基本保障,环境、训练、饲养条件等后天因素也会使肌纤维转化,外界因素和机体内部因子协同调控是转化的必然结果[38]。
4 结 论
本研究分析了胎儿期和成年期蒙古马肌纤维类型转化情况,发现胎儿期蒙古马快肌纤维比例显著高于成年期蒙古马。经过转录组筛选出差异表达基因44个,其中ATP2A2、MYOZ2等基因主要表达于成年期蒙古马肌纤维,ENO3、TNNI2等基因主要表达于胎儿期蒙古马肌纤维。钙信号和AMPK信号通路与肌纤维类型转化有关。
