绵羊miR-127/FOXO4反馈环路及其对卵泡颗粒细胞凋亡相关基因表达的影响
2022-03-08岳巧娴锡建中宋鹏琰陈晓勇周荣艳
付 强,岳巧娴,锡建中,宋鹏琰,陈晓勇,周荣艳
(河北农业大学动物科技学院,保定 071001)
绵羊产羔数的遗传力较低[1],易受环境、季节、营养等条件影响[2]。卵泡的生长、发育与绵羊产羔数密切相关,即当绵羊排卵率上升时产羔数增加[3]。颗粒细胞为哺乳动物卵泡的发育、成熟提供物质保障[4]。miRNA是由18~24个核苷酸组成的非编码单链小RNA分子,通过碱基互补配对的方式作用于靶基因,进而降解mRNA或阻碍其翻译,在调控卵泡发育、闭锁和颗粒细胞凋亡过程中发挥作用[5]。
FOXO4属于FOXO家族成员,此家族成员在生物体中参与的调节通路基本相同,FOXO4参与了机体的糖脂代谢过程,体内高表达FOXO4的小鼠,糖异生受到抑制[6],细胞中胆固醇的合成量减少、葡萄糖的摄入量增加[7],经营养物质和胰岛素等多因素刺激后,诱导FOXO4乙酰化而使其活化, 促进细胞凋亡[8-9]。FOXO4参与了能量代谢过程,在生物体代谢稳定过程中发挥重要作用,调节细胞周期,广泛影响细胞的生理过程[10]。
颗粒细胞凋亡作为细胞自主发生的模式[11-12],在卵泡发育过程中扮演着重要角色。卵泡发育、成熟过程中,颗粒细胞凋亡则通常被认为是引起卵泡闭锁的“诱因”[13]。miRNA调控动物卵泡颗粒细胞凋亡[14]。绵羊miR-150通过靶向STAR基因,抑制孕酮合成相关基因表达减少孕酮合成,促进体外颗粒细胞的凋亡,抑制其增殖[15]。miR-26b通过靶向SMAD4基因促进卵泡颗粒细胞凋亡[16]。miR-181a-5p通过靶向SIRT1抑制鹅颗粒细胞凋亡[17]。近年来研究表明,miRNAs在动物卵泡颗粒细胞凋亡过程中发挥着非常重要的调控作用。
本研究组前期研究发现,FSH显著降低了绵羊卵泡颗粒细胞oar-miR-127和FOXO4的表达水平,细胞凋亡相关基因表达水平上升。根据生物信息学分析结果,推测oar-miR-127可能靶向FOXO4基因,且在细胞凋亡调控过程中发挥作用,目前oar-miR-127在绵羊颗粒细胞中的研究未见报道,本研究拟明确oar-miR-127对绵羊颗粒细胞凋亡的影响及其与靶基因FOXO4之间的互作关系,为阐明其在绵羊卵泡发育过程中的调控机制提供理论依据。
1 材料与方法
1.1 绵羊卵泡颗粒细胞分离培养及293T细胞培养
将复苏后的293T细胞(购自中国医学科学院),转移到含有2 mL DMEM完全培养基(DMEM培养基+10%胎牛血清+1%双抗)的培养瓶中,培养在37 ℃,5% CO2的培养箱中。
采集绵羊卵巢,去除卵巢周围多余的脂肪,割开卵泡皮质层后将液体收集于离心管中,1 000 r·min-1离心10 min,去上清,重复3次。加入适量DMEM/F12完全培养基(DMEM/F12培养基+10%胎牛血清+0.1%丙酮酸钠+1%双抗),吹打混匀后接种于培养瓶中,在37 ℃,5% CO2培养箱中培养。
1.2 引物设计
以绵羊FOXO4、Casp3和Bax基因为模板设计qRT-PCR引物,以oar-miR-127成熟体序列为模板设计茎环引物;利用Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/)预测绵羊miR-127基因启动子,设计启动子扩增引物(Primer 3, https://bioinfo.ut.ee/primer3-0.4.0/),测序引物由擎科生物公司合成(表1)。

表1 引物信息表
1.3 绵羊卵泡颗粒细胞总RNA提取与反转录
利用TRIzol试剂对收集的细胞进行总RNA提取。采用NanoDrop2000(Thermo Fisher Scientific, 美国)进行浓度测定。将RNA稀释至200 ng·μL-1,按照反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa, Code No.RR047A)说明书进行cDNA合成。反转录体系包含10.0 μL去除基因组DNA的反应液,1.0 μL PrimeScript RT Enzyme Mix I,1.0 μL RT Primer Mix(反转录oar-miR-127时,换成oar-miR-127反转录引物),4.0 μL 5×PrimeScript Buffer 2,4.0 μL RNase Free Water,反转录条件为42 ℃ 15 min,85 ℃ 5 s。
1.4 miR-127启动子区转录因子FOXO4结合位点预测和重组质粒的构建
1.4.1 miR-127启动子区转录因子FOXO4结合位点预测 利用Promoter 2.0(http://www.cbs.dtu.dk/services/Promoter/)预测绵羊miR-127启动子(NCBI,Gene ID: 102466274),并利用JASPAR在线数据库 (http://jaspar.genereg.net/) 预测oar-miR-127和转录因子FOXO4的结合位点,以分数为评判依据进行结合位点的筛选。
1.4.2FOXO4过表达载体构建 在Ensembl中下载绵羊FOXO4的CDS区序列,利用重组臂技术将目的片段(完整编码区)连接至pcDNA3.1(+)质粒。利用限制性内切酶Hind Ⅲ和XbaⅠ双酶切pcDNA3.1(+)过表达载体,胶回收纯化,使用T4连接酶(北京全式金生物技术有限公司)在4 ℃条件下将目的条带与酶切产物连接10 min,目的片段与酶切产物质量比为1∶6,连接产物转化至感受态细胞Trans5α,过夜培养,利用SalⅠ酶切和测序筛选阳性克隆。
1.4.3 miR-127启动子区荧光素酶报告载体构建 选取miR-127启动子区包含转录因子FOXO4结合位点长度为600 bp的目的片段(-1 401~-2 000 bp)。 利用MluⅠ和Hind Ⅲ酶切pGL3-basic载体,胶回收纯化,将目的条带与酶切产物用T4连接酶在4 ℃条件下连接10 min,转化至感受态细胞Trans5α,过夜培养,利用酶切(HpaⅠ、HindⅢ)和测序筛选阳性克隆。
1.5 靶基因FOXO4的3′-UTR miR-127结合位点预测与荧光素酶报告载体构建
利用TargetScan在线预测靶基因结合位点,选取包含miR-127结合位点长度为70 bp的FOXO4基因序列,在序列两端添加SacⅠ、XbaⅠ酶切位点(表2)。将两条链按照如下体系进行退火:FOXO4 3′-UTR正义链、反义链各10 μL,反应条件为95~25 ℃温度梯度,每个梯度相差5 ℃,反应时间为2 min。利用SacⅠ酶和XbaⅠ酶对pmir-GLO质粒进行双酶切,利用胶回收试剂盒回收纯化酶切产物。利用T4连接酶在4 ℃条件下连接10 min, 转化至感受态细胞,过夜培养后挑选菌落,利用PCR扩增和测序筛选阳性克隆。
1.6 293T和绵羊卵泡颗粒细胞转染及双荧光素酶活性检测
1.6.1 293T细胞转染 选取对数期的293T细胞,按1.6×105个·孔-1接种于24孔细胞培养板中,过夜培养,待细胞汇合度达80%~90%时进行转染。共转染miR-127 mimic、mimicNC和FOXO4野生型质粒、突变型质粒、缺失型质粒(0.5 μg DNA,1.0 μL P3000TM,1.5 μL LipofectamineTM 3000),每组设3个重复孔,转染48 h后收集细胞进行荧光素酶的活性检测。pcDNA3.1-FOXO4重组质粒与pGL3-basic(miR-127)的共转染方法同上。
1.6.2 绵羊卵泡颗粒细胞转染 将在体外培养的绵羊卵泡颗粒细胞按1.6×105个·孔-1接种于24孔细胞培养板中,过夜培养。细胞汇合度达80%~90%时,利用HiPerFect Transfection Reagent将miR-127 mimic(50 nmol·L-1)、mimic NC(50 nmol·L-1) 转染绵羊颗粒细胞(30 μL Optim-MEM,1.25 μL mimic/2.5 μLmimic NC,3 μL HiPer- Fect Transfection Reagent),每组设3个重复孔,处理48 h后收集细胞进行RNA提取和反转录。转录因子FOXO4 过表达载体转染绵羊卵泡颗粒细胞步骤同“1.6.1”。
1.6.3 荧光素酶活性检测 转染48 h后,将细胞收集于EP管中,用GloMax Multi Jr单管多功能检测仪(Promega,美国)检测荧光素酶活性,每管添加100 μL Stop & Glo Reagent,检测海肾荧光素酶活性,重复检测3次,计算萤光虫荧光素酶与海肾荧光素酶活性比值。
1.7 qPCR检测miR-127及相关基因表达
miR-127及mRNAs均按以下反应体系和条件进行设置,每个样品设3个技术重复。qRT-PCR扩增体系为:cDNA 1 μL,上、下游引物各0.4 μL (10 pmol·L-1), Super Evagreen®qPCR Master Mix(Biotium,美国) 10 μL,ROX(100×) 3 μL,水5.2 μL。扩增条件为:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 30 s,共40个循环。利用2-△△Ct方法计算目的基因的相对表达量,miRNA表达量计算以U6为内参,mRNAs表达量计算以GAPDH为内参。
1.8 统计分析
数据使用GraphPad Prism8软件进行作图分析,采用独立样本t检验比较两组间基因表达量的差异,利用单因素方差分析相对荧光素酶活性,使用Duncan’s多重极差检验法进行多重比较,P<0.05为差异显著。
2 结 果
2.1 载体的构建
2.1.1 转录因子FOXO4过表达载体的酶切验证 利用SalⅠ酶对转录因子FOXO4与过表达载体(pcDNA3.1+)的重组质粒进行单酶切,如图1所示,酶切片段大小均符合目的片段的长度;将测序结果与目的片段序列进行比对,发现序列一致并无突变,说明质粒可进行下一步试验。
2.1.2 miR-127启动子区荧光素酶报告载体酶切验证 利用HpaⅠ和Hind Ⅲ酶对miR-127启动子区片段与pGL3-basic的重组质粒进行双酶切,酶切片段大小与目的片段长度相符(图2),将测序结果与目的片段序列比对发现序列完全一致,说明重组质粒构建成功。
2.1.3FOXO4基因3′-UTR区结合位点荧光素酶报告载体构建 在线预测的绵羊miR-127与FOXO4基因3′-UTR二者的结合位点见图3。依据该结合位点利用pmir-GLO载体构建FOXO4基因3′-UTR野生型、突变型和缺失型重组质粒。分别培养其单克隆菌,利用PCR鉴定阳性菌落,挑选符合目的片段大小的菌落扩增后进行序列测定。测序结果与原序列进行比对(图4),序列无突变,表明载体构建成功。
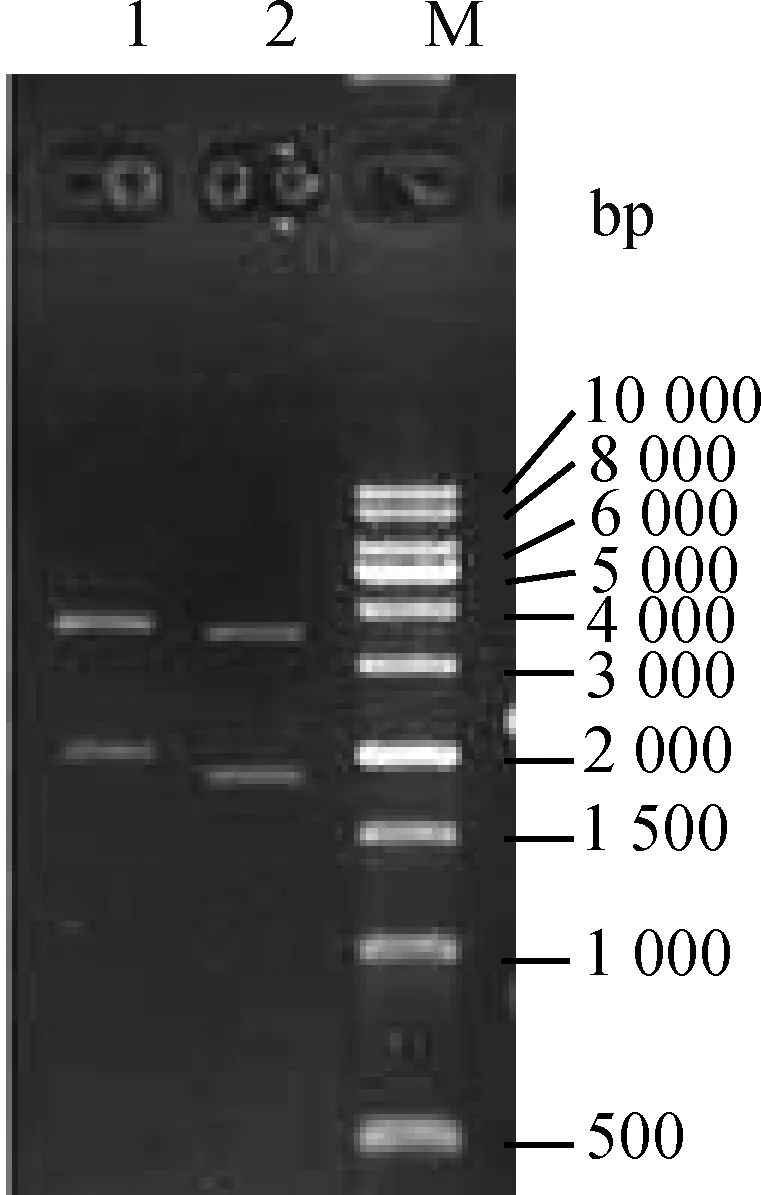
1.未酶切的pGL3-basic质粒;2.使用Hpa Ⅰ和Hind Ⅲ双酶切重组质粒1. Undigested pGL3-basic plasmid; 2. Double digested recombinant plasmid with Hpa Ⅰand Hind III图2 miR-127启动子区荧光素酶报告载体重组质粒酶切电泳图Fig.2 Enzyme digestion electrophoresis diagram of the recombinant plasmid of the luciferase reporter vector in the promoter region of miR-127
2.2 绵羊miR-127与FOXO4基因的相互作用
2.2.1 转录因子FOXO4对miR-127启动子转录活性及其表达水平的影响 利用JASPAR软件预测并通过评分筛选,miR-127启动子区与转录因子FOXO4的结合位点为GTGAACA,详见表3。转录因子FOXO4过表达载体pcDNA3.1(+)和miR-127启动子区重组质粒pGL3-miR-127共转染293T细胞。如图5所示,pGL3-miR-127+pcDNA3.1-FOXO4组荧光素酶活性值显著低于pGL3-miR-127+ pcDNA3.1组(P<0.05,图5A),表明转录因子FOXO4负调控miR-127的表达。将FOXO4过表达载体pcDNA3.1(+)和pcDNA3.1质粒分别转染颗粒细胞,pcDNA3.1-FOXO4组 miR-127的表达水平显著低于pcDNA3.1组(P<0.05,图5B),表明转录因子FOXO4抑制了miR-127的表达。

图3 miR-127与FOXO4基因3′-UTR的结合位点Fig.3 The binding sites of miR-127 and FOXO4 3′-UTR

图4 FOXO4重组质粒序列比对图Fig.4 Alignment of recombinant plasmid sequence of FOXO4

表3 miR-127启动子区与转录因子FOXO4预测结合位点

A.FOXO4过表达载体转染293T细胞后荧光素酶活性值;B.FOXO4过表达载体转染绵羊卵泡颗粒细后miR-127的相对表达量。*. P<0.05,下同A. Luciferase activity value after FOXO4 overexpression vector transfected into 293T cells; B. Relative expression level of miR-127 after FOXO4 overexpression vector transfected into ovine follicular granulosa cells. *. P<0.05, the same as below图5 相对荧光素酶活性和miR-127的相对表达量Fig.5 Relative luciferase activity and relative expression of miR-127
2.2.2 绵羊miR-127与基因FOXO4间的靶向关系验证 绵羊卵泡颗粒细胞中过表达miR-127后,FOXO4的表达量极显著降低(P<0.01,图6A)。为进一步验证FOXO4与miR-127的靶向关系,进行了双荧光素酶报告试验。结果显示,与共转染mimic NC+FOXO4-WT野生型载体组相比,共转染miR-127 mimic+FOXO4-WT野生型载体组的293T细胞中荧光素酶活性显著降低(P<0.05,图6B),表明miR-127可以靶向结合FOXO4 3′-UTR序列,抑制FOXO4基因的表达;分别与共转染mimic NC+FOXO4-MUT突变型和共转染mimic NC+FOXO4-DEL缺失型载体组相比,共转染miR-127 mimic+FOXO4-MUT突变型和共转染miR-127 mimic+FOXO4-DEL缺失型载体组的荧光素酶活性均无显著差异(P>0.05,图6B),表明FOXO4 3′-UTR序列的突变和缺失均能消除miR-127对FOXO4基因的抑制作用,进一步表明miR-127可以靶向结合FOXO4基因3′-UTR序列,并抑制FOXO4基因的表达。
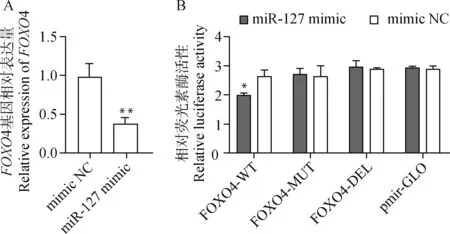
A. miR-127 mimic 或mimic NC转染绵羊卵泡颗粒细胞后FOXO4基因的相对表达量;B. miR-127 mimic、mimic NC分别与FOXO4野生、突变、缺失型质粒共转染293T细胞后相对荧光素酶活性A. Relative expression of FOXO4 gene after miR-127 mimic or mimic NC transfected into sheep follicular granulosa cells; B. The relative luciferase activity of miR-127 mimic, mimic NC and FOXO4 wild, mutant, and deletion plasmids transfected into 293T cells图6 相对荧光素酶活性和FOXO4基因的相对表达量Fig.6 Relative luciferase activity and relative expression of FOXO4 gene
2.3 oar-miR-127对凋亡基因Casp3和Bax表达水平的影响
为探究miR-127对绵羊卵泡颗粒细胞凋亡的影响,转染miR-127后检测凋亡基因Casp3和Bax的mRNA表达变化。结果如图7所示,与mimic NC组相比,miR-127 mimic能极显著上调Casp3和Bax基因的表达(P<0.001)。
2.4 过表达转录因子FOXO4对细胞凋亡基因表达水平的影响
实时荧光定量PCR检测过表达转录因子FOXO4的绵羊卵泡颗粒细胞中凋亡基因Casp3、Bax和BCL2的mRNA表达水平(图8)。结果显示,转染过表达转录因子FOXO4后,Casp3和Bax基因相对表达量与转染pcDNA3.1相比没有显著差异(P>0.05),但BCL2基因相对表达量与转染pcDNA3.1相比显著降低0.4倍(P<0.05)。

A. 凋亡基因Casp3相对表达量;B. 凋亡基因Bax相对表达量。***.P<0.001A. Relative expression of apoptosis gene Casp3; B. Relative expression of apoptosis gene Bax. ***.P<0.001图7 转染miR-127颗粒细胞凋亡基因Casp3和Bax的表达水平Fig.7 Relative expression level of apoptosis genes Casp3 and Bax in granulosa cells
3 讨 论
绵羊卵泡的发育与颗粒细胞增殖、凋亡密切相关[18]。卵泡的成熟过程中,大约99%的卵泡被淘汰而产生闭锁,卵巢颗粒细胞是影响卵泡发育的重要“中介”,颗粒细胞凋亡会直接导致卵泡闭锁,进而影响生殖功能[19]。miRNA在调节颗粒细胞凋亡中发挥重要作用[15]。对oar-miR-127进行研究发现,转录因子FOXO4与miR-127的启动子区结合,抑制了miR-127的表达;miR-127与靶基因FOXO4的3′-UTR区结合,抑制绵羊卵泡颗粒细胞中FOXO4基因的表达,并促进了细胞凋亡,明确了miR-127在卵泡颗粒细胞中的作用,间接表明miR-127通过靶向FOXO4可能促进卵泡颗粒细胞的凋亡,为阐明miR-127和FOXO4调控卵泡闭锁机理提供了一定的理论依据。miR-127是内源性具有调控功能的非编码RNA[20],不同组织中miR-127的表达量不同,其在骨关节炎软骨细胞中的表达显著低于正常软骨细胞,miR-127靶向下调adipoR1基因的表达,促进了软骨细胞的增殖[21]。miR-127-3p可直接靶向于Ddit3基因的CDS区域,调控靶基因表达,显著促进葡萄膜黑色素瘤细胞分化[22];miR-127-5p特异性结合IRAK4,负调控其表达,诱导了肺炎链球菌肺泡上皮细胞凋亡[23],miR-127-3p靶向下调MAPK4基因表达来抑制葡萄膜黑色素瘤细胞增殖、迁移和侵袭,诱导细胞凋亡[24]。miR-96-5p通过靶向FOXO4抑制高糖诱导的大鼠视网膜血管内皮细胞凋亡并促进细胞增殖[10],表明了miRNA可以通过靶向FOXO4调控细胞的增殖和凋亡。FOXO4是叉头框转录因子家族成员之一[25-26],能够加速细胞集落的衰老,通过抑制细胞的凋亡进而维持人脐带间充质干细胞的活力和功能[27]。miR-421通过抑制FOXO4基因的表达进而抑制致鼻咽癌细胞的增殖和凋亡[28];FOXO4在人黄素化的壁颗粒细胞中表达[29],表明其参与卵泡发育和黄体生成过程,在卵泡颗粒细胞凋亡过程中起着重要的调控作用,但有关FOXO4在卵泡颗粒细胞中作用的相关报道较少,其对绵羊卵泡颗粒细胞的作用机理和卵泡闭锁的影响还需要深入研究。miR-128-3p通过抑制FOXO4和MMP9的表达来抑制血管平滑肌细胞的增殖和迁移[30]。
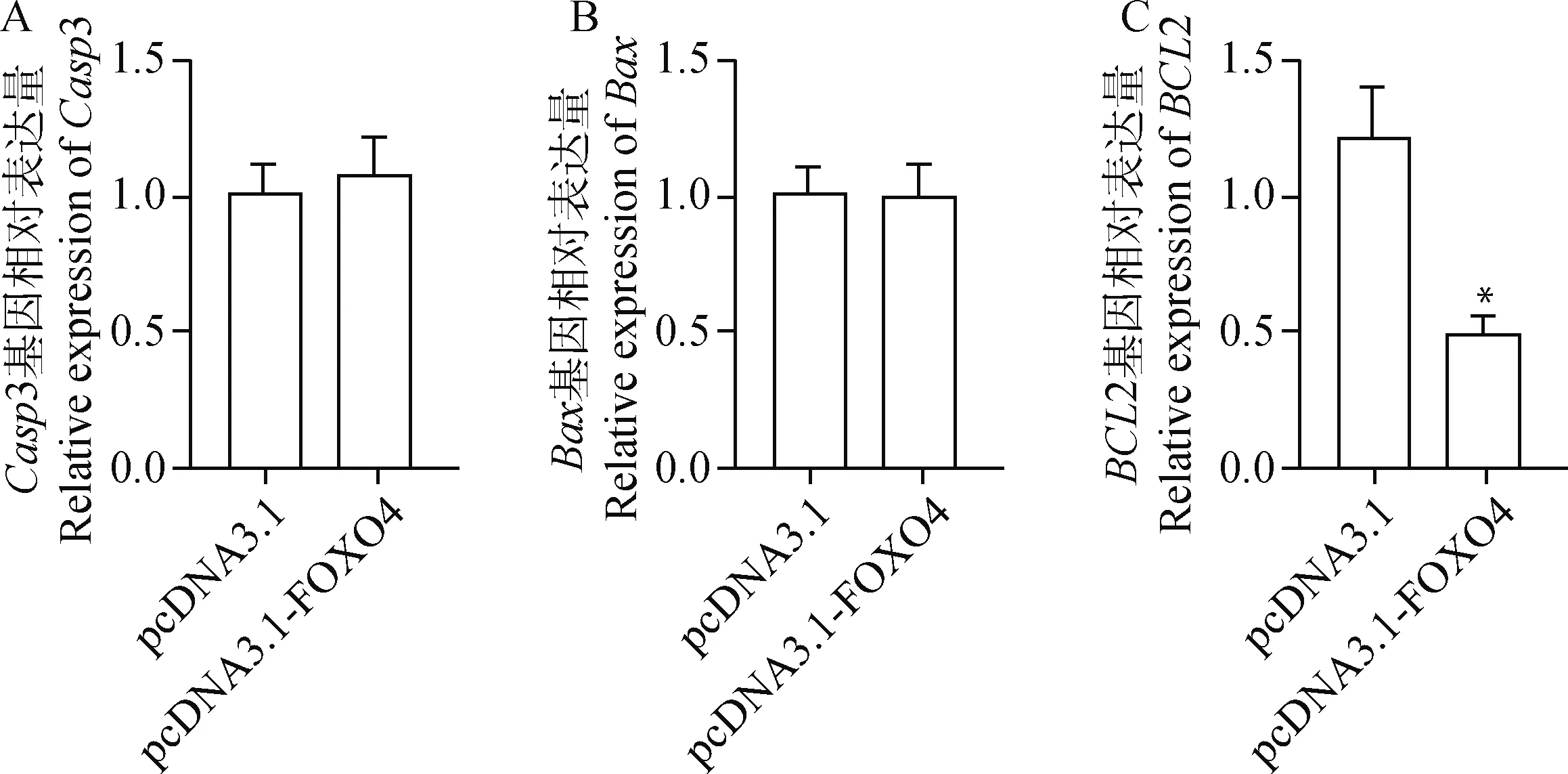
A、B、C.表示过表达转录因子FOXO4后凋亡基因Casp3、Bax和BCL2相对表达量A, B, C. Represent the relative expression levels of apoptosis genes Casp3, Bax and BCL2 after overexpression of transcription factor FOXO4, respectively图8 过表达转录因子FOXO4颗粒细胞中凋亡基因的表达水平Fig.8 The expression level of apoptotic genes in granulosa cells with overexpressed transcription factor FOXO4
4 结 论
本试验证实了绵羊miR-127与转录因子FOXO4之间存在反馈抑制环路。此外,FOXO4通过下调抑凋亡基因BCL2的表达,miR-127通过上调促凋亡基因Casp3和Bax的表达,促进绵羊卵泡颗粒细胞的凋亡。
