弓形虫卵囊感染小鼠的急性期与慢性期的脑组织蛋白质组变化
2022-03-08贺君君朱兴全
付 明,贺君君,朱兴全,丛 伟*
(1. 山东大学海洋学院,威海 264209; 2. 中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室,兰州 730046; 3. 山西农业大学动物医学学院, 太谷 030801; 4. 云南农业大学动物医学院,云南省高校兽医公共卫生重点实验室,昆明 650201)
弓形虫是一种呈全球性分布的细胞内寄生原虫,全世界约有三分之一的人口感染弓形虫[1],我国居民弓形虫感染率约为8%,而一些欧美国家弓形虫感染率更高[2-3]。弓形虫可以感染几乎所有温血动物[4],在宿主中速殖子是急性感染期间的标志,一旦速殖子受到来自宿主免疫反应的压力,就会分化为缓殖子并在宿主多种组织中以包囊形式长期存在而不表现明显的临床症状,表现为慢性感染[1]。弓形虫感染对于免疫功能低下患者或受损个体可能具有致命性[5],潜伏感染可能被重新激活,这种再激活通常表现为弓形虫脑炎[6]。
猫科动物是弓形虫唯一的终末宿主,感染弓形虫的猫科动物通过一次粪便排泄可向环境中释放大量卵囊,在适宜条件下可发育为感染性极强的孢子化卵囊,且在不利的环境中仍能保持较长时间的感染能力[7-8]。据调查,人急性弓形虫病与环境弓形虫卵囊污染密切相关,主要是由孢子化卵囊污染环境水源、土壤引起[9]。与弓形虫包囊(缓殖子)和假包囊(速殖子)相比,卵囊污染已成为水源性和食源性弓形虫感染的主要因素[10-11]。弓形虫感染被认为是对牲畜业造成经济影响的一个重要原因[12-13],尤其是猪等杂食性动物,在中国,母猪弓形虫感染造成的流产现象比较普遍,可能会导致巨大的经济损失[14]。而生食或食用未煮熟的被感染动物的肉类被认为是人感染弓形虫的主要来源之一。
弓形虫具有独特的协调宿主基因表达与逃避宿主免疫防御机制的能力,以便更好地建立急性或慢性感染[15],而蛋白质组学对于揭示不同阶段弓形虫感染和对宿主细胞的机制研究具有重要意义[16],iTRAQ技术结合2D-LC-MS/MS分析已广泛用于病原体与宿主相互作用的组学研究。采用该项技术,Yang等[17]分析了弓形虫包囊慢性感染对野生型和CD44小鼠脑组织蛋白的表达情况;Zhou等[18]进行了弓形虫卵囊孢子化过程的蛋白质组学研究;Wang等[19]研究了弓形虫不同发育阶段的蛋白表达情况。这也表明蛋白质组学技术可能是进一步阐明弓形虫持续存在的许多未知因素的最佳方法[20]。
弓形虫感染的严重程度与环境因素、宿主遗传学特点、弓形虫虫株、感染期间虫体所处阶段以及感染途径等有关[20]。迄今为止,对于弓形虫虫体本身及弓形虫包囊以及速殖子感染宿主相关的蛋白质组学研究相对较多[17,21-22],但缺少弓形虫卵囊感染对宿主蛋白质组影响的研究。因此本试验利用iTRAQ技术对弓形虫PRU株卵囊急、慢性感染对小鼠脑组织蛋白组的影响展开研究,并对差异表达蛋白进行功能分析。这些发现将有助于了解弓形虫脑炎的发病机制,并有助于发现弓形虫脑病新的诊断、预防、控制和治疗方法。
1 材料与方法
1.1 实验动物及虫株
SPF级6~8周龄雌性BALB/c小鼠购自兰州大学实验动物中心。1只10周龄的中国狸花猫(Chinese Li Hua Mao),购自兰州雁滩花鸟市场,经间接血凝试验(IHA)和改良凝集试验(MAT)检测[23],呈弓形虫抗体阴性。弓形虫Ⅱ型PRU株系由本实验室经小鼠传代保存。
1.2 主要试剂及仪器
Bradford 蛋白定量试剂盒(Bio-Rad)、iTRAQ®Reagents Multiplex Kit(Sigma)、质谱级胰酶(Promega)、L-3000 HPLC(RIGOL)、EASY-nLCTM1200 纳升级 UHPLC(Thermo)、Q ExactiveTM HF-X 质谱仪(Thermo)、C18除盐柱(Thermo)、RT-6100 酶标仪(雷杜)、3k超滤管(Millipore)、组织研磨仪(上海净信)、超声波细胞破碎仪(宁波新芝)。
1.3 卵囊的制备与收集
弓形虫PRU虫株感染小鼠制备包囊,含100个PRU株包囊的小鼠脑组织研磨液饲喂小猫。饲喂后第3天起对猫粪便进行显微镜检查,检测到卵囊后,收集粪便,利用蔗糖浮选和氯化铯梯度离心法对卵囊进行分离纯化[18,24]。将纯化过的卵囊360 r·min-1离心后,置于2 mL·L-1硫酸中悬浮,室温下摇床摇动7 d,获得孢子化(即感染性)的卵囊。用0.85 mL·L-1生理盐水洗涤2次,2 mL·L-1硫酸悬浮。最后,对卵囊计数,调整为每毫升PBS含100个卵囊, 4 ℃保存备用[25]。
1.4 弓形虫卵囊感染及小鼠脑组织收集
12只SPF 6~8周龄雌性BALB/c小鼠,随机分为4组,每组3只。随机选择其中两组,1 mL PBS(含100个孢子化卵囊) 灌胃感染,另外两组为对照组,1 mL PBS缓冲液灌胃。在感染后的第11和33天[26-29],麻醉处理后,无菌采集脑组织,使用TIANamp Genomic DNA kit (TianGenTM, Beijing, China) 提取脑组织基因组DNA,-20 ℃保存,利用弓形虫B1基因经PCR扩增进一步证实脑组织中弓形虫的存在,最后样品经瞬时液氮冷冻后转移至—80 ℃冰箱保存,用于蛋白质组学研究。
1.5 蛋白质抽提及定量
样品低温条件研磨成粉,迅速转移至离心管(经液氮预冷),加入蛋白质裂解液(50 mmol·L-1Tris-HCl、8 mol·L-1尿素、0.2 mL·L-1SDS,pH=8),振荡混匀,冰水浴超声5 min。充分裂解后,4 ℃、12 000 r·min-1离心15 min。取上清加入终浓度2 mmol·L-1二硫苏糖醇,56 ℃反应1 h后,加入足量碘乙酸,室温避光反应1 h。离心管中加入4倍体积的丙酮(经-20 ℃预冷),-20 ℃条件下进行沉淀(不少于2 h),4 ℃、12 000 r·min-1离心15 min收集沉淀。再加入1 mL 经-20 ℃预冷处理过的丙酮,重新悬浮并清洗沉淀后,4 ℃、12 000 r·min-1离心15 min,收集沉淀,风干,加入蛋白溶解液(8 mol·L-1尿素、100 mmol·L-1TEAB,pH=8.5)溶解蛋白沉淀。将抽提出来的蛋白按照Bradford 蛋白质定量试剂盒说明书的要求进行蛋白定量。
1.6 样品的酶解、iTRAQ标记蛋白及HPLC分级
每个样品各取100 μg蛋白,加入蛋白溶解液定容至100 μL,分别加入1 μg·μL-1胰酶2 μL和100 mmol·L-1TEAB缓冲液500 μL,混匀,37 ℃酶切过夜。再加等体积的1 mL·L-1甲酸,混匀,室温条件下,12 000 r·min-1离心 5 min。将上清通过C18除盐柱处理后,清洗洗脱,洗脱样合并后冻干。加入 0.5 mol·L-1TEAB缓冲液20 μL复溶,并加入足量 iTRAQ 标记试剂(溶于异丙醇)混匀,室温反应1 h。标记采用8-plex 标记,方法参考 iTRAQ试剂盒操作说明。配制流动相 A 液(2 mL·L-1乙腈,氨水调至 pH=10),使用1 mL A液溶解标记后的混合样品粉末,室温下12 000 r·min-1离心10 min, 取1 mL体积上清进样。使用L-3000 HPLC系统,色谱柱为XBridge Peptide BEH C18(25 cm×4.6 mm, 5 μm),进行HPLC分级。
1.7 液相色谱-串联质谱分析、差异蛋白筛选及生物信息学分析
每个馏分上清各取 2 μg进样,液质检测。使用 EASY-nLCTM1200 纳升级 UHPLC 系统,按仪器说明进行液相色谱洗脱。使用 Q ExactiveTM HF-X 质谱仪进行质谱序列测定,生成质谱检测原始数据(raw文件)。将下机后的raw文件直接导入到Proteome Discoverer2.2软件进行数据库检索,谱肽、蛋白定量。按差异倍数FC(Fold Change)筛选差异表达蛋白,其中,FC≥1.5且P≤0.05为上调表达蛋白,FC≤0.83且P≤0.05为下调表达蛋白。利用Gene Ontology数据库(http://www.geneontology.org/)对筛选到的差异表达蛋白进行GO功能富集分析。同时,利用 KEGG (kyoto encyclopedia of genes and genomes) 数据库进行差异蛋白通路富集分析。最后利用STRING(https://string-db.org/)获取蛋白互作数据,使用Cytoscape3.7.2进行蛋白互作分析。
2 结 果
2.1 差异表达蛋白的筛选
依据FC≥1.5 或者≤0.83 倍,P≤0.05 的筛选条件,在急性感染阶段,共筛选出85个差异表达蛋白,其中,30个上调表达,55个下调表达。在慢性感染阶段,共筛出51个差异表达蛋白,其中47个上调表达,4个下调表达。而慢性感染阶段与急性感染阶段相比,共有114个差异表达蛋白,其中,71个上调表达,43个下调表达(图1)。相关蛋白组数据已通过iProX[30]上传ProteomeXchange,获得的接收编号为IPX0002989000/PXD025815。
2.2 差异蛋白的GO功能富集分析
对弓形虫卵囊急慢性感染小鼠脑组织鉴定到的差异蛋白进行GO分析(图2)可以发现,在弓形虫卵囊急性感染期,差异表达蛋白在生物过程排在首位的为运输(transport),差异蛋白主要表现为下调表达;而慢性感染中免疫系统过程(immune system process)排在首位,表现上调表达。在细胞组分中,排在首位的均为生物膜(membrane),分别表现为下调和上调。在分子功能中,排在首位的分别为离子跨膜转运蛋白活性(ion transmembrane transporter activity)和小分子结合(small molecule binding),分别表现为下调和上调。
与急性感染相比,慢性感染小鼠脑组织差异表达蛋白在生物过程、细胞组分和分子功能主要在调节细胞内信号转导(regulation of intracellular signal transduction)、质膜蛋白复合物(plasma membrane protein complex)、半胱氨酸型肽酶活性(cysteine-type peptidase activity)方面表现出差异。
2.3 差异表达蛋白的KEGG通路分析
对于弓形虫卵囊急性感染小鼠,在85个差异表达蛋白中,有59个蛋白被注释,共涉及115条通路。慢性感染小鼠的51个差异表达蛋白中,有38个蛋白被注释,共涉及56条通路。弓形虫慢性感染与急性感染相比,在114个差异表达蛋白中,有79个蛋白被注释,共涉及103条通路。
对差异表达蛋白进行KEGG通路分析(图3),相同的路径富集主要集中在同种异体移植排斥(allograft rejection)、抗原处理和呈递(antigen processing and presentation)、自身免疫性甲状腺疾病(autoimmune thyroid disease)、移植物抗宿主病(graft-versus-host disease)、单纯疱疹病毒感染(herpes simplex infection)、弓形虫病(toxoplasmosis)、Ⅰ型糖尿病(Type I diabetes mellitus)、病毒性心肌炎(viral myocarditis),这些通路多与机体免疫应答过程相关。在弓形虫急性感染期,其他路径包括钙信号通路(calcium signaling pathway)、系统性红斑狼疮(systemic lupus erythematosus)等通路相关蛋白也表现差异性表达。在慢性感染期,与原发性免疫缺陷(primary immunodeficiency)、肺结核(tuberculosis)等相关通路蛋白表现出特异性表达。急慢性感染相比多种信号通路相关蛋白表达呈现特异性,如甲状腺激素信号通路(thyroid hormone signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)。
2.4 差异表达蛋白的互作分析
急性感染小鼠脑组织差异蛋白互作分析(图4)发现,信号传导及转录激活蛋白1(Stat1)处于作用网络中心,与干扰素-γ(IFN-γ)诱导的GTP酶(Igtp、Iigp1)、免疫相关的GTP酶(Irgm1、Irgm2)、鸟苷酸结合蛋白(Gbp2、Gbp6)、β-2-微球蛋白(B2 m)等上调表达蛋白及血清白蛋白(Alb)等下调表达蛋白具有相互作用。慢性感染期间,绝大多数蛋白均表现出上调表达,蛋白酶体亚基(Psmb8)处于网络中心,除与Stat1、Igtp、Irgm1、Irgm2、Gbp2等具有相互作用外,还与泛素蛋白(Isg15)、干扰素-γ诱导蛋白(Ifi47、Ifit3)等具有相互作用。
慢性与急性感染小鼠脑组织差异蛋白互作分析发现,干扰素-γ诱导蛋白(Ifi47)处于作用网络中心,与Stat1、Isg15、Irgm2、Irgm1、Iigp1、Psbm10、B2m、胞嘧啶单磷酸激酶2(Cmpk2)等上调表达蛋白及囊泡相关蛋白(Vta1)等下调表达蛋白具有相互作用。
3 讨 论
作者应用iTRAQ技术结合2D-LC-MS/MS,对弓形虫PRU株卵囊感染后11和33 d的小鼠大脑差异表达的蛋白进行了GO功能富集、KEGG通路分析以及蛋白质相互作用(PPI)网络分析。多数差异表达蛋白都参与代谢、细胞结构、信号转导和免疫反应等过程。KEGG路径分析表明,多数差异表达蛋白与机体免疫应答过程相关。
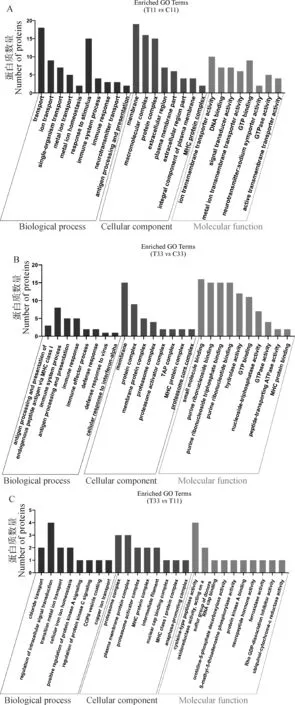
A. 急性感染;B. 慢性感染;C. 慢性vs 急性感染A. Acute infection; B. Chronic infection; C. Chronic infection vs Acute infection图2 弓形虫卵囊急慢性感染阶段脑组织差异蛋白进行GO分类富集分析Fig.2 The GO classification enrichment analysis of all DEPs of mouse brain infected with Toxoplasma gondii oocysts
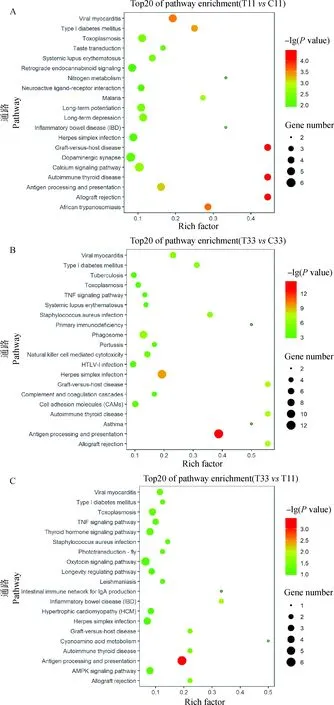
A. 急性感染 B.慢性感染 C. 慢性vs 急性感染A. Acute infection; B. Chronic infection; C. Chronic vs Acute infection图3 弓形虫卵囊急慢性感染小鼠脑组织差异表达蛋白KEGG通路分析(top20)Fig.3 KEGG pathway analysis of all DEPs of mouse brain infected with Toxoplasma gondii oocysts (top20)
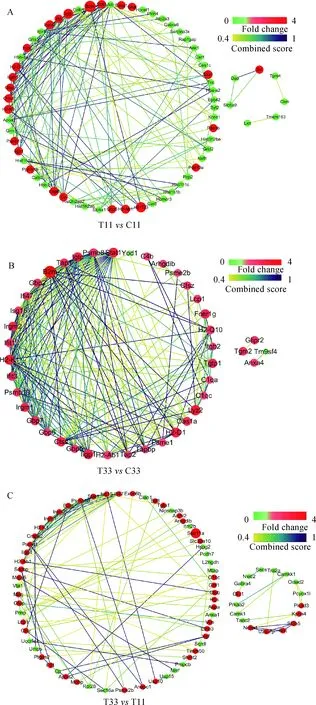
A. 急性感染 B.慢性感染 C. 慢性vs 急性感染A. Acute infection; B. Chronic infection; C. Chronic vs Acute infection图4 弓形虫卵囊急慢性感染小鼠脑组织差异表达蛋白互作网络Fig.4 Interaction network of all DEPs of mouse brain infected by Toxoplasma gondii oocysts
与弓形虫PRU株包囊感染相比,卵囊感染有多种蛋白呈现相同的表达趋势,如包囊感染14 d泛素C末端水解酶L1(Uchl1)与卵囊慢性感染中均表现下调表达,包囊感染21 d鸟嘌呤核苷酸结合蛋白α-1亚基与卵囊急性感染中鸟嘌呤核苷酸结合蛋白α-2亚基均呈现上调表达[26]。而卵囊急性感染期丝氨酸蛋白酶抑制剂(Serpin A3k)(见图4A)下调表达,在包囊感染7、14以及21 d,该蛋白呈现持续上调表达[26]。多种丝氨酸蛋白酶抑制剂具有免疫调节特性,如阻止核因子(NF-κB)激活来抑制炎症反应[31],可见Serpin A3k在卵囊急性感染期的低表达与诱导宿主免疫增强来抵抗弓形虫感染有关。此外蛋白酶体活化复合物3(Psme3)在包囊感染7及14 d均下调表达,而在卵囊慢性感染期psme1呈上调表达。此外在包囊感染中有多种差异表达蛋白在卵囊感染中未检测到,如蛋白Lmnb1、Eif1a、Cops4等[26]。可见弓形虫包囊感染与卵囊感染具有差异性。
弓形虫卵囊急慢性感染期间免疫应答效应显著增强。IFN-γ是弓形虫感染后产生的重要细胞因子[32],在感染弓形虫的细胞中强烈刺激细胞引发自主免疫,其诱导的效应物如IFN诱导的GTP酶、诱导型一氧化氮合酶等在抑制弓形虫生长及其在细胞自主免疫反应中起重要作用[33]。IFN-γ诱导宿主防御弓形虫的效应机制是研究热点之一,从感染初期直到慢性感染,多种与IFN-γ相关的蛋白表达量随之增加以应对感染,如Gbp2、Gbp2b、Gbp5、Gbp6、Gbp7等均上调表达,这与Hu等[25]的结果一致。p65鸟苷酸结合蛋白(GBPs) 是GTP酶家族四个成员之一[34],其中小鼠鸟苷酸结合蛋白家族(mGBPs)是由炎症细胞因子IFN-γ诱导的,并已被证明是诱发自主免疫抵抗弓形虫感染的重要物质[35]。Degrandi等[36]证实mGBP2是介导寄生虫抗性的基本免疫效应分子,能积聚在寄生虫的质膜上进而破坏了寄生虫的完整性。相关研究结果表明mGBPs对弓形虫的抗性可能与其在纳空泡膜(PVM)中积累和破坏囊泡完整性有关[37-38]。
作为GTP酶的Irgm1、Irgm2、Igtp、ligp1、Tgtp1等蛋白在小鼠脑组织中上调表达,这与Hu等[25]的试验结果一致。GBP含有一个保守的GTP酶结构域,储存于正常细胞中,一旦受到弓形虫感染便可迅速定位到囊泡上,并在囊泡上形成聚合体对弓形虫囊泡结构造成破坏。GTP的水解为这一聚合过程及这一过程的化学修饰提供能量,这可以解释GBP与GTP酶同时表达上调的现象。
卵囊急性感染阶段小鼠脑组织细胞能量供代谢受抑制。肌酸激酶(Ckm)在所有脊椎动物中都存在,可催化肌酸和ATP的可逆反应,形成磷酸肌酸和ADP[39],在能量传导以及间歇性高能量需求细胞的能量平衡中起着重要作用[40]。在弓形虫急性感染阶段,肌酸激酶呈下调表达,这与周永华等[41]的研究结果一致。此外急性感染小鼠脑组织中血红蛋白(Hbb-b1和Hba-a2)的合成受抑制,这将导致氧气从肺部到脑组织的输送效率降低,导致脑部组织能量供应受阻以及脑组织细胞内环境pH的改变。碳酸酐酶 8 (Car8) 是三磷酸肌醇受体 1 (ITPR 1) 的变构抑制剂,可调节细胞内钙的释放,对关键细胞功能如线粒体能量产生中至关重要[42],在急性感染中Car8呈下调表达。
免疫相关基因的转录水平在弓形虫卵囊急、慢性感染中被显著上调。Stat1和IFN-γ的活性对于调控弓形虫急、慢性感染是必不可少的[43]。IFN-γ主要通过JAK/STAT1信号通路激活基因表达[44],Stat1可以在IFN-γ存在的条件下被磷酸化,进而形成二聚体迁移至细胞核,在细胞核中激活抗病原体相关基因的转录[45]。弓形虫效应体TgIST运输到宿主细胞核后通过将抑制性Mi-2/NuRD复合物募集到染色质上的Stat1来阻断Stat1的转录来适时抵抗宿主的防御[46-47]。试验结果表明在弓形虫卵囊急慢性感染中Stat1均上调表达,这也与弓形虫急性和慢性感染GO富集及KEGG通路富集结果相吻合。
4 结 论
对弓形虫PRU株卵囊急慢性感染小鼠后脑组织差异表达蛋白进行分析,在急性感染期小鼠脑组织能量代谢受到明显抑制,慢性感染期小鼠免疫应答变得十分强烈,这与Ckm 的下调及mGbp2、Irgm1、Irgm2、Igtp的上调表达相关。结果表明多种与免疫相关的蛋白显著上调,可见机体抗弓形虫的生理过程是在多种蛋白协同下完成的,本研究将为弓形虫脑病的研究及弓形虫卵囊感染的致病机制研究提供重要的参考数据。
