脓毒症患者血液激活素a,CRP,HMGB1和vWF表达水平及临床意义
2022-03-08李炳奇叶俊伟梅喜平冯辉斌鄂东医疗集团黄石市中心医院湖北理工学院附属医院重症医学科湖北黄石435000
李炳奇,叶俊伟,梅喜平,冯辉斌(鄂东医疗集团黄石市中心医院/湖北理工学院附属医院重症医学科,湖北黄石 435000)
脓毒症导致危及生命安全的器官功能损害,严重威胁患者生命健康[1]。据报道显示[2],目前临床主要通过急性生理与慢性健康评分系统Ⅱ(acute physiology andchronic health evaluation scoring system Ⅱ,APACHE Ⅱ)评分与脓毒症相关的序贯器官衰竭评估(sepsis-related organ failure assessment,SOFA)评分评估患者病情严重程度及预后,但评分系统使用过程中难免受主观或客观因素的影响,评估价值有限。近年来有关研究显示,炎症反应和血管内皮细胞(vascular endothelial cell,VEC)损伤在脓毒症发生和发展中发挥重要作用[3]。激活素a(Activin-A)具有调节细胞增殖、分化、凋亡、损伤修复等作用,近年研究发现其还可根据细胞成熟、激活、空间环境发挥促炎或抗炎作用[4]。C 反应蛋白(C-reactive protein,CRP)为临床常用炎症观测指标,当机体组织受损或出现感染时可急剧升高[5]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)可刺激多种炎性介质生成和释放,增强机体炎症反应[6]。VEC 损伤时可大量释放血管性血友病因子(von willebrand factor,vWF)入血,被认为是VEC 损伤标志物[7]。本研究就分析脓毒症患者血清Activin-A,CRP,HMGB1 和vWF水平变化,探讨其与脓毒症病情严重程度和预后的关系。
1 材料与方法
1.1 研究对象 选取2019年1月~2020年5月鄂东医疗集团黄石市中心医院收治的87 例脓毒症患者,其中男性42 例,女性45 例;年龄31~82(59.09±12.15)岁;根据病情严重程度分为两组:脓毒症组29 例,其中男性14 例,女性15 例;年龄35~77(57.34±13.20)岁;脓毒性休克组58 例,其中男性28 例,女性30 例;年龄31~82(59.97±11.61)岁。纳入标准:①符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[8]诊断标准;②患者及家属均知情研究;③临床资料完整者;④年龄≥18 岁;⑤入组前未行液体复苏等特殊治疗者。排除标准:①免疫系统疾病或长期服用免疫抑制剂者;②精神严重障碍者;③妊娠及哺乳期妇女;④各种疾病终末期;⑤原发性肝肾等脏器功能不全者;⑥放弃治疗者。另选取同期53 例健康体检者为对照组,其中男性26 例,女性27 例;年龄25~86(60.32±11.86)岁;两组一般资料比较差异无统计学意义(P>0.05)。本研究经伦理委员会批准。
1.2 仪器与试剂 多普勒超声诊断仪(深圳迈瑞生物医疗电子股份有限公司,型号:DCN2S),全自动生化分析仪(美国贝克曼库尔特有限公司,型号:AU5800),Activin-A 试剂盒(上海广锐生物科技有限公司,货号:elisa2013-10050),CRP 试剂盒(上海广锐生物科技有限公司,货号:GRZ13-118),HMGB1试剂盒(上海西格生物科技有限公司,货号:XG-E99197),vWF 试剂盒(上海瓦兰生物科技有限公司,货号:ABE10100)。
1.3 方法 收集脓毒症患者基线资料,包括性别、年龄、吸烟史、饮酒史、感染部位、并发慢性病、体温、心率、平均动脉压(mean arterial pressure,MAP)、中心静脉压(central venous pressure,CVP)、休克指数(脉搏/收缩压)、APACHE Ⅱ评分和SOFA 评分,于确诊后24h 内采集5ml 静脉血,3 000r/min 离心15min,半径10cm,全自动生化分析仪测定血乳酸(blood lactic acid,BLA)、降钙素原(procalcitonin,PCT)和清蛋白(albumin,Alb)水平,酶联吸附法测定血清Activin-A,CRP,HMGB1 和vWF水平。采集对照组5ml 清晨空腹静脉血,同脓毒症患者测定血清Activin-A,CRP,HMGB1 和vWF水平。所有脓毒症患者均根据《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[8]接受治疗,随访28 天,根据预后情况分为死亡组(n=36)和存活组(n=51)。
1.4 统计学分析 选用SPSS27.0 统计学软件,计数资料以n(%)表示,χ2检验;正态分布且方差齐计量资料以均数±标准差(±s)表示,两组间t检验。偏态分布或方差不齐计量资料以中位数(四分位间距[M(P25,P75)]表示,两组间Z检验,多组间H 检验,组间两两比较Bonferroni 法校正。相关性采用Spearman 相关性分析。多因素Logistics 回归分析脓毒症患者不良预后影响因素。ROC 曲线分析指标对脓毒症患者预后的预测价值,曲线下面积(area under curve,AUC)采用Z检验。P<0.05 为差异有统计学意义。
2 结果
2.1 脓毒性休克组、脓毒症组和对照组血清Activin-A,CRP,HMGB1,vWF水平比较 见表1。脓毒性休克组、脓毒症组、对照组血清Activin-A,CRP,HMGB1 和vWF水平比较,差异具有统计学意义(均P<0.05)。脓毒性休克组血清Activin-A,CRP,HMGB1 和vWF水平明显高于脓毒症组(Z=-3.558,-3.678,-4.178 和-3.863,均P<0.001)和对照组(Z= -8.302,-8.726,-8.935,-8.023,均P<0.001),差异具有统计学意义。脓毒症组血清Activin-A,CRP,HMGB1 和vWF水平明显高于对照组,差异具有统计学意义(Z= -6.210,-7.347,-7.356 和-5.950,均P<0.001)。

表1 脓毒性休克组、脓毒症组和对照组血清Activin-A,CRP,HMGB1 和vWF水平比较[M(P25,P75)]
2.2 脓毒症患者血清Activin-A,CRP,HMGB1 和vWF水平与APACHE Ⅱ,SOFA 评分的相关性 Spearman 相关性分析显示,脓毒症患者血清Activin-A,CRP,HMGB1,vWF水平与APACHE Ⅱ,SOFA评分呈正相关,差异具有统计学意义(APACHE Ⅱ评分:rs=0.450,0.396,0.420,0.445,均P=0.000;SOFA 评分:rs=0.442,0.381,0.395,0.434,均P=0.000)。
2.3 不同预后脓毒症患者血清Activin-A,CRP,HMGB1 和vWF水平比较 见表2。死亡组血清Activin-A,CRP,HMGB1 和vWF水平明显高于存活组,差异具有统计学意义(均P<0.05)。

表2 不同预后脓毒症患者血清Activin-A,CRP,HMGB1,vWF水平比较[M(P25,P75)]
2.4 死亡组与存活组基础资料比较 见表3。死亡组MAP,休克指数,BLA,APACHE Ⅱ评分,SOFA 评分明显高于存活组,差异具有统计学意义(均P<0.05),性别、吸烟史、饮酒史、感染部位、并发慢性病、年龄、体温、心率、CVP,PCT 及Alb 两两比较,差异均无统计学意义(均P>0.05)。

表3 死亡组与存活组基线资料比较
2.5 脓毒症患者不良预后影响因素的多因素Logistics 回归分析 见表4。以MAP,休克指数、BLA,APACHE Ⅱ评分、SOFA 评分、Activin-A,CRP,HMGB1 和vWF 为自变量,脓毒症患者预后为因变量(是=1,否=0),多因素Logistics 回归分析显示,APACHE Ⅱ评分、SOFA 评分、Activin-A,CRP,HMGB1 和vWF 为脓毒症患者不良预后独立影响因素(P<0.05)。
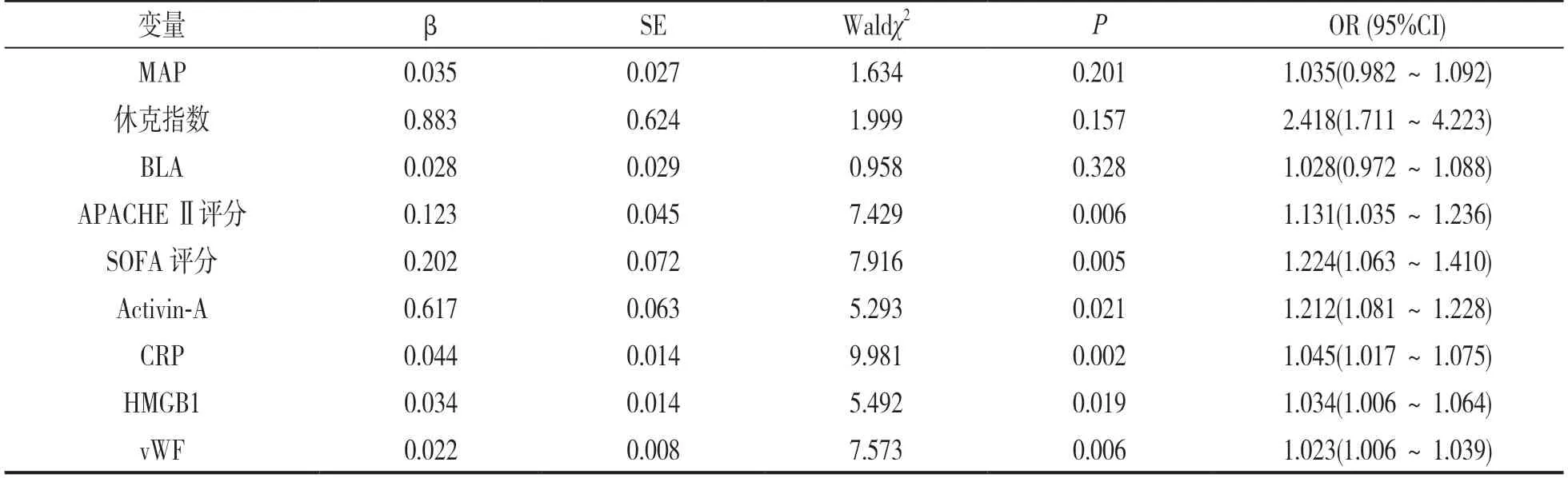
表4 脓毒症患者不良预后影响因素的多因素Logistics 回归分析
2.6 血清Activin-A,CRP,HMGB1 和vWF水平及APACHE Ⅱ,SOFA 评分对脓毒症患者不良预后的预测价值 见表5。ROC 曲线显示,Activin-A+CRP+HMGB1+vWF 预测不良预后的AUC 明显大于APACHE Ⅱ评分、SOFA 评分及Activin-A,CRP,HMGB1,vWF 单独与两两预测,差异具有统计学意义(Z=3.005,3.757,1.999,3.291,2.861,3.146,2.905,2.835,2.657,2.203 和1.956,P=0.003,0.000,0.046,0.001,0.004,0.002,0.004,0.005,0.008,0.028 和0.048)。
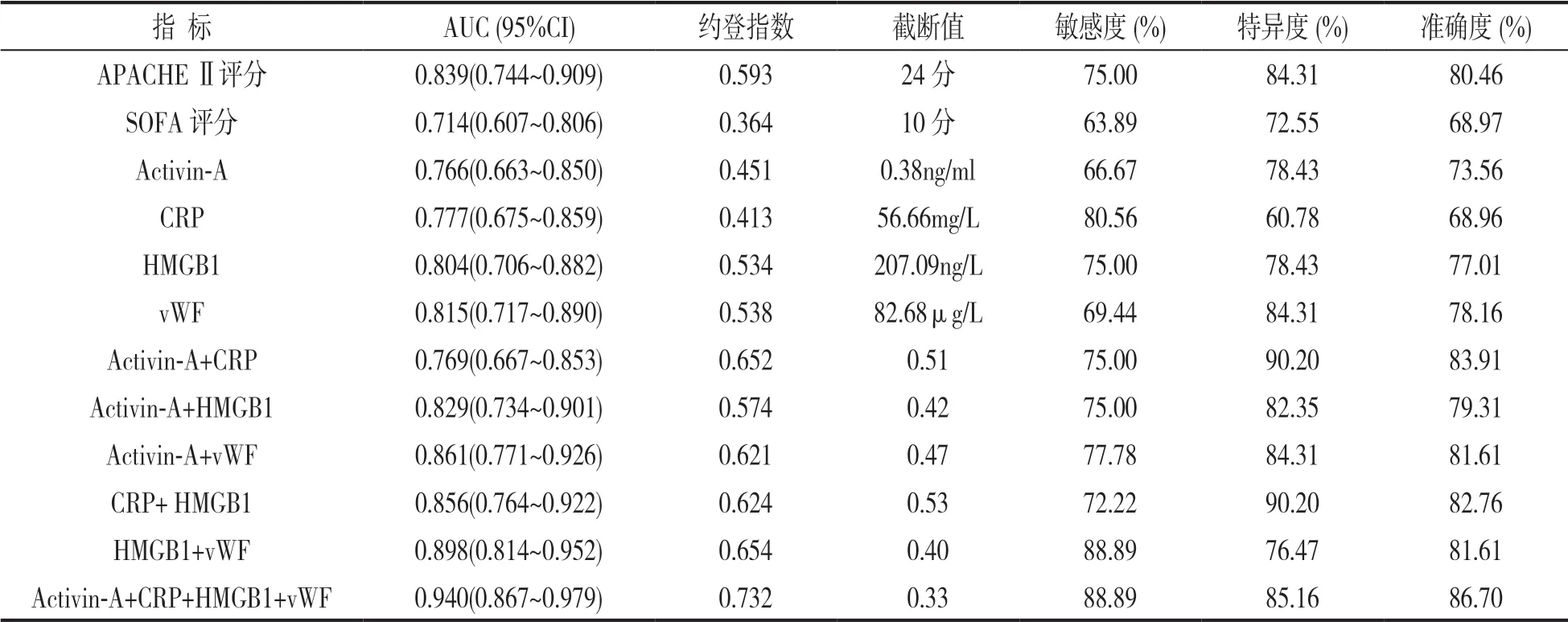
表5 血清Activin-A,CRP,HMGB1,vWF水平及APACHE Ⅱ,SOFA 评分对脓毒症患者不良预后的预测价值
3 讨论
脓毒症是临床常见危重症,随着研究的深入,针对脓毒症导致的多器官功能、多系统损害的支持治疗取得较好进展,但其病死率仍然较高,在脓毒症时为35.5%,发展为脓毒性休克后超过50%,早期识别诊断可降低脓毒症发展为脓毒性休克的几率,由此可见早期判断脓毒症严重性和预后具有重要价值[2]。近年来有关脓毒症患者体内免疫炎症紊乱理论得到了医学界广泛认可,研究发现,脓毒症早期存在以炎性因子为主的炎症风暴,晚期存在以抗炎因子为主的免疫抑制,因此从炎症反应方向判断患者病情严重程度和预后是可行的[9]。此外,循环功能障碍为脓毒症特征性功能障碍,而VEC 功能障碍在循环功能障碍中扮演重要角色。
Activin-A 为转化生长因子-β 超家族一员,可由多种细胞产生和分泌,具备广泛生物学活性,近年研究发现,Activin-A 在组织再生、分化、修复、炎症恢复等方面有重要调节作用[10]。巨噬细胞为机体产生Activin-A 主要细胞之一,研究通过刺激腹腔巨噬细胞发现,在肿瘤坏死因子-α、白介素-1β水平上调的同时,Activin-A 表达也明显提升,进一步研究发现Activin-A 可促进肿瘤坏死因子-α、白介素-1β、白介素-6 等炎症因子表达,增强炎症反应[11]。但也有研究发现,Activin-A 在心脏疾病中具有重要的抗炎作用,可抑制炎症避免动脉粥样硬化,提示Activin-A 具有促炎与抗炎功能[12]。Lee等[13]研究显示,血清Activin-A水平可随着脓毒症病情严重程度升高而升高。本研究结果显示,对照组、脓毒症组、脓毒性休克组血清Activin-A水平逐渐提升,与APACHE Ⅱ,SOFA 评分呈正相关,APACHE Ⅱ和SOFA 评分是临床公认可评估脓毒症病情程度指标,说明脓毒症患者血清Activin-A水平明显提升,且与病情程度相关,与上述报道一致,推测与Activin-A 在脓毒症患者中促炎作用更具优势有关。本研究结果显示,死亡组血清Activin-A水平明显高于存活组,为不良预后独立影响因素,分析是Activin-A 在多种组织细胞中以旁分泌和自分泌发挥作用,而脓毒症患者机体多种细胞紊乱可激活产生大量Activin-A,同时随着炎症反应加重,血管内皮通透性增加,渗漏大量Activin-A,因此血清Activin-A水平越高患者预后越差。
CRP 是一种急性炎症蛋白,主要由肝脏产生,也可由腺细胞、淋巴细胞、内皮细胞、巨噬细胞和肌肉细胞产生,生理状态下表达极低,在组织创伤、感染后可短时间内急剧升高,可加强吞噬细胞的吞噬作用和激活补体以清除损伤、坏死、凋亡组织细胞和入侵病原体,在机体天然免疫过程中扮演重要角色[14]。研究发现[15],CRP 通常于感染后2h 开始提升,并于24~48h 达顶峰,感染控制后1~2 天迅速降低,但病毒感染时大多为轻微升高或正常,因此CRP 还有助于鉴别病毒与细菌感染。袁鼎山等[16]分析不同脓毒症患者预后发现,CRP 与病情严重程度和不良预后呈正相关。本研究结果显示,对照组、脓毒症组、脓毒性休克组血清CRP水平逐渐提升,与APACHE Ⅱ,SOFA 评分呈正相关,说明脓毒症患者血清CRP水平明显提升,且与病情程度相关。结果显示,死亡组血清CRP水平明显高于存活组,为不良预后独立影响因素,说明血清CRP水平越高患者预后越差,分析是CRP 在富集巨噬细胞的同时也会诱导其产生炎症因子损伤组织器官,同时还会抑制T淋巴细胞和自然杀伤细胞,降低局部免疫力,导致感染持续复制,加重患者病情,降低预后[14]。
HMGB1 是一种非组蛋白核蛋白,广泛分布于心、肝、肾、肺、脑、淋巴等组织中,由坏死细胞、活化单核/巨噬细胞主动或被动释放,胞外HMGB1 可结合Toll 样受体2、Toll 样受体4、晚期糖基化终末产物等相应胞膜受体,通过胞内信号传导发挥生物学效应[17]。DENG 等[18]通过内毒素建立内毒素血症模型发现大量HMGB1 分泌,且随着刺激时间的延长出现脓毒症症状,中和细胞外HMGB1 表达能抑制脓毒症进展,说明HMGB1 在脓毒症发生发展中发挥重要作用。安曙光等[19]研究发现,脓毒症血清中HMGB1 表达明显提升,CD4+/CD8+明显降低,且随着病情加重而变化,提示HMGB1 高表达可引起脓毒症患者细胞免疫功能紊乱。REN 等[20]对脓毒症小鼠脑室注射HMGB1拮抗剂后发现小鼠脑细胞凋亡显著改善,学习、记忆、运动功能明显提升,提示HMGB1 参与了脓毒症发病过程。本研究结果显示,对照组、脓毒症组、脓毒性休克组血清HMGB1水平逐渐提升,与APACHE Ⅱ,SOFA 评分呈正相关,为不良预后独立影响因素,符合上述研究报道。分析是胞外HMGB1 结合晚期糖基化终末产物受体后可磷酸化促分裂原活化蛋白激酶,引起活化蛋白-1 和核因子-κB 核内转移,启动炎症级联反应,恶化炎症反应,加重患者病情,影响预后[21]。
VEC 为血管内皮薄层上皮细胞,生理状态下,VEC 具备高度生物活性,参与机体多种生理过程,可根据细胞外环境变化而做出相应反应。脓毒症发生时病原微生物等内外源性损伤因素可激活VEC表面模式识别受体,激活VEC并释放大量炎性介质,改变VEC 结构和功能,增加血管内皮通透性,最终引起机体器官功能障碍[22]。vWF 是一种以单体形式形成,经糖基化、多聚化、原肽切除等胞内过程后形成的多聚糖蛋白,生理状态下大部分由VEC合成,其余由巨噬细胞合成,为血管基底膜黏附与血小板主要黏附蛋白,当VEC 受损时其中vWF则会释放入血管内皮和血液,因此血清中vWF 表达可反映血管内皮受损程度[23]。PEETERMANS等[24]研究发现,脓毒症外周血患者血管性血友病因子裂解酶水平明显降低,vWF水平明显提升,与病情严重程度和预后相关,与本研究中脓毒症患者血清vWF水平随着病情严重程度加重、预后不良而提升结论一致,分析不仅与血清vWF水平高低可反映内皮功能障碍情况有关,还可能与vWF可促进凝血因子Ⅷ释放,紊乱凝血功能,导致多器官功能不全有关[25]。本研究结果显示,Activin-A+CRP+HMGB1+vWF 预测不良预后的AUC 明显大于APACHE Ⅱ,SOFA 评分、Activin-A,CRP,HMGB1,vWF 单独和两两预测,说明联合检测Activin-A,CRP,HMGB1,vWF水平可替代APACHE Ⅱ,SOFA 评分预测,方便评估患者病情和预后。本研究可能存在研究样本量不足的问题,后续研究中需要扩大研究样本量进行深入研究。
