还原型谷胱甘肽调控Nrf2/iNOS信号对DR大鼠视网膜的保护机制
2022-03-07杨馥宇王林洪
杨馥宇,苏 杰,王 玲,王林洪,张 蒙
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病的一种微血管并发症,是最常见的并发症,也是全球主要的致盲性眼病[1-2],其主要以视网膜血管改变为病理特征,眼底多表现为视网膜渗出水肿、新生血管、视物模糊、视力下降、出血及增殖膜形成等,如未能得到及时有效的治疗,会严重威胁患者的视觉健康[3]。谷胱甘肽是生物体内抗氧化防御系统中最重要的小分子活性寡肽,分为氧化型谷胱甘肽(glutathione oxidized,GSSG)和还原型谷胱甘肽(glutathione,GSH)[4]。GSH是一种合成肽,由谷氨酸、半胱氨酸及甘氨酸组成,参与体内糖代谢。GSH作为谷胱甘肽过氧化物酶,参与体内氧化还原过程,能和过氧化物及自由基结合,可清除生物体内有害自由基,结合自由基、有氧自由基、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽转硫酶(Glutathione S-transferases,GSTs)等[5-6]。GSH 生物效应广泛,临床上主要在肝脏疾病应用较多,其在治疗神经系统、消化系统疾病也有广泛的应用[7]。有报道芪灯名目胶囊剂有效成分可以减轻糖尿病大鼠视网膜病变程度,主要和抑制氧化应激损伤有关[8]。一氧化氮(NO)是一种内源性血管扩张剂和神经递质,在视网膜血流的调控机制和糖尿病视网膜病变的发生发展中起重要作用,作为体内NO 生成的主要限速因素[9],诱导型一氧化氮合成酶(iN‐OS)在DR 形成中的作用也日益受到关注。因此,本文探讨原型谷胱甘肽调控Nrf2/iNOS 信号对DR大鼠应激反应的作用,现研究如下。
1 材料与方法
1.1 实验大鼠 48只SD大鼠,由南京君科生物工程公司提供,体重190~220 g,温度(22±1)℃,分4 笼饲养,湿度45%~55%,大鼠活动饮水自由,给予大鼠一周时间习惯新环境,按照《实验动物管理条例》规定进行实验,动物许可证号:SYXK(苏)2018-0009。
1.2 主要仪器与设备 链脲佐菌素购买于北京厚嘉生物科技公司;GSH购买于上海联硕宝为生物科技有限公司;SOD、MDA、GSH-Px 试剂盒购买于上海金畔生物科技公司;Nrf 抗体购买于无锡云萃生物科技;HO-1 抗体购买于厦门慧嘉生物科技;NO抗体购买于上海科敏生物科技;活性氧(reactive oxygen species,ROS)试剂盒子购自上海圻明生物公司;iNOS抗体购买于上海心语生物科技公司。
1.3 DR 大鼠分组及模型制备 用随机法将48 只大鼠分为4组,每组12只,健康组、糖尿病视网膜病变大鼠组(病变组)、糖尿病视网膜病变大鼠给予还原型谷胱甘肽干预组(甘肽组)、糖尿病视网膜病变大鼠给予辛伐他汀干预组(他汀组)。健康组除外,其余三组建立糖尿病视网膜病变大鼠。用新配制的链脲佐菌素溶液按照55 mg/kg 的剂量行大鼠腹腔内注射,大鼠注射后72 h 收集尾静脉测血糖,血糖水平≥16.7 mmol/L,糖尿病大鼠造模成功。分笼饲养4个月后监测尾静脉血糖>16.7 mmol/L的大鼠采用戊巴比妥(40 mg/kg)进行腹腔注射麻醉,阿托品双眼散瞳,盐酸丙美卡因眼表面麻醉后进行眼前照相,并经尾静脉注射0.2 mL 浓度为50 mg/mL 的异硫氰酸葡聚糖荧光素,眼底血管造影检查眼底情况,同时具备4 个月持续糖>16.7 mmol/L 且眼底血管造影出现微血管瘤及渗漏的大鼠为DR 大鼠建模成功,本次实验大鼠均建模成功[9]。
1.4 干预方法 建模成功后,甘肽组大鼠给予还原谷胱甘肽0.9%生理盐水溶解后,2 mL/kg 注入大鼠腹腔,他汀组大鼠给予辛伐他汀0.2 mg/kg 灌胃,各组大鼠1/d,连续干预14 d。健康组及病变组大鼠不进行用药,给予等体积柠檬酸缓冲液腹腔注射,时间及剂量相同。
1.5 标本组织采集 将各组大鼠用戊巴比妥钠麻醉处死后,十字型剪开眼眶骨组织后暴露眼球,取出整个眼球,立即进入PBS 冲洗,放入无菌玻璃器皿,在眼科手术显微镜下用眼科镊剥离视网膜组织,低温保存。
1.6 视网膜组织HE染色 将各组大鼠视网膜组织置于4%多聚甲醛液固定24 h,取出已经固定好的视网膜组织,梯度酒精脱水,透明,浸蜡包埋、切片取4μm 厚度,用二甲苯脱蜡,梯度酒精水化,水洗5 min,置于苏木精染色10 min,水洗,置于伊红染色10 min,再次梯度酒精脱水,二甲苯透明,中性树胶封片。光镜下观察染色情况。
1.7 免疫荧光法检测各组大鼠视网膜组织ROS 表达 取大鼠视网膜组织,用PBS 清洗,共清洗3 次,3%过氧化氢室温孵育10 min,再用10%山羊血清封闭1 h,滴加一抗ROS(1:200),4 ℃过夜,于次日用PBS 清洗,共3 次,滴加二抗山羊抗兔(1:200),孵育1 h,再次PBS 冲洗3 次,滴加DA-PI 孵育10 min,抗荧光淬灭封片。荧光显微镜下观察,检测各组大鼠视网膜组织中ROS的表达。
1.8 检测大鼠视网膜组织中SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力以及脂质过氧化物丙二醛(malonaldehyde, MDA)蛋白表达 取各组大鼠视网膜组织50 g 进行匀浆后离心,离心速度为1500 r/min,离心时间为10 min,取上清液。SOD 活性检测采用WST-1 法,GSH-Px 活力检测使用比色法,MDA 含量的检测使用TBA 法,严格按照试剂盒操作,每个实验检测3次。
1.9 Western blot 检测大鼠视网膜组织中核因子相关因子(Nrf2)2、HO-1、NO、iNOS 蛋白的表达 各组大鼠视网膜加入蛋白裂解液快速混匀,运转离心机后保留上清液,放置在75 ℃水浴10 min使蛋白变性后放入样孔中灌胶和上样,每组取5 μg蛋白进行电泳实验。将蛋白转移到PVDF膜TBS浸泡10 min,反复PBS冲洗,每次5 min,加入1抗Nrf2、HO-1、NO、iNOS抗体(1:1000),孵育过夜,后放入2抗辣根过氧化物酶标记羊抗兔IgG(1:2000)杂交冲洗。浸入ECL工作液,检测,显色等步骤,成像系统对印迹条带的光密度进行分析。GAPDH作为内参。
1.10 PCR法检测大鼠视网膜组织中Nrf2、HO-1表达 各组大鼠视网膜组织研磨,提取总RNA,RNA反转录总cDNA,采用Trizol 法提取总RNA,无核酸酶溶解。将提取的RNA 进行转录为cDNA,获得反体系,条件为:42 ℃作用60 min,72 ℃作用5 min,4 ℃终点。每个细胞设置6个复孔,以GAPDH为内参,反应条件为95 ℃预作用3 min,95 ℃作用5 s,58 ℃退火,40个循环。表1。

表1 引物序列
1.11 统计学处理 采用SPSS22.0 软件进行分析,符合正态分布的计量资料以均数±标准差()表示,多组间比较采用方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 眼底荧光血管造影检查视网膜病变大鼠成模情况 病变组大鼠眼底可见微血管瘤,后期渗漏,呈强荧光,毛细血管管壁着染,视网膜可见小片出血遮蔽荧光。健康组大鼠眼底未见明显异常荧光,图1。

图1 眼底荧光血管造影检查
2.2 各组大鼠视网膜HE 染色比较 健康组大鼠视网膜内、外核层细胞排列紧密、规律,表面光滑平整;病变组内外核细胞的单元间隙明显缩小,细胞排列不规则,内在限制膜存在轻微肿胀,表面不光滑;他汀组和甘肽组细胞排列较规则,内在限制膜表面较光滑,病变明显改善。图2。
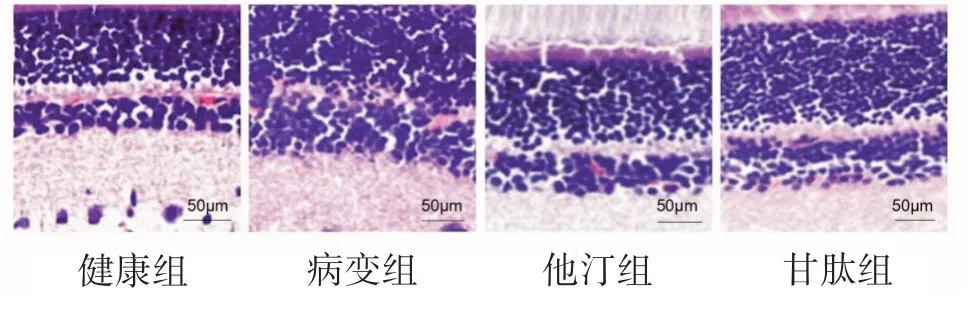
图2 各组大鼠HE染色(×200)
2.3 各组大鼠视网膜组织中ROS 表达水平 与健康组大鼠ROS(1.00±0.00)比较,病变组大鼠视网膜组织中ROS(1.97±0.12)表达水平明显升高(P<0.05);与病变组比较,他汀组ROS 表达(1.75±0.11)和甘肽组视网膜组织中ROS 表达(1.13±0.09)水平明显降低(P<0.05);与他汀组比较,甘肽组ROS表达降低明显(P<0.05)。图3。
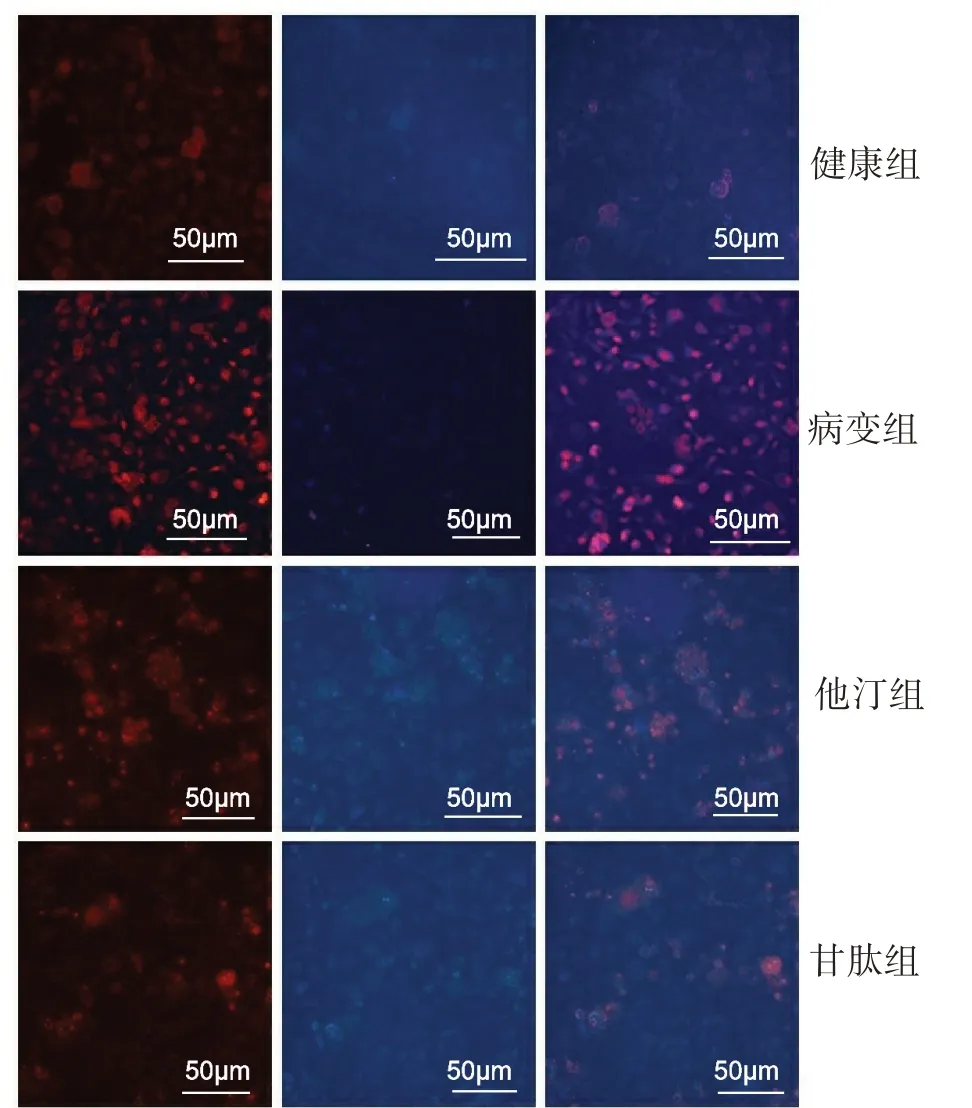
图3 各组大鼠视网膜组织中ROS表达水平(×200)
2.4 各组大鼠视网膜组织氧化应激指标 与健康组比较,病变组视网膜组织中SOD、GSH-Px 水平降低,MDA水平升高(P<0.01),与病变组比较,他汀组和甘肽组视网膜组织中SOD、GSH-Px 水平明显降低,MDA水平明显升高(P<0.01),与他汀组比较,甘肽组SOD、GSH-Px水平升高明显,MDA水平升高明显(P<0.01)。表2。
表2 各组大鼠氧化应激指标比较(±s)
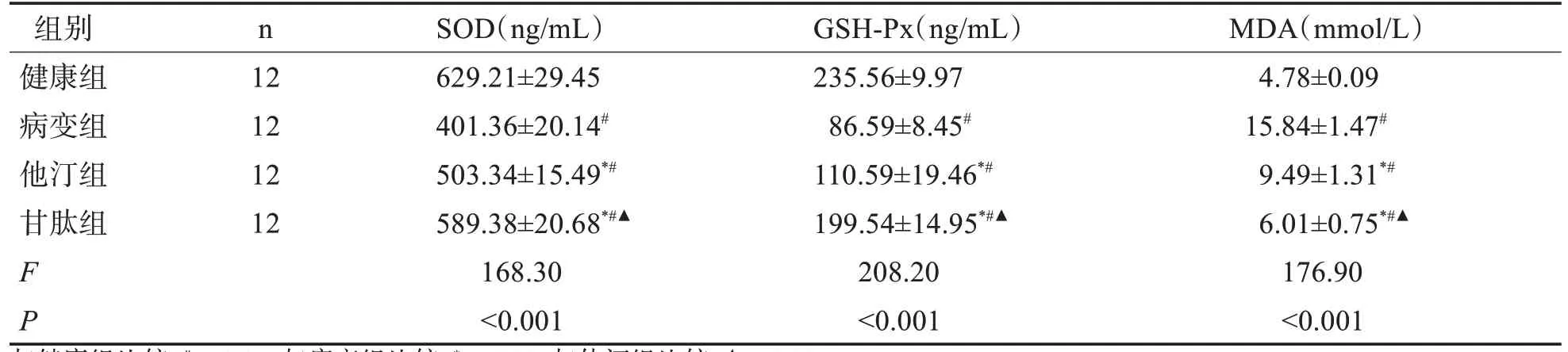
表2 各组大鼠氧化应激指标比较(±s)
与健康组比较,#P<0.01;与病变组比较,*P<0.01;与他汀组比较,▲P<0.01。
组别健康组病变组他汀组甘肽组FP n 12 12 12 12 SOD(ng/mL)629.21±29.45 401.36±20.14#503.34±15.49*#589.38±20.68*#▲168.30<0.001 GSH-Px(ng/mL)235.56±9.97 86.59±8.45#110.59±19.46*#199.54±14.95*#▲208.20<0.001 MDA(mmol/L)4.78±0.09 15.84±1.47#9.49±1.31*#6.01±0.75*#▲176.90<0.001
2.5 各组大鼠视网膜组织中Nrf2、HO-1 蛋白水平表达 与健康组比较,病变组视网膜组织中Nrf2、HO-1 蛋白水平降低(P<0.05),与病变组比较,他汀组和甘肽组视网膜组织中Nrf2、HO-1蛋白水平明显升高(P<0.05),与他汀组比较,甘肽组视网膜组织中Nrf2、HO-1蛋白水平上升明显(P<0.05)。表3,图4。
表3 各组大鼠视网膜组织中Nrf2、HO-1水平比较(±s)
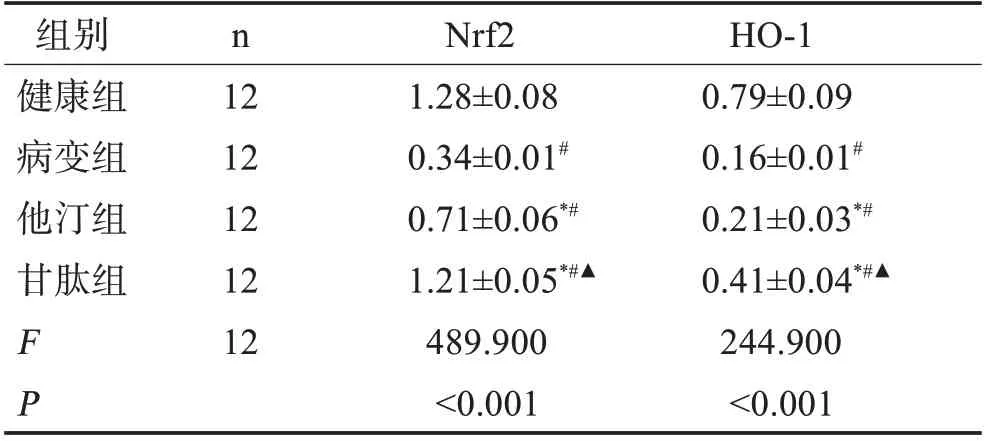
表3 各组大鼠视网膜组织中Nrf2、HO-1水平比较(±s)
与健康组比较#P<0.05;与病变组比较*P<0.05;与他汀组比较▲P<0.05。
?

图4 各组大鼠Nrf2、HO-1蛋白表达水平
2.6 各组大鼠视网膜组织中NO、iNOS 的蛋白水平表达 与健康组比较,病变组NO、iNOS 水平升高(P<0.05),与病变组比较,他汀组和甘肽组NO、iNOS 水平降低(P<0.05),与他汀组比较,甘肽组NO、iNOS水平降低明显(P<0.05)。表4。
表4 各组大鼠NO、iNOS的水平表达(±s)
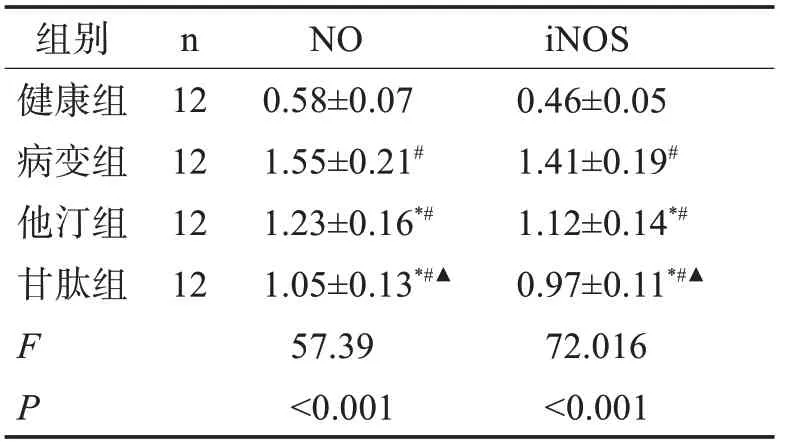
表4 各组大鼠NO、iNOS的水平表达(±s)
与健康组比较#P<0.05;与病变组比较*P<0.05;与他汀组比较▲P<0.05。
组别健康组病变组他汀组甘肽组FP n 12 12 12 12 NO 0.58±0.07 1.55±0.21#1.23±0.16*#1.05±0.13*#▲57.39<0.001 iNOS 0.46±0.05 1.41±0.19#?1.12±0.14*#0.97±0.11*#▲72.016<0.001
图5 各组大鼠NO、iNOS蛋白水平表达
2.7 各组大鼠Nrf2、HO-1mRNA 的表达 与健康组比较,病变组Nrf2mRNA、HO-1mRNA 水平降低(P<0.05),与病变组比较,他汀组和甘肽组Nrf2mRNA、HO-1mRNA 水平明显升高(P<0.05),与他汀组比较,甘肽组Nrf2mRNA、HO-1mRNA 水平明显升高(P<0.05)。表5。
表5 各组大鼠Nrf2、HO-1mRNA表达的比较(±s)
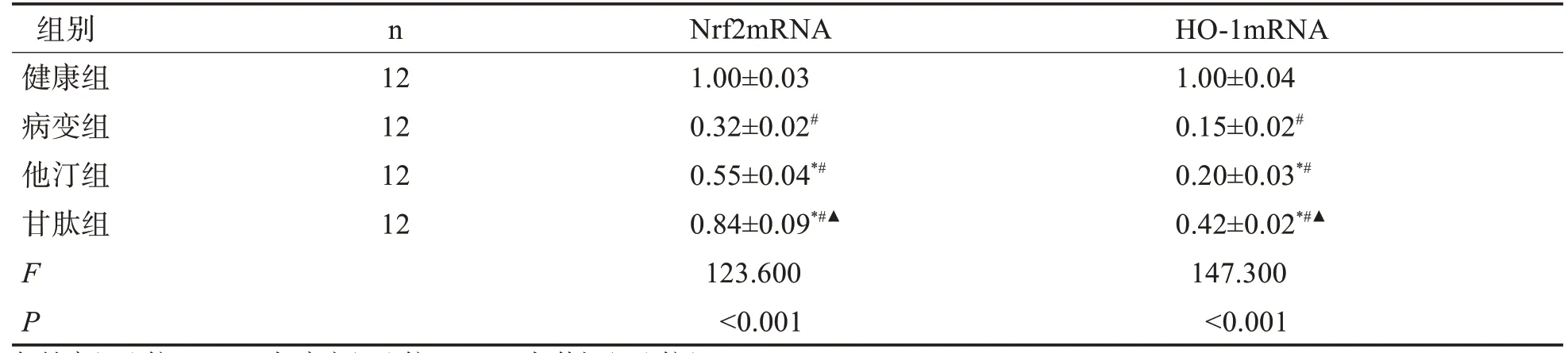
表5 各组大鼠Nrf2、HO-1mRNA表达的比较(±s)
与健康组比较#P<0.05;与病变组比较*P<0.05;与他汀组比较▲P<0.05。
组别健康组病变组他汀组甘肽组F P n 12 12 12 12 Nrf2mRNA 1.00±0.03 0.32±0.02#0.55±0.04*#0.84±0.09*#▲123.600<0.001 HO-1mRNA 1.00±0.04 0.15±0.02#0.20±0.03*#0.42±0.02*#▲147.300<0.001
3 讨论
糖尿病视网膜病变的发病机制尚无明确结论,糖尿病视网膜病变发展史复杂的病理过程,是多种因素共同作用所致,其主要的病理变化包括高血糖、微血管病变和神经组织病变等[10-11]。有研究显示糖尿病引起的视网膜病变、肝脏等疾病,与机体内自由基增长和抗氧化能力下降有关[12-13]。还原型谷胱甘肽(GSH)是一种抗氧化剂同时也是机体内重要的还原剂,存在于人体各种组织和细胞中,具有调节体内蛋白质和核苷酸合成的作用,并与机体中的抗氧化能力有关[14]。糖尿病视网膜病变发病过程中氧化应激占主导位置[15]。辛伐他汀属于他汀类药物,对冠心病有较好的治疗作用,同时还有降血脂的作用,除此之外,还可以促进血管新生,对糖尿病的视网膜病变有一定的治疗作用,但是辛伐他汀对患者的肝脏功能及肌肉反应有影响。目前研究显示高血糖引起的活性氧簇增多是DR 发病的始动因素。ROS将导致多种视网膜细胞功能障碍,包括视网膜神经节细胞的凋亡及视网膜血管内皮细胞功能的紊乱[16-17]。有学者通过研究红斑狼疮患者发现,GSH 可以下调患者中性粒细胞ROS 的水平,在红斑狼疮的治疗中起到了积极作用[18]。在糖尿病患者氧化应激过程中,各种氧自由基不断攻击视网膜,发生脂质过氧化作用。有研究发现DR 大鼠视网膜细胞出现氧化应激损伤,MDA 水平升高,SOD和GSH-Px活力降低,说明DR大鼠处于氧化应激状态,控制机体自由基平衡,有助于糖尿病视网膜病变的控制。SOD 是重要的抗氧化酶,其可清除细胞内过多的活性氧,保护细胞免受自由基的氧化损伤。原型谷胱甘肽能和自由基结合,对抗氧化对巯基的破坏,保护身体重要脏器,可以免受自由基的破坏。谷胱甘肽参与人体的氧化还原反应,同时还可调节细胞的增生。还原型谷胱甘肽是减少细胞内氧化应激作用的重要物质,GSH-Px 作用降低时,GSH 的生成会减少,导致细胞内氧化应激反应增加,造成细胞损伤[19]。徐辉勇等研究发现经过柚皮素干预后,糖尿病视网膜病变大鼠的视网膜组织中的MDA 水平明显下降,SOD 和GSH-Px活力明显升高,柚皮素可以拮抗氧化应激,减轻DR 大鼠视网膜病变[20]。本文研究发现病变组SOD、GSH-Px水平降低,MDA、ROS 表达水平升高,经过干预后,甘肽组SOD、GSH-Px 水平升高,MDA、ROS 表达水平降低明显。本文研究和上述研究一致。
Nrf2 是一种维持细胞氧化应激的重要转录因子。正常条件下,Nrf2 存在于细胞质中,ARE 存在于细胞核内,受到自由基刺激时,活化的Nrf2 进入细胞核,并与ARE结合,从而启动受Nrf2-ARE调控的氧化还原酶类,调控抗氧化酶,进而提高细胞的抗氧化应激能力。有研究表明葡萄籽原花青素可增加DR大鼠视网膜Nrf2和HO-1的表达水平,激活Nrf2 来改善氧化应激介导的DR 大鼠视网膜损伤[21]。Nrf2 通路具有抗氧化、抗细胞凋亡、神经保护等多种作用,同时在糖尿病视网膜病变中起到一定作用[22]。到目前为止很多的实验和研究亦已证明Nrf2在高氧化应激状态的疾病中都有保护作用,并决定了机体对氧化应激的敏感性和机体炎性反应的严重程度。糖尿病视网膜病变大鼠的GSH-Px活力降低时,GSH 的生成会减少,GSH-Px和Nrf2在糖尿病视网膜病变中成正相关。原型谷胱甘肽是含有巯基的体内最重要的抗氧化物之一,在酶的催化下能与过氧化物和自由基结合,对抗氧化物的破坏作用。GSH 能激活多种酶,促进糖、脂肪及蛋白质的代谢。有研究还原谷胱甘肽可以通过P38MAPK 通路诱导HO-1 的表达来组织肾脏近曲小管上皮细胞氧化应激的损伤。本文研究发现糖尿病大鼠视网膜发生病变时Nrf2、HO-1 水平降低,经过原型谷胱甘肽干预后甘肽组Nrf2、HO-1 水平上升,说明原型谷胱甘肽可干预Nrf2-ARE 信号通路对DR疾病的发生发展有影响。
NO 是体内最强的血管扩张因子,同时也是活跃的免疫分子和炎症介质,在糖尿病视网膜病变中不仅参与视网膜血流动力学和血液流变学改变,还能增加视网膜血管通透性,参与破坏血-视网膜屏障,还影响视网膜神经节细胞的功能。NO 的合成有赖于一氧化氮合酶(NOS),同时多种细胞表达诱导型NOS(iNOS)增多,导致cNOS/iNOS 失衡,NO合成过量[23]。NOS 在高糖刺激下可以导致视网膜细胞中iNOS的表达增加,导致NO 增加,NO 的过量产生和释放则具有细胞毒性和细胞抑制作用,尤其是源于iNOS 的过度表达而产生的NO。高血糖时体内氧化应激反应增强,也使iNOS表达增强,产生一系列自由基引起的氧化及硝化损伤,在视网膜神经元以及血管的结构与代谢方面产生损伤作用,从而加速DR 的进展。还原谷胱甘肽可以抑制TNF、IL-6 等炎症因子的活化,减少iNOS 的合成,使NO产生减少,减轻炎症反应对肾脏的损害。还原谷胱甘肽可与白细胞在氧化应激时产生的过氧化酶衍生氧化物,阻止其进一步参与氧自由基生成反应,减少氧化反应和炎症反应相互作用。本研究原型谷胱甘肽可显著降低iNOS、NO 蛋白水平表达,增加Nrf2 和HO-1 表达量,同时降低ROS 和NO 水平,由次推断说明原型谷胱甘肽能够通过促进Nrf2 和HO-1 表达,抑制iNOS 表达,进而降低细胞炎症反应,减少细胞ROS产生,对细胞起到保护作用。
综上所述:还原型谷胱甘肽可以调控Nrf2/iNOS 信号通路,改善氧化应激反应,对糖尿病视网膜病变其保护作用。
