外源Zn对土壤抗生素抗性基因及细菌群落的诱导作用
2022-03-07杨统一唐国腾唐玉斌
杨统一,李 静,唐国腾,杨 芬,唐玉斌
(1.江苏科技大学环境与化学工程学院,江苏 镇江 212100;2.镇江海关综合技术中心,江苏 镇江 212003)
抗生素抗性基因(antibiotic resistance genes, ARGs)的水平基因转移风险被世界卫生组织确定为21世纪卫生安全领域的主要挑战[1],其可通过禽畜粪肥、污泥农用及污水灌溉等方式大量进入农田土壤,并可能传播至人类致病菌,严重威胁公共安全[2]。目前发现在临床和自然环境中减少抗生素的使用有时不能有效地控制ARGs在环境中的传播[3],表明环境中还存在其他因素驱动ARGs的传播扩散。
在重金属污染的土壤环境中,细菌不仅具有重金属抗性,而且通过共选择、间接选择等机制还可能激发抗生素抗性,进而提高ARGs水平转移的风险[4]。重金属污染作为一种长期、广泛的选择压力,难以被降解,使土壤中ARGs得以维持和增强[5]。重金属Zn离子作为土壤中细菌生长所必需的微量元素,当浓度较低时可以促进细菌的生长,但是一旦超过一定的阈值就会对细菌有害,降低生物多样性,甚至杀死菌体[6]。欧盟在2010年评估土壤Zn累积污染的影响时发现,农田土壤生态系统在未来10~50 a内Zn浓度可能超过安全阈值[7]。2014年《土壤重金属污染公报》显示,我国土壤Zn污染以轻微和轻度污染为主,点位超标率为0.9%。而农田土壤的Zn污染风险较高,因为我国每年向土壤施用6.18亿t以上粪肥,是土壤Zn污染的重要来源,对农田土壤生态安全构成了巨大风险[8]。研究发现,施用粪肥的土壤Zn、Cu及Pb含量显著增加,与sul1、sul2、tetG、tetW、ermF和ermB等ARGs呈显著正相关,表明重金属参与ARGs共选择过程;且与整合子intl1呈显著正相关,揭示重金属可能诱导可移动遗传元件(mobile genetic elements,MGEs)参与土壤ARGs的扩散[9]。
土壤中包括温度、含水量、重金属离子及pH值等多种因素共同影响细菌群落和ARGs,进而影响ARGs的产生和传播[3,10]。目前土壤重金属对ARGs影响的研究中多存在其他干扰因素,无法准确评估重金属的直接效应[8,11],且重金属Zn作为单一因素影响土壤ARGs的阈值、浓度效应及迁移转化规律未见报道,阻碍了Zn在土壤环境中风险的准确评估。笔者基于室内培养实验,采用Miseq高通量测序分析和荧光定量PCR技术,分析Zn对土壤中氨基糖苷类ARGs及MGEs相对丰度的影响,研究Zn诱导ARGs与细菌群落的浓度效应,以期为预测及治理土壤ARGs污染提供科学的基础数据。
1 材料与方法
1.1 Zn处理土壤实验设计与取样
实验土壤来源于中国农业科学院蚕桑研究所试验站(镇江)的桑树苗圃,为长江近代石灰性新冲积物母质发育的黄棕壤(pH=7.4)[12],w(有机碳)为2.95 g kg-1,w(总氮)为765.37 mg·kg-1,w(总磷)为23.57 mg·kg-1,黏土、粉土和砂的含量比例为42∶36∶22。土壤重金属含量由ICP-OES法测定(Varian,720-ES,美国),Zn、Cr、Cd、Cu、Ni及Pb的w分别为91.48、64.7、2.36、30.75、32.3及38.37 mg·kg-1。Zn处理前将土壤风干过2 mm孔径筛,搅拌使土壤均质化。根据调研农田土壤中广泛存在的Zn污染水平来设计Zn处理的浓度[8,10]。提前准备ZnSO4母液,处理土壤时按照处理浓度稀释。Zn处理浓度分别为0(对照)、100、200、400、800和1 000 mg·kg-1,每处理装150 g干土,3个生物学重复。整个处理过程放置在培养箱中,瓶口覆盖保鲜膜,土壤含水量(称重法)保持在30%左右,温度25 ℃,光周期夜晚(L)∶白天(D)= 12 h∶12 h。处理30和60 d时取土样分析。土壤取样后置于-20 ℃条件下保存。
1.2 MiSeq 测序及数据分析
土壤DNA的提取及高通量测序委托江苏中益金达分析检测有限公司(中国宜兴)进行。采用土壤提取试剂盒Fast DNA SPIN Kit(MP Biomedicals, USA),从1 g土壤混合样品(3个重复样混合)中提取DNA,然后利用w为1%的琼脂糖凝胶电泳检测抽提的基因组DNA。采用分光光度法(NanoDrop ND-1000,Thermo Scientific, USA)对提取的DNA定量。以16S rRNA基因V1~V2高变区为靶点,利用引物F:5′-AGAGTTTGATYMTGGCTCAG-3′、R:5′-TGCTGCCTCCCGTAGGAGT-3′扩增。PCR扩增在25 μL反应体系中进行,该反应体系包含1 μL正向引物(10 μmol·L-1)和1 μL反向引物(10 μmol·L-1)、12.5 μL 2×EasyTaq PCR Super Mix(Transgene,北京)、1 μL(10 ng·μL-1)模板DNA和9.5 μL超纯水。PCR反应的程序为:94 ℃预变性5 min,94 ℃ 30 s、54 ℃ 30 s、72 ℃ 40 s共20个循环,最后72 ℃延伸10 min。
用UCHIME识别测序数据并去除非特异扩增及嵌合序列,用UPARSE 7.1软件对相似性为97%的操作分类单元(OTU)进行聚类。根据序列最少的样本,使用序列数标准对OTU数进行归一化,用Mothurv.1.35.1软件计算多样性指数[13]。测序数据已提交至NCBI数据库,登录号NO.SRP117127。
1.3 qPCR分析
根据前期PCR扩增结果,选择4个氨基糖苷类ARGs:aac、aacC1、aacA/aphD和aac6′-II,3个转座酶基因(tnpA、IS613和Tp614)和1个整合酶基因intI1(表1)。使用7300型qPCR仪(Applied Biosystems,USA)执行以下程序:95 ℃ 预变性 5 min,95 ℃ 15 s、60 ℃ 60 s、72 ℃ 40 s共40个循环。反应体系为 20 μL,包含10 μL SYBR PremixEx TaqTM (大连Takara), 0.6 μL引物(10 μmol·L-1),7.8 μL去离子水,1 μL模板DNA。同时检测无DNA模板的阴性对照。每个样品的扩增反应由3个重复组成,根据熔解曲线计算每个靶基因的拷贝数,并归一化为16S rDNA 拷贝数[8]。相对丰度为ARGs/16S rDNA。

表1 供试基因的实时定量PCR引物
1.4 数据的统计分析
数据采用Excel 2016版及Origin 9.3等软件进行统计分析。在Gephi平台上使用MGEs、ARGs和细菌群落(基于OTU)的相对丰度进行基于Spearman秩相关的网络分析;冗余分析(RDA)采用Canoco5软件进行分析[4]。
2 结果与分析
2.1 氨基糖苷类抗生素抗性基因对Zn胁迫的响应
qPCR分析表明,不同Zn浓度诱导氨基糖苷类ARGs相对丰度的差异显著(图1)。
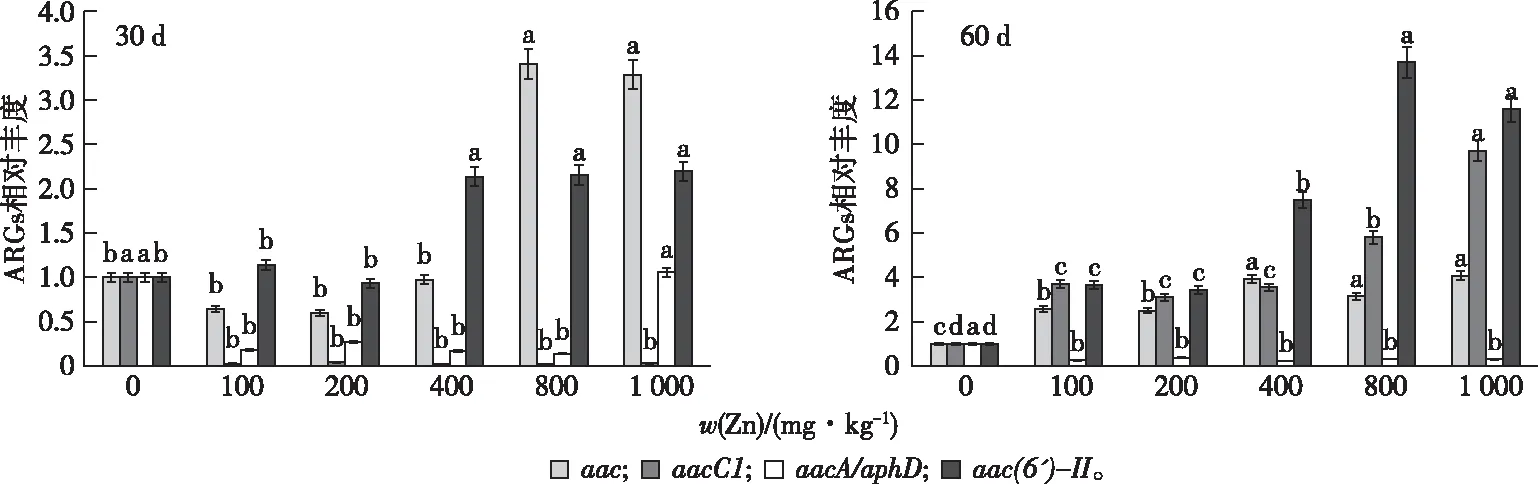
同一组直方柱上方英文小写字母不同表示不同处理间ARGs差异显著(P<0.05)。
Zn胁迫60 d比30 d时对ARGs的影响更大,且对不同的基因影响程度不一样;从浓度效应来看,高浓度的Zn对ARGs的影响更大,且不同基因对Zn的响应浓度不同。从Zn离子对acc的影响来看,处理30 d时100、200和400 mg·kg-1Zn对其没有显著影响,而800 mg·kg-1时提高到对照的3.4倍;处理60 d时,100 mg·kg-1Zn处理是对照的2.6倍,1 000 mg·kg-1Zn处理是对照的4.1倍。与对照相比,不同Zn离子处理30 d时aacC1都显著降低;处理60 d时aacC1显著高于对照,1 000 mg·kg-1Zn处理时达到对照的9.7倍。与对照相比,100和200 mg·kg-1Zn处理30 d时对aac(6′)-II没有显著影响,而400 mg·kg-1时提高到2.1倍;100 mg·kg-1Zn处理60 d时与对照也有显著差异,达到3.7倍;800 mg·kg-1Zn处理时达到最大,为对照的13.7倍,而1 000 mg·kg-1Zn处理时下降为对照的11.6倍。与其他基因相对丰度大幅提高不同,Zn处理使aacA/aphD基因的相对丰度不断下降,最低为对照的0.14倍。
2.2 可移动遗传元件对Zn胁迫的响应
使用qPCR检测所有样本中的3个(tnpA、IS613和Tp614)和1个整合酶基因(int11)(图2)。Zn处理30 d对tnpA相对丰度的影响显著高于60 d;低浓度Zn也能显著提高其相对丰度,且1 000 mg·kg-1Zn处理时最高,为对照的10.9倍。与对照相比,处理30 d时100、200、400和800 mg·kg-1Zn处理时显著降低IS613的相对丰度,而1 000 mg·kg-1时提高到对照的1.1倍,差异不显著;60 d时,100 和200 mg·kg-1Zn处理与对照没有显著差异,而400、800和1 000 mg·kg-1Zn处理显著高于对照。与对照相比,30 d时所有Zn浓度处理显著降低Tp614的相对丰度; 60 d时所有Zn浓度处理都显著提高其相对丰度,最高达对照的4.7倍,但1 000 mg·kg-1Zn处理时降为对照的2.1倍。与对照相比,30 d时100和200 mg·kg-1Zn处理有降低int11相对丰度的趋势,但差异不显著,而400、800和1 000 mg·kg-1Zn处理就显著提高了其相对丰度; 60 d时, 200、400、800和1 000 mg·kg-1Zn处理都显著高于对照,最大为对照的3.7倍。
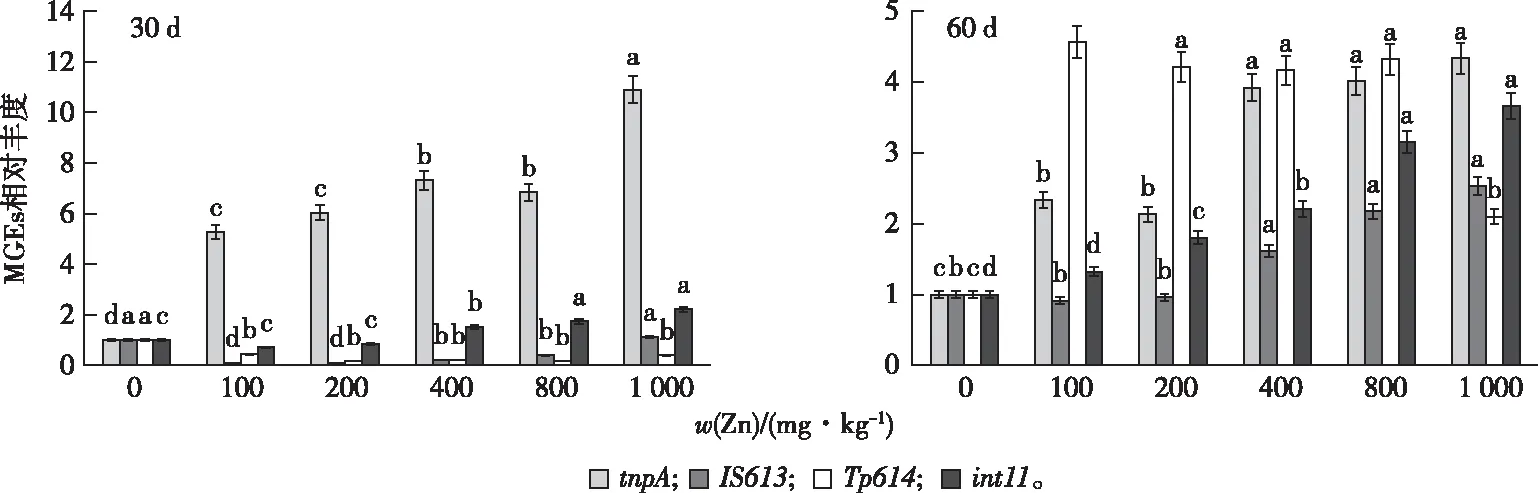
同一组直方柱上方英文小写字母不同表示不同处理间MGEs差异显著(P<0.05)。
2.3 Zn胁迫对土壤细菌群落多样性的影响
为进一步了解土壤细菌受到的影响,利用Illumina MiSeq高通量测序对土壤样品中的细菌群落进行分析。不同处理土壤样品的OTU从4 109到5 984 不等(表2)。
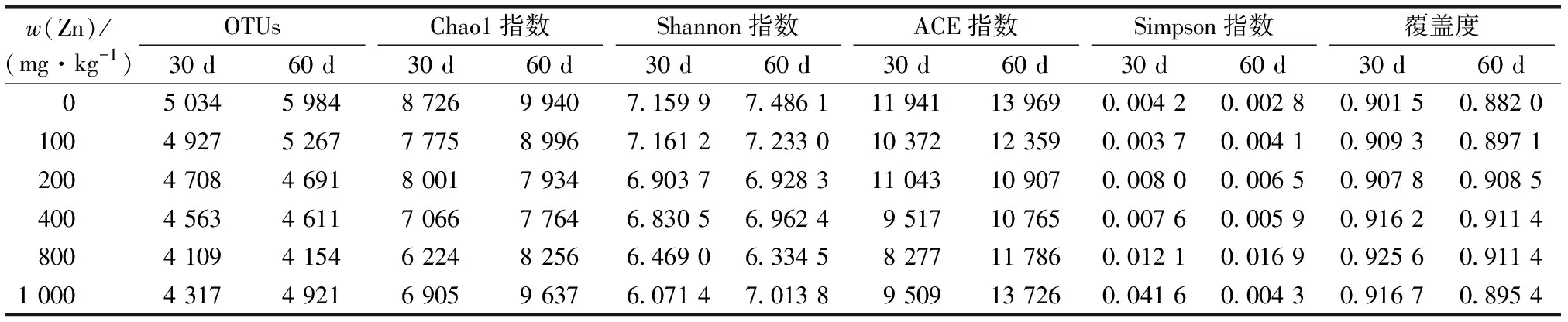
表2 土壤中细菌多样性指数
2.4 Zn胁迫对土壤细菌群落结构的影响
2.4.1在门水平上的影响
Zn胁迫对土壤细菌群落门水平影响的高通量测序结果(图3)表明,在已鉴定的26个细菌门中,在所有处理土壤样品中的主要菌群是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes),其平均总相对丰度占比分别为26.5%~45.1%、9.8%~19.7%、10.3%~15.9%、5.4%~13.4%和3.1%~16.6%。其中变形菌门所占比例最大,Zn处理大幅度提高了该门的占比,特别是高浓度处理(400~1 000 mg·kg-1)时,最大提高了12.8%。但60 d时,1 000 mg·kg-1Zn处理比对照低4.6%。Zn处理对芽单胞菌门的影响表现为短期(30 d)呈下降趋势;随着处理时间的延长(60 d),1 000 mg·kg-1Zn处理时增加了1倍。
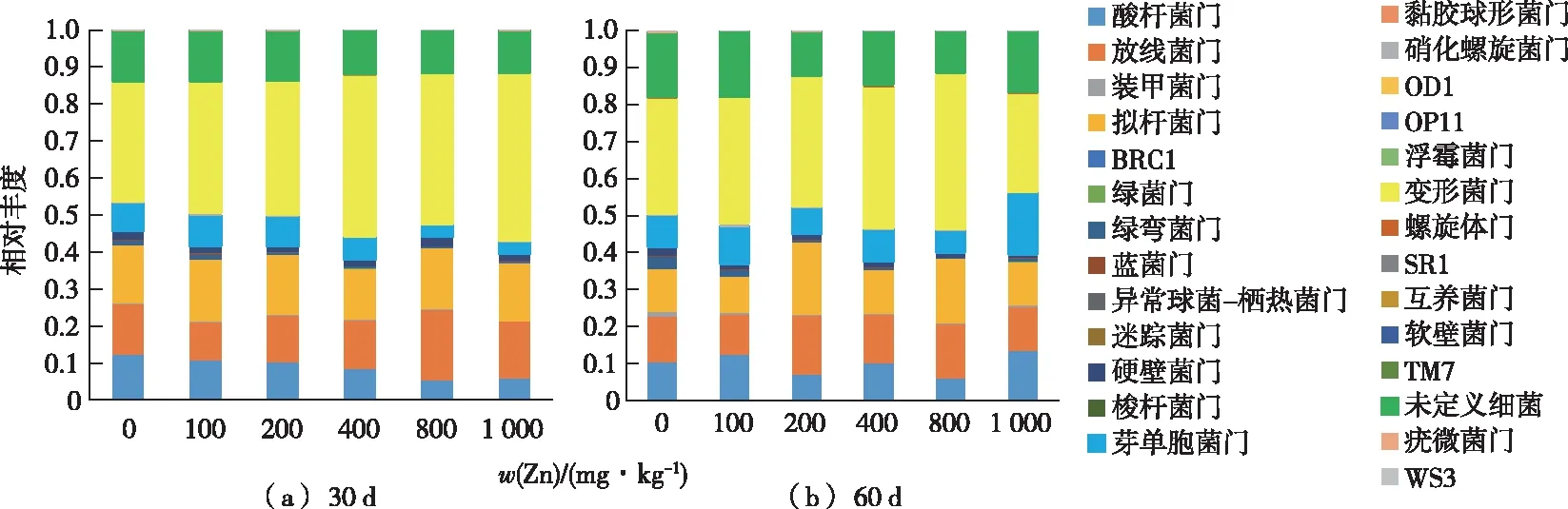
图3 Zn处理对土壤细菌群落门水平上的影响Fig.3 Bacterial communities at phylum level in all soil samples under Zn stress
2.4.2在属水平上的影响
对Zn处理土壤细菌(属水平)的热图分析反映了Zn胁迫影响属水平的细菌群落结构差异性(图4)。总体来看,在属水平上各样品细菌群落热图分为2个主要的簇。簇1主要是Zn处理浓度为400~1 000 mg·kg-1的样品聚类在一起;簇2是Zn处理浓度为0~200 mg·kg-1的样品聚类在一起。但1 000 mg·kg-1Zn处理60 d时,细菌群落结构与其他浓度处理的结构差异较大。30 d时,芽单胞菌属(Gemmatimonas)的相对丰度随着处理浓度的增加逐渐降低;1 000 mg·kg-1Zn处理60 d时提高了芽单胞菌属的相对丰度,为原来的2倍。所有样品中Flavisolibacter、Arthrobacter、Lysobacter属和Acidobacteria_Gp4、Acidobacteria_Gp6的相对丰度都超过1%。此外,随着Zn浓度的增加,Ohtaekwangia、Sphingomonas、Luteimonas、Micromonospora和Streptomyces属的相对丰度增加,表明这些属可能适应了高浓度Zn引起的胁迫压力。
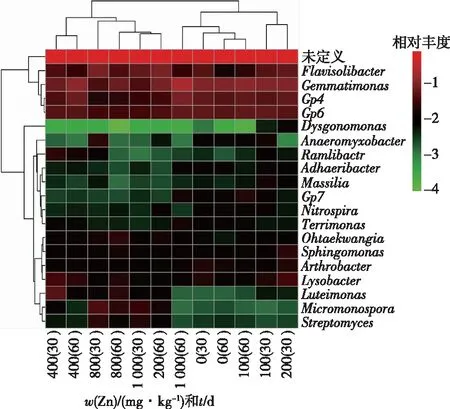
图4 属水平上细菌群落相对丰度(>1%)热图分析Fig.4 Heat map analysis of the relative abundance of bacteria (>1%) at genus level
2.5 抗生素抗性基因水平转移相关因子对Zn胁迫的响应
2.5.1土壤细菌群落、抗生素抗性基因及可移动遗传元件与Zn浓度的相关性
为了明确Zn胁迫对ARGs水平转移相关因子的影响,采用RDA分析了土样、细菌群落(属水平)、ARGs及MGEs的关系,RDA分析时选取相对丰度在1%以上的12个菌群,结果见图5。RDA1(Zn处理)能够解释22.6%的总变异,RDA2能够解释65.7%的总变异,大于Zn处理的影响。从样品的细菌群落分布来看,Zn处理土壤30和60 d对细菌结构的影响明显不同,且随着Zn浓度的提高影响程度加深;从处理浓度来看,中等浓度(100~400 mg·kg-1)Zn处理的土壤群落结构相似性更强,而高浓度(800~1 000 mg·kg-1)Zn处理对土壤群落结构的影响更强。多种细菌群落包括Nocardioides、Adhaeribacter和Arthrobacter等与Zn胁迫具有负相关性;而Flavisolibacter、Sphingomonas及Solirubrobacter与Zn胁迫具有正相关性。Zn处理30 d时,Zn主要减少Nocardioides、Adhaeribacter、Arthrobacter、Lysobacter和Anaeromyxobacter菌群的相对丰度;60 d时减少Gemmatimonas、Gp4、Gp6和Gp7菌群的相对丰度。
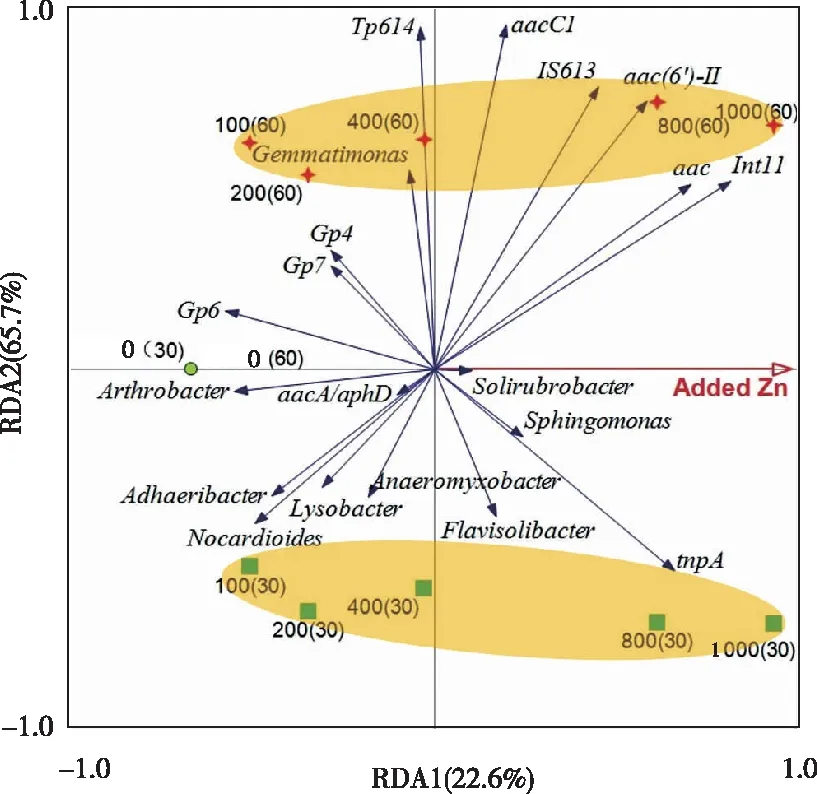
图5 土壤样品、细菌群落、ARGs及MGEs与外源Zn的RDA分析Fig.5 RDA of soil samples, the microbial community, ARGs, MGEs and added Zn
RDA分析还表明,Zn胁迫对acc、aac(6′)-II及aacC1具有明显的影响,特别是在处理60 d时。Zn处理与int11、IS613及tnpA具有正相关性,且与处理时长有关。此外,acc、aac(6′)-II及aacC1与int11、IS613具有较强的相关性,也就是说在Zn的胁迫压力下,这些ARGs水平转移的风险可能增加了。
2.5.2Zn胁迫压力下细菌群落、抗生素抗性基因及可移动遗传元件网络分析
为了分析ARGs水平转移的潜在风险,揭示Zn胁迫影响土壤ARGs与潜在宿主菌、MGEs变化的内在联系,对其进行网络分析(图6)。在Zn胁迫的压力下,Adhaeribacter、Arthrobacter和Gemmatimonas与其他细菌连接数较多,说明活跃度较高,是响应Zn胁迫的敏感菌群。acc、aac(6′)-II与intI1、IS613这些MGEs具有较多的连接度,这说明在Zn胁迫的影响下,整合子intI1携带多个抗性基因水平转移的可能性提高了。网络分析还揭示Steroidobacter与Tp614存在连接,可能是Tp614的潜在宿主菌。
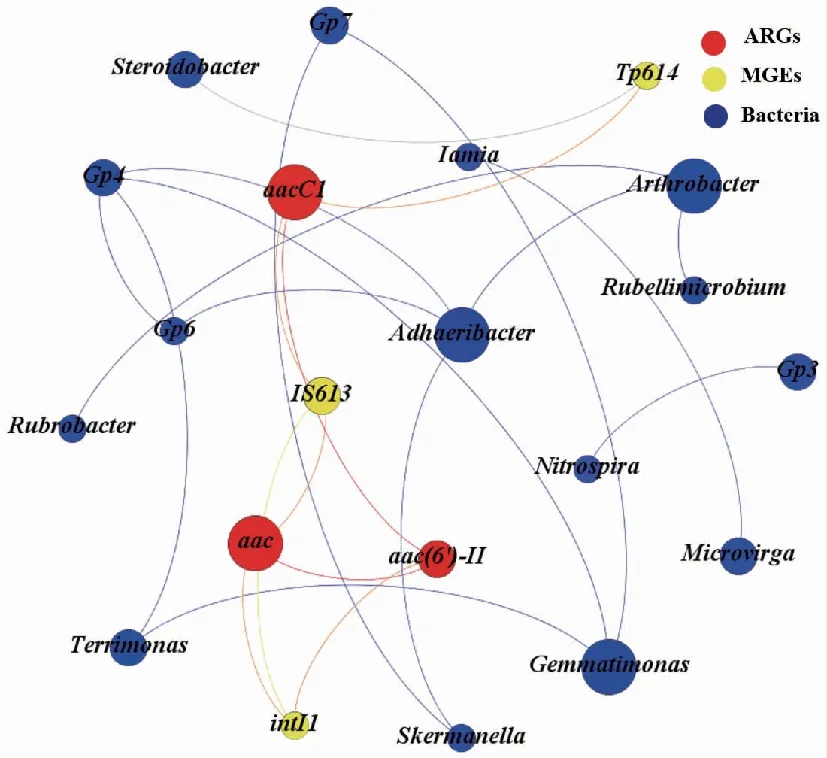
每个节点的大小与连接数成正比。
3 讨论
与抗生素相比,重金属的化学性质稳定,在土壤中难以被降解。Zn作为细菌生长所必需的微量元素,可以被细菌吸收利用,但累积超过一定阈值,也可以产生胁迫压力,威胁细菌的生存[6]。土壤重金属和抗生素的协同选择增加了ARGs传播扩散风险,降低了遏制ARGs传播政策的有效性[11,14]。农业土壤中经常检出氨基糖苷类、四环素类和氯霉素类ARGs[15],这些ARGs持久性传播并通过发移动遗传元件转移到临床病原菌中,导致抗生素治疗失效。LI等[16]的研究表明,Cu处理不仅增强了抗生素抗性,而且促进了抗性从堆肥肥料转移到农田土壤。HU等[4]通过高通量qPCR发现,Cu污染4~5 a的土壤含有多耐药性抗性基因和内酰胺类ARGs;Cu污染程度显著影响ARGs的多样性和相对丰度, 在中度污染(100~200 mg·kg-1)的红土和重度污染(400~800 mg·kg-1)的潮土中最高。对上海多个禽畜养殖场周边土壤的研究发现,土壤Zn含量与磺胺类ARGs的丰度具有显著的正相关性[17]。该研究实验用的土壤来源于桑蚕研究所苗圃基地,重金属Zn的浓度为91.48 mg·kg-1,较高的Zn浓度可能来源于多年施用粪肥导致,但低于GB 15618—2018《农用地土壤污染风险管控标准》中Zn浓度(250 mg·kg-1)。土壤中不同的氨基糖苷类ARGs对Zn胁迫响应不同,Zn胁迫对acc的影响存在一个阈值浓度,处理30 d时约为891.48 mg·kg-1;随着时间的延长,60 d时即使低浓度(100 mg·kg-1)Zn处理,其相对丰度也能达到对照的2.6倍。aacC1对Zn胁迫的响应比较特别,30 d时不同浓度处理都有不同程度的下降,而60 d时又大幅度升高,最多时提高到对照的13.7倍。ZHU等[8]研究中国禽畜养殖场周边土壤时发现,氨基糖苷类抗性基因与重金属Zn、Cu具有很强的相关性。JI等[17]发现,施入猪粪的土壤中sul3、sulA与Cu、Zn、Hg之间存在显著相关性。
可移动遗传元件在土壤中广泛存在,包括质粒、插入序列、转座子及整合子等。ARGs通常借助MGEs进行水平转移,在土壤细菌进化和适应特定环境压力的过程中扮演重要角色[11,18]。作为整合子Ⅰ类家族的一员,intl1被认为是一种环境污染的敏感生物标记,来指示抗性基因的传播风险[19-20]。BINH等[21]研究表明,随着猪粪中重金属含量的增加,氨基糖苷类抗性基因aadA与Intl1结合并提高其迁移率。ROSEWARNE等[14]的研究表明,intl1的相对丰度与淡水沉积物中Zn的含量呈显著正相关。Zn处理的浓度和时长对intl1的影响不同,随着处理时间的延长,intl1的相对丰度有增加的趋势,最多为对照的3.7倍。然而,intI1基因不能在细菌间调动和转移,它们通常与其他MGEs结合,如质粒、转座子和插入序列[22]。网络共存分析显示intI1和aac、IS613连接,说明其可能结合在一起形成复合转座子,进而提高aac的可移动性。RDA和网络分析还表明,aacC1与转座子IS613、Tp614显著相关,且与Adhaeribacter具有显著的相关性,说明这些菌群可能携带这个抗性基因,传播风险较高。在土壤中检测到的最丰富的转座酶基因就属于IS6家族,IS613、Tp614是IS6家族的2种常见的转座子,通常与多种ARGs相关,如氯霉素、氨基糖苷和β-内酰胺抗性基因,能协助ARGs发生水平转移扩散[23]。
先前的宏基因组学和qPCR分析发现,ARGs丰度及多样性与微生物结构和功能密切相关,表明细菌群落结构是ARGs的重要决定因素[24-25]。变形菌门、拟杆菌门、放线菌门、酸杆菌门是土壤中最常见的细菌,其中放线菌和变形菌还具有产生多种抗生素的遗传潜力,含有多种ARGs[26]和具有较强的重金属耐受性[4,27]。这与笔者的研究结果一致。研究还发现,在Zn胁迫下细菌多样性下降,抗性种属的相互关系比较复杂,这可能大大提高ARGs的迁移率,增加这些基因向其他细菌传播的风险。但随着Zn处理浓度的增加,多样性逐渐降低,到800 mg·kg-1Zn处理时OUT数和Chao1指数多样性达最低点,而1 000 mg·kg-1Zn处理时多样性增加了。一种解释是Zn可能对特定的敏感细菌有毒,导致细菌结构和多样性发生改变,随着抗性菌群适应了高浓度Zn胁迫的环境,种类和数量都有所提高。RDA分析表明,Zn胁迫提高了抗性菌群Flavisolibacter、Sphingomonas及Solirubrobacter的丰度,这些结果说明Zn胁迫下幸存的抗性菌群携带的抗性基因增加,这可能提高其抗生素抗性。
4 结论
基于室内培养实验,结合高通量测序和qPCR技术,评估了Zn作为单一因素驱动氨基糖苷类ARGs和细菌群落的动态变化,表明30~60 d的Zn处理土壤会显著影响氨基糖苷类ARGs及迁移潜力。尽管抗生素可能是驱动ARGs传播扩散的主要因素,但Zn诱导的氨基糖苷类ARGs相对丰度和多样性的变化可能也是一个重要的途径。低浓度Zn离子长时间胁迫也能提高部分ARGs的相对丰度,而且重金属还可以在土壤中累积,达到最小选择阈值并触发更多ARGs的增殖和扩散。重金属Zn充当直接的选择性压力,迫使土壤中抗生素抗性的扩散和传播,未来控制土壤ARGs的水平基因转移风险应充分考虑重金属污染的共选择作用。
