Dravet综合征SCN1A基因新突变及遗传咨询*
2022-03-05林迎春张芳乔凤昌张翠平焦娇胡平
林迎春,张芳,乔凤昌,张翠平,焦娇,胡平
(南京医科大学附属妇产医院&南京市妇幼保健院产前诊断中心,南京 210004)
Dravet综合征(dravet syndrome, DS)是最典型的发育性癫痫性脑病,其发病率约为1/40 000~1/20 000[1],具有起病早、发作形式多样及对抗癫痫药物不敏感等特点。目前报道的DS致病基因包括电压门控性钠离子通道α亚单位基因(SCN1A、SCN2A、SCN8A、SCN9A),原钙黏蛋白19(PCDH19),GABA受体α1亚型(GABRA1),γ-氨基丁酸γ2受体基因(GABRG2)及染色质解旋酶DNA结合蛋白2(CHD2)等,但DS主要是由SCN1A杂合性功能缺失突变所致[2]。2001年,Claes等[3]首次在DS患者中发现SCN1A基因突变,并证实其可以编码电压门控钠通道。以往研究证实与DS相关的SCN1A基因突变占比约为85%[4]。SCN1A是常染色体显性遗传基因,多数为新发突变,低于10%的突变遗传自突变嵌合体父母[5]。近年来,随着全外显子测序技术的发展,为癫痫的遗传学病因分析、遗传咨询以及精准治疗提供了重要的支撑[6]。本研究拟采用全外显子测序技术诊断2例不明原因癫痫伴精神运动发育迟缓患儿,并发现患儿SCN1A基因均存在新发杂合突变,分别为c.5354T>C(p.I1785T)和c.4380T>A(p.Y1460*)。报道如下。
1 研究对象和方法
1.1研究对象 患儿一,男,15岁,汉族,1周岁诊断为癫痫,每月发作2次,口服奥卡西平至今,但效果欠佳。患儿发病后出现进行性精神运动发育迟缓,尤其是语言发育迟缓,智商检测为重度智力低下(IQ30)。患儿外院脑电图及头颅MRI检查未见异常。
患儿二,女,8岁,汉族,患儿存在全面发育迟缓,智力低下,语言、运动发育落后,肢体不协调,4个月癫痫发作,开始时每1~2个月发作1次,药物治疗每3~4个月后发作1次。
2例患儿均就诊于南京医科大学附属妇产医院医学遗传中心,患儿一就诊时间为2020年11月,患儿二就诊时间为2021年7月。行外周血及染色体微阵列芯片检查均未见异常,征得2例患儿父母同意,拟对2例患儿进行全外显子测序检测以寻找致病基因及位点,本研究获得南京医科大学附属妇产医院医学伦理委员会批准(No.宁妇伦字 [2019] KY-081号),患儿家属签署知情同意书。
1.2主要仪器与试剂 S220型Covaris 超声破碎仪(美国Covaris公司),BECKMAN Allegra X-12 R离心机(美国Beckman coulter公司),Qubit3.0荧光仪(美国Thermo公司),Veriti 梯度PCR 仪(美国ABI公司),Illumina Hiseq2500 测序仪(美国Illumina公司)。DNA 提取试剂盒(德国Qiagen公司),PCR扩增试剂(南京诺唯赞公司),Agilent SureSelect QXT ALL Human Exon V6 kit试剂盒(美国Agilent公司),文库构建试剂盒(德易东方公司)。
1.3方法
1.3.1标本采集 2例患儿及其父母在遗传咨询门诊就诊后,选择基因诊断进行遗传学病因分析。分别对2个家庭的患儿和父母采集外周血2~3 mL(无需空腹),EDTA-K2抗凝,样本置于4 ℃保存。按照DNA 提取试剂盒说明书在采血后48 h内完成基因组DNA提取,纯化的DNA以及剩余的血液样本置于-20 ℃保存。
1.3.2全外显子测序 按照DNA 提取试剂盒说明书提取2例患儿及其父母基因组DNA,所得DNA浓度均>50 ng/μL,总DNA量>2.0 μg。基因组DNA经打断后进行文库构建,杂交捕获后上机测序。测序结果用BWA0.6.2-r126软件(https://sourceforge.net/projects/bio-bwa/)与人类参考基因组序列(GRch37/hg19)比对,去掉建库过程中因PCR扩增产生的冗余信息,运用GATK软件(http://www.broadinstitute.org/gatk/)识别序列中的单核苷酸变异及基因组小片段的插入或缺失。采用Annovar注释软件(https://annovar.openbioinformatics.org/en/latest/)对识别出的变异位点进行注释及分类,并对测序深度、覆盖深度等进行统一描述。
1.3.3检出变异的生物信息学分析 通过ExAC Browser(https://exac.broadinstitute.org/)、Genome Aggregation Database(http://gnomad.broadinstitute.org)、the 1000 Genomes Project(http://gnomad.broadinstitute.org)、dbSNP(https://www.ncbi.nlm.nih.gov/snp/)获得突变位点在正常人群中的频率;通过OMIM、HGMD和ClinVar等数据库,注释已报道的致病基因及位点等,并与疾病关联。此外,通过SIFT、Polyphen-2、MutationTaster和PROVEAN软件预测错义突变对蛋白质功能的影响;通过Human Splicing Finde、regSNP-intron和MutationTaster软件对剪切位点附近的突变进行预测。对检出突变位点致病性的评估采用ACMG(2015)评级指南[7]。
1.3.4Sanger测序验证 采用NCBI在线软件(https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi?LINK_LOC=BlastHom)对2个SCN1A基因变异位点设计引物,c.5354T>C(p.I1785T)上游引物序列:5′-GCTAGCACCCATTCTCAAC-3′,下游引物序列:5′-GTTTGGTTGTGGCAGATTG-3′,产物片段大小为349 bp。c.4380T>A(p.Y1460*)上游引物序列:5′-GAAATGAGACTGCTCGATG-3′,下游引物序列:5′-CCTGGTCGAGGTATAGGC-3′,产物片段大小为376 bp。PCR反应体系均为50 μL,包括25 μL PCR mix,10 μmol/L上、下游引物各2 μL,DNA模板2 μL,ddH2O 19 μL。PCR反应参数:95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 10 min。扩增产物送至苏州金唯智公司进行测序。
2 结果
2.1外显子捕获测序结果及变异位点致病性分析 2例患儿全外显子测序质控数据结果合格,样本数据量、测序深度及覆盖度见表1。结果发现患儿一SCN1A基因第29号外显子存在c.5354T>C(p.I1785T)杂合突变,为错义突变,使该处氨基酸序列发生改变。患儿二SCN1A基因第26号外显子存在c.4380T>A(p.Y1460*)杂合突变,为无义突变,截断第1 460处的蛋白质翻译,产生截短蛋白,2例患儿父母相应位点均为野生型。此外,2例患儿还检测出表型相关的其他变异,为意义未明变异,同时根据ACMG SFv2.0推荐范围内未检出与表型不相关的致病变异或疑似致病变异[8]。对检出位点在不同物种的保守性进行了评估,发现c.5354T>C(p.I1785T)和c.4380T>A(p.Y1460*)在各物种间均高度保守(图1)。
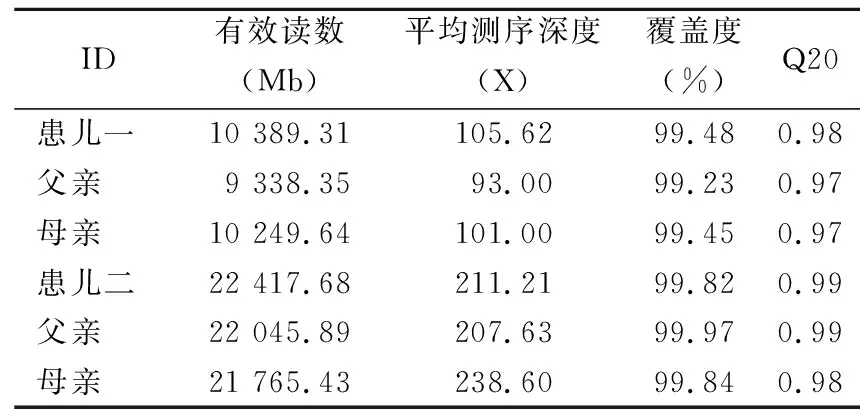
表1 测序数据量

图1 不同物种两突变位点同源序列比对
根据ACMG(2015)发布的关于变异的解读标准对该位点进行分析,判定c.5354T>C(p.I1785T)变异证据为PS2+PM2+PP2+PP3,为可疑致病变异;c.4380T>A(p.Y1460*)变异证据为PVS1+PS2+PM2,为致病变异。
2.2Sanger测序验证结果 2例患儿Sanger测序结果与全外显子捕获测序结果一致,患儿父母的外周血样本中并未检测出相应位点的变异,因此,c.5354T>C(p.I1785T)和c.4380T>A(p.Y1460*)为新发变异(图2)。
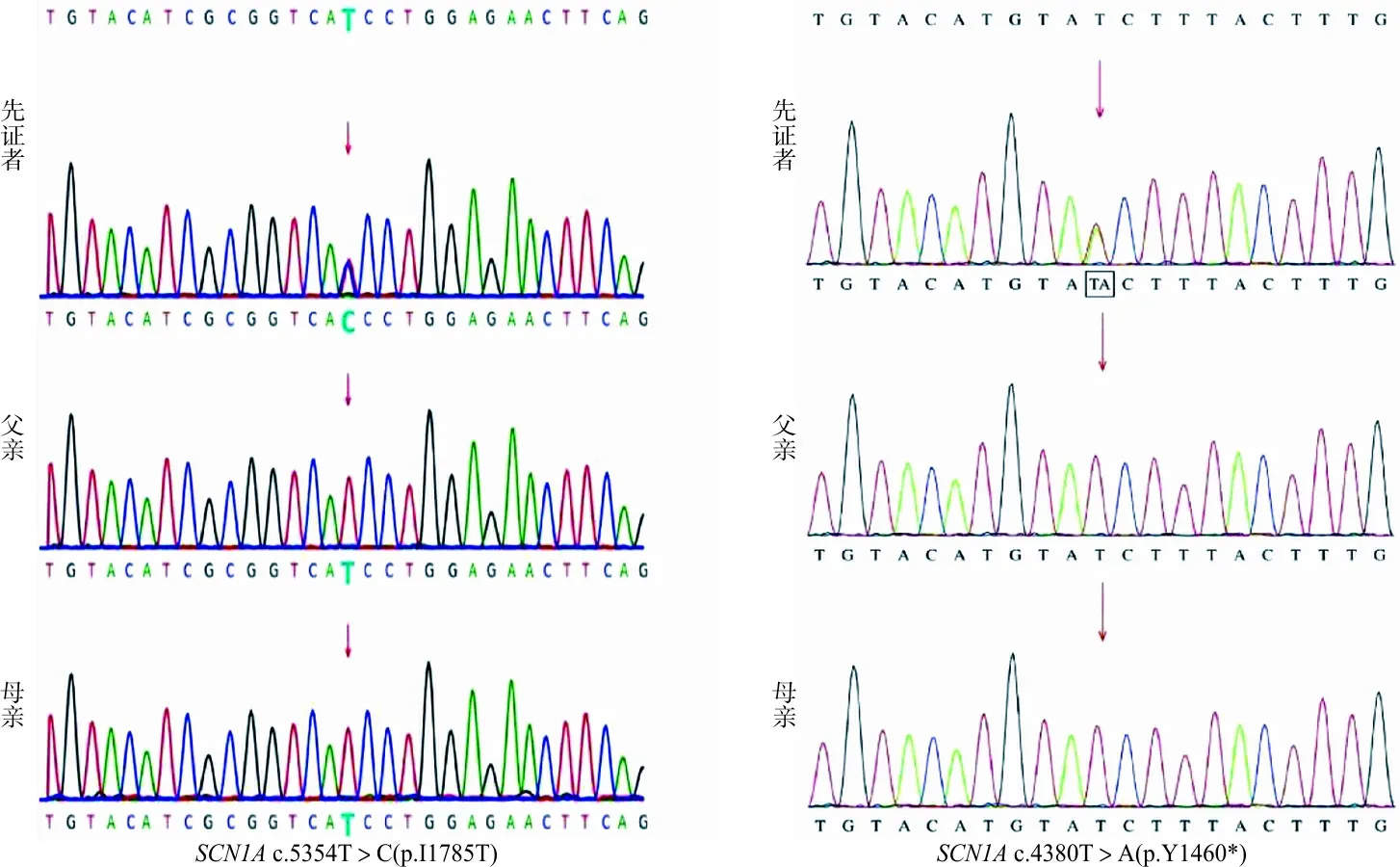
图2 Sanger测序验证2例患儿及其父母SCN1A基因的杂合突变
3 讨论
SCN1A基因(NM_001165963.4)位于2q24.3,有29个外显子,编码2 009个氨基酸。其编码的蛋白质为Nav1.1,对控制中枢神经系统的兴奋性起重要的调节作用[9]。本研究发现的c.5354T>C(p.I1785T)和c.4380T>A(p.Y1460*)突变位点分别位于Nav.1.1的DIVS6和DⅢS6区。SCN1A基因突变所致环门孔区结构异常会引起钠通道通透性及电压敏感性变化,涉及功能突变(截短或错义),使得Nav1.1钠离子通道单极化不足,导致GABA能神经元兴奋性下降,锥体神经元兴奋性增强,诱发神经发育异常与癫痫产生,最终导致DS[10]。故而证实本研究检出的新发突变是2例患儿的主要致病原因。
2例患者均属于新发突变,再发风险较低,但也存在父母生殖腺突变嵌合体的可能。因此,告知两对夫妇可以正常怀孕,但再孕时,建议考虑进行针对变异位点的产前诊断。患儿一母亲再次妊娠,孕19周时到本院做产前遗传咨询,笔者建议针对突变位点做羊水穿刺及胎儿染色体分析。经充分咨询及告知风险后,患者家属放弃产前诊断,告知其做好后续的各项孕期和新生儿检查,如有异常应及时就诊。孕30周胎儿超声系统筛查未见异常,笔者将对该家系进行持续随访。
Dravet综合征作为耐药性癫痫的代表性疾病,尽早明确诊断有助于临床精准治疗。目前,大部分DS患者使用钠通道阻滞剂[11],其中经典抗癫痫药物钠通道阻滞剂(如奥卡西平)是DS的禁忌[1]。de Lange等[11]首先证实了钠通道阻滞剂会加重肌痉挛,并对患者的认知产生负面影响。但由于DS的临床表现多样,影像学检查亦无阳性发现,因此该病很容易被漏诊、误诊。本研究中的患儿由于早期未得到及时正确地诊断,在治疗过程中长期服用DS禁忌药奥卡西平,加重了神经功能损害。在回访中建议该患儿于小儿神经科就诊,进一步调整其治疗方案并对其随访。
