FANCA 基因缺陷的恶性肿瘤患者使用PARP抑制剂的疗效研究
2022-03-05车瑛琦武辉宇李雪任云会李茜楠娄晔刘国华杨雪松
车瑛琦,武辉宇,李雪,任云会,李茜楠,娄晔,刘国华,杨雪松
大庆龙南医院肿瘤内科,黑龙江大庆 163000
DNA 损伤修复功能异常是肿瘤发生发展的重要特点之一。同源重组(homologous recombination,HR)修复通路整合参与DNA 双链断裂的修复[1-3]。乳腺癌易感基因1/2(breast cancer susceptibility genes 1/2,BRCA1/2)作为HR 修复的关键抑癌基因,其编码的蛋白参与DNA 双链损伤的修复、细胞生长和防止异常细胞分裂导致肿瘤的发生。在临床试验中发现携带BRCA 突变的卵巢癌患者,由于其HR 通路的缺陷,恰好成为PARP 抑制剂的适用人群,近年来研究者们发现,BRCA1/2 基因突变和其他HR 修复缺陷与卵巢癌、前列腺癌、乳腺癌、胰腺癌的发展密切相关[4-6]。对于存在HR 修复功能异常的肿瘤,PARP 抑制剂(PARP inhibitor,PARPi)通过抑制PARP 酶活性和增加PARP-DNA 复合物的形成,导致肿瘤细胞DNA 损伤修复障碍、促发肿瘤细胞凋亡[7],同时HR 通路参与DNA 双链损伤修复,该通路上基因(BRCA、FANCA、FANCF 等基因)异常可导致同源重组修复缺陷(homologous recombina‐tion deficiency,HRD)。从合成致死的原理上,PARP抑制剂可以在所有HRD 肿瘤细胞中发挥作用,即不仅限于BRCA1/2 基因突变,因此本研究选取2020年2 月—2021 年2 月在大庆龙南医院接受治疗的60例Ⅱ~Ⅲ期无BRAC 突变的卵巢癌患者为研究对象,探究卵巢癌中FANCA 突变的患者应用PARP 抑制剂的疗效,未来可以用作实体瘤使用PARP 抑制剂的新的生物标志物选择。现报道如下。
1 资料与方法
1.1 一般资料
选取在本院接受治疗的60 例Ⅱ~Ⅲ期无BRAC突变的卵巢癌患者为研究对象,根据FANCA 基因检测结果将研究对象分为有FANCA 基因突变组(n=25)及 无FANCA 基因突变组(n=35)。其中有FANCA 基因突变组年龄32~68 岁,平均(50.02±2.31)岁;临床分 期Ⅱ期14 例,Ⅲ期11 例。无FANCA 基因突 变组年 龄30~68 岁,平均(49.77±2.93)岁;临床分期Ⅱ期20 例,Ⅲ期15 例。两组患者年龄、瘤种分期比较,差异无统计学意义(P>0.05),具有可比性。且患者签署知情同意书,本研究获得本院医学伦理委员会批准。
1.2 纳入与排除标准
纳入标准:①病理、免疫组化明确诊断卵巢癌患者;②分期为Ⅱ~Ⅲ期,且均完成4~6 周期铂类基础方案化疗后一线维持治疗的患者;③行BRCA1/2及FANCA 基因检测,根据结果入组的患者;④ECOG 评分≤2 分,预计生存时间≥6 个月的患者,⑤临床资料及随访资料完整的患者。
排除标准:①既往使用过PARP 抑制剂者;②合并严重的心脑血管疾病、肝肾疾病、自身免疫性疾病等者。
1.3 方法
所有患者均接受铂类为基础方案化疗,即紫杉醇注射液(进口药品注册证号H20171227,规格:10 mL∶60 mg)静脉注射175 mg/m2,注射时间大于3 h,同时给予顺铂(国药准字H20040813,规格:6 mL∶30 mg)75 mg/m2,用生理盐水或5%葡萄糖溶液稀释后静脉滴注,给药前2~16 h 和给药后至少6 h 之内,必需进行充分的水化治疗。该化疗方案为3 周/次,连续治疗4~6 个周期。化疗结束后,两组患者开始进入维持治疗,氟唑帕利(国药准字H20 200014;规格:50 mg)单药一线维持治疗,在医师的指导下铂类化疗结束的8 周内口服150 mg/次,2 次/d,持续维持治疗6 个月。
1.4 观察指标
1.4.1 近期疗效评价 所有患者维持治疗6 个月后复查盆腔增强CT 或MRI,依据WHO 关于实体瘤疗效评价标准进行近期疗效评估,完全缓解(complete remission,CR):所有靶病灶完全消失,至少维持4 周以上;部分缓解(partial relief,PR):所有目标病灶长径总和小于50% 以上;疾病稳定(stable disease,SD):介于PR 与PD 之间;疾病进展(disease progres‐sion,PD):出现一个或多个新病灶,或目标病灶长径总和增大25%以上,以客观缓解率(objective re‐mission rate,ORR)和疾病控制率(disease control rate,DCR)评估疗效[8-9]。ORR=CR+PR,DCR=CR+PR+SD。
1.4.2 安全性评价 参照美国国家癌症研究所和国立卫生研究院的不良反应标准评价两组患者治疗后出现的不良反应[10-11]。
1.4.3 远期疗效 对所有患者进行随访,随访日期截至2022 年3 月1 日,统计两组患者无进展生存期(progression free survival,PFS),即化疗结束后当天至患者出现肿瘤进展或死亡的时间。
1.5 统计方法
采用SPSS 22.0 统计学软件处理数据,符合正态分布的计量资料以()表示,组间差异比较采用t检验;计数资料以频数和百分比(%)表示,组间差异比较采用χ2检验;应用Kaplan-Meier 方法分析患者生存情况,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗后的近期疗效对比
治疗6 个月后,有FANCA 基因突变组患者的ORR、DCR 分别为48.00%、84.00%,均明显高于无FANCA 基因突变组患者的22.86%、57.14%,差异有统计学意义(P<0.05)。见表1。
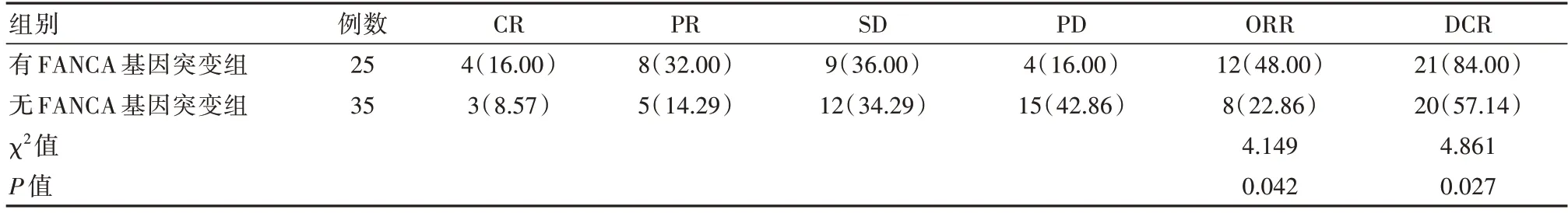
表1 两组患者治疗后的近期疗效比较[n(%)]
2.2 两组患者不良反应发生情况比较
治疗6 个月后,两组患者在胃肠道反应、骨髓抑制、肝肾功能损害、心脏毒性、过敏反应、神经系统损害方面的不良反应发生情况比较,差异无统计学意义(P>0.05),见表2。
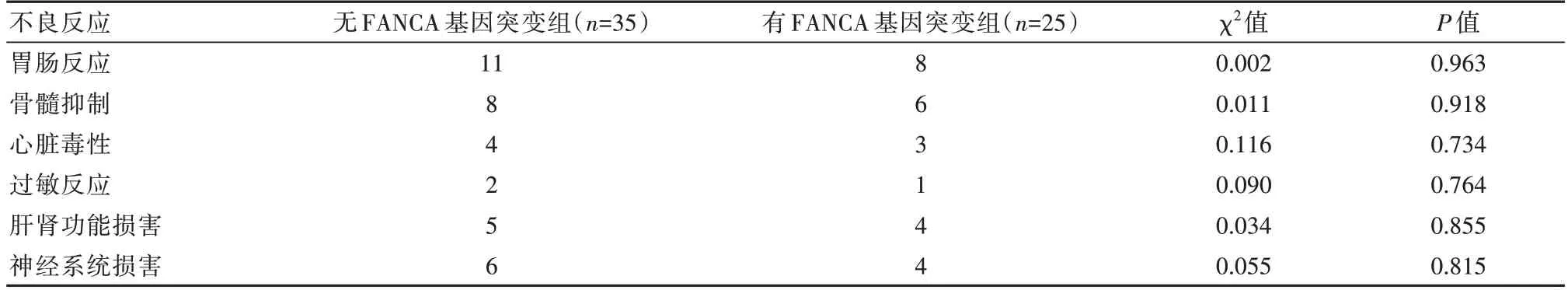
表2 两组患者不良反应发生情况比较
2.3 两组患者远期疗效比较
随访时间截至2022 年3 月1 日,有FANCA 基因突变组无进展生存期(17.74±0.67)个月,95%CI为16.427~19.053,无FANCA 基因突变组无进展生存期(12.63±1.12)个月,95%CI为10.426~14.832,两组患者PFS 比较,差异有统计学意义(t=22.064,P<0.001),见图1。
3 讨论
PARP 抑制剂的治疗潜力已在多种BRCA1/2 突变的癌症患者中得到很好的表征。BRCA1/2 在DNA 损伤修复中发挥关键作用,该修复由多种不同的途径组成,参与者众多。在DNA 损伤修复途径中其他关键基因发生突变的患者也可能对PARP 抑制剂的治疗产生反应,并且识别这些改变可以显着增加可能受益于PARP 抑制的患者百分比[12-14]。既往研究发现,PARP 与范可尼贫血(fanconi anemia,FA)途径相互作用,以抑制DNA 损伤期间过度的非同源末端链接NHEJ 和HR,产生合成致死,FANCA 是FA核心复合物的一个组成部分,负责激活链间交联修复[15]。FANCA 和FA 核心复 合物中 的其他7 种FANC 必需蛋白通过FANCD2 和FANCI 的单泛素化激活FA/BRCA 修复途径,FANCA 是FA 最常改变的基因,它在DNA 损伤反应中的重要作用意味着FANCA 突变的患者可以从PARP 抑制治疗计划中受益[16]。目前国内外研究主要公布了BRCA 基因突变的恶性肿瘤患者使用PARP 抑制剂的研究数据,故本研究主要探索无BRAC 突变、有FANCA 突变的卵巢癌患者使用PARP 抑制剂的疗效情况,结果显示,治疗6 个月后,有FANCA 基因突变组患者的ORR、DCR 分别为48.00%、84.00%,均明显高于无FANCA 基因突变组患者22.86%、57.14(P<0.05)。Amit M Oza 等[17]的研究结果显示,Olaparib 加常规化疗组的中位PFS 为12.2 个月;Ledermann J 等[18]的研究结果示,奥拉帕尼组中位无进展生存期为8.4个月,结果表明奥拉帕尼作为维持治疗显著提高了铂敏感、复发、高级别浆液性卵巢癌患者的无进展生存期,这与本研究无FANCA 基因突变组PFS(12.63±1.12)个月显著长于无FANCA 基因突变组PFS(17.74±0.67)个月(P<0.05)的结果一致。
综上所述,FANCA 可能是PARP 抑制剂使用的新的生物标志物。但鉴于本研究样本量偏小,FANCA 预测潜力还需进一步验证,该生物标志物如果能够很好地预测PARP 抑制剂的适用人群,可以帮助患者更好地选择药物,提高一部分卵巢癌患者的生存期。
