冻藏条件对人乳脂质及挥发性风味物质的影响
2022-03-05张丽娜瞿婧妍尹利昂孙赵娜
张丽娜,瞿婧妍,尹利昂,刘 君,孙赵娜,周 鹏,*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.海尔智家股份有限公司,山东 青岛 266101;3.南京医科大学附属无锡妇幼保健院,江苏 无锡 214002)
人乳是由乳腺上皮细胞合成分泌的汁液物质,含有婴儿生长所需的营养素,含量适中且比例恰当,最易于婴儿消化吸收且有助于改善循环及器官系统的功能,被誉为“白色血液”[1]。人乳中的脂肪含量约为3%~5%,在营养价值和保护功能方面具有重要作用。人乳脂肪可为婴儿提供50%~60%的能量,促进脂溶性化合物的运输和吸收并有助于构成细胞膜的结构,还可针对细菌、病毒等致病微生物为机体提供保护作用[2]。另外,人乳也富含一系列长链多不饱和脂肪酸,如二十二碳六烯酸(docosa hexaenoic acid,DHA)和二十碳五烯酸(eicosa pentaenoic acid,EPA)等,它们对婴儿脑组织和视网膜的正常发育至关重要[3]。因此,人乳具有动植物乳以及配方奶粉无可比拟的营养价值,人乳喂养的优势不言而喻。
然而,母亲们也可能因母婴疾病或是职业工作等因素而无法及时进行哺育。在此情况下,越来越多的女性选择使用预存人乳喂养代替直接哺育[4]。人乳的预存方式主要分为冷藏和冷冻。两者均通过低温抑制人乳细菌繁殖并延缓某些理化特性的降解达到延长保存期的目的[5]。冷藏能够在短期贮藏期内最大限度地保持细胞的结构、活力和功能;冷冻能够在保证人乳品质安全的基础上大大延长贮藏期限,母亲断奶后仍可使用预存的冷冻人乳进行喂养以最大程度地促进婴幼儿的生长发育[6-7]。从长期贮藏的角度考虑,学者们更推荐使用冻乳。
已有研究表明,人乳脂质特性在冻藏过程中会发生变化,主要集中在脂肪总量、脂肪分解、脂肪氧化等方面[8-10],对于贮藏过程中脂肪酸组成及挥发性风味物质组成等方面的研究较少。此外,以往的研究多集中于探究-18~-20 ℃或-70~-80 ℃两个温度区间的变化,而-18~-20 ℃虽然是家庭最常见的贮藏温度,但贮藏期有限;另一方面,-70~-80 ℃冰箱效果虽好,但造价昂贵且噪音较大,不适合应用于家庭。近年来,越来越多的家用电器公司开始探索深低温技术,尝试开发专用于储存母乳的-20~-70 ℃冰箱。与金枪鱼、三文鱼等高端食品低温循环使用的商用冰箱一样,-20~ -70 ℃可以最大限度地保持其质地和风味,满足经济和实际需求。然而,目前还没有关于人乳脂肪在-20~ -70 ℃冷冻过程中变化的信息。
因此,本研究将探寻人乳脂质及挥发性风味物质在不同冻藏条件下的变化。以新鲜人乳为对比,分别探究人乳脂质在不同冻藏温度(-18 ℃和-60 ℃)以及相同温度下不同降温速率(-60 ℃和-60 ℃快速冷冻(Q))的变化差异,为寻求研制合适、经济的人乳专用贮存冰箱条件提供科学依据,为冻乳的贮藏提供科学指导意见。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
本研究受江南大学医学伦理委员会批准,遵照相关标准选择人乳收集对象,所有参与本研究的母亲均签署了知情同意书。筛选标准如下:
入选标准:产后1~9个月;一次性分泌大于50 mL乳汁;分娩健康足月新生儿(37~24 周),孕前和孕期身体健康。
排除标准:有抽烟、酗酒和滥用毒品史;患有乳腺炎、传染病或精神病;患肿瘤、癌症、糖尿病等疾病。
无菌储奶袋 积谷(上海)贸易有限公司。
1.1.2 试剂
正庚烷(色谱纯)、14%三氟化硼-甲醇溶液(BF3-Methanol) 阿拉丁试剂(上海)有限公司;十一碳酸甘油三酯标准品(纯度>99%) 美国Nu-chek公司;尼罗红染料 美国Sigma公司;非酯化脂肪酸(nonesterified fatty acids,NEFA)试剂盒(A042-1-1)、脂质过氧化物(lipid peroxide,LPO)试剂盒(A106-1-2) 南京建成生物工程研究所;其余试剂均为国产分析纯。
1.2 仪器与设备
BC/BD-318HD卧式冷冻柜、DW/BD-55W321E卧式单温深冷冻柜 中国海尔集团;UT322高精度接触式温度计(K型热电偶) 优利德集团有限公司;EL204电子天平 梅特勒-托利多仪器(上海)有限公司;UV-2700紫外-可见分光光度计 日本岛津公司;Microtrac S3500激光粒度分析仪 美国Microtrac公司;TCS SP8 STED 3X超高分辨率多光子激光共聚焦显微镜 德国徕卡公司; SCIONSQ-456-GC气相色谱-质谱联用仪 美国布鲁克公司。
1.3 方法
1.3.1 人乳收集与处理
本研究共收集了无锡市20 位母亲的乳汁。乳汁由母亲清洁双手及乳房后,用电动吸奶泵采集,并用无菌储奶袋贮存。采集时间为上午8:00—10:00,所有样品收集后立即放入冰盒,在2 h内运送至实验室。所有样品运送至实验室后,在无菌烧杯中进行混合,混合后按要求分装至各无菌储奶袋中。
新鲜样品立即进行指标测定;将分装好的样品分成3 组,先置于4 ℃预冷。其中2 组分别置于-18 ℃和 -60 ℃条件下冷冻贮存;在相同-60 ℃条件下放入风机,调节风速为2 m/s,将剩余一组置于其中贮存,记为-60 ℃(Q)组。将3个热电偶探头分别置于3 组储奶袋的中心位置,监测样品从离开预冷状态至冷冻4 h之间的中心温度变化。以上样品同时置于3 组冷冻条件开始进行冷冻处理并开始温度监测,贮存60 d和180 d后取出,随即置于45 ℃水浴环境,以振荡方式使冻乳完全解冻,解冻后立即进行指标测定。
1.3.2 人乳脂肪含量测定
脂肪含量的测定参考罗兹-哥特里(Rose-Gottlieb)法,并进行适当修改。脂肪酸成分的测定参考Lacomba等[9]的方法,并进行适当修改。吸取2.5 mL样品于具塞试管中,加入0.4 mL氨水混匀30 s,于60 ℃水浴5 min,再振摇2 min,加入2.5 mL 96%乙醇溶液摇匀2 min,于冷水冷却,依次加入6.25 mL乙醚振摇30 s,6.25 mL石油醚振摇30 s,静置30 min,待上层液澄清后,读取醚层体积。用移液管移取1 mL有机层到恒质量的称量瓶,于通风橱挥发30 min,再置于烘箱中于105 ℃干燥至恒质量,记录称量瓶烘干前后质量。人乳脂肪含量按式(1)计算:
式中:X为脂肪质量浓度/(mg/mL);V为样品体 积/mL;m1为称量瓶烘干后质量/g;m2为称量瓶烘干前质量/g;V1为醚层上体积/mL;V2为醚层下体积/mL。
1.3.3 NEFA及LPO含量的测定
使用试剂盒测定,参照试剂盒说明书进行操作。
1.3.4 脂肪酸成分的测定
参考Lacomba等[9]的实验方法,并进行适当修改。取5 mL人乳,加入15 mL的三氯甲烷-甲醇混合液(2∶1,V/V)及2 mL 2 mg/mL的十一碳酸甘油三酯标准品,随后涡流振荡2 min;静置10 min后加入5 mL 20%氯化钠溶液,于25 ℃、3 500×g离心10 min;取下层氯仿层,于3 g无水硫酸钠脱水后氮气吹干;吹干后加入5 mL 0.5 mol/L氢氧化钠-甲醇溶液,70 ℃回流10 min;加入5 mL 14%三氟化硼-甲醇溶液,70 ℃回流5 min;加入2 mL正庚烷及5 mL饱和氯化钠溶液,混合后静置10 min;取1 mL上层清液于0.22 μm有机系滤膜过滤。
脂肪酸测定采用气相色谱-质谱联用仪。气相色谱条件:反式色谱柱(100 m×0.25 mm,0.20 μm),载气为氦气,载气流速为1 mL/min,进样口温度240 ℃,进样量200 μL,分流比为100∶1。采用程序升温,初始温度为60 ℃,保持1 min,然后以20 ℃/min升至120 ℃,保持1 min;然后以5 ℃/min升至240 ℃,保持15 min。质谱条件:离子源温度300 ℃;传输线温度240 ℃;质量扫描范围m/z50~500;溶剂延迟时间4 min。
1.3.5 激光共聚焦显微镜观察
采用超高分辨率多光子激光共聚焦显微镜观察人乳脂肪球(human milk fat globule,HMFG)的形态。使用丙酮配制质量浓度为1.0 mg/mL的尼罗红染液。取200 μL乳样,加入2 μL尼罗红染液用以标记脂肪,混匀后于室温避光反应20 min。取8 μL已标记好的样液置于载玻片上,随后小心盖上盖玻片,封片处理。设定尼罗红激发波长为552 nm,使用20 倍物镜进行观察。
1.3.6 挥发性风味成分分析
参考Spitzer等[11]的方法,并进行修改。取5 mL人乳,加入10 μL 50 mg/L 4-甲基-2-戊酮作为内标,萃取头50/30 μm DVB/CAR/PDMS于60 ℃顶空萃取30 min。 吸附完成后将进样针插入气相色谱-质谱联用仪在250 ℃解吸6 min。
色谱条件:载气为高纯氦气,不分流进样,流速为0.80 mL/min。采用DB-WAX弹性毛细管柱(30 m×0.25 mm,0.25 μm),40 ℃柱初温条件下保持3 min,接着以5 ℃/min升温至90 ℃,之后以6 ℃/min升温至230 ℃并保持6 min。质谱条件:进样口和接口温度均为250 ℃;采用电子电离源;电离电压和发射电流分别为70 eV和200 μA;温度200 ℃;四极杆温度150 ℃;检测器电压1 kV;质量扫描范围33~400 u。
1.4 数据分析与处理
所有指标的测定结果均以±s表示。数据统计分析使用IBM SPSS Statistics 20版软件进行处理。方差使用通用线性模型程序,数据之间的显著性差异使用Duncan模型在P值小于0.05水平进行分析。
色谱原始文件用Xcalibur分析,经检索数据库NIST 2005和Willey 7检索后,选出纯度与匹配度均大于800的检测结果,各组分含量以μg/100 mL表示。按式(2)计算气味活度值(odour activity value,OAV),用以评价该挥发性组分对人乳总体风味的影响,OAV大于1的物质对样品风味的形成具有重要贡献。
式中:Cx为化合物x的质量浓度/(μg/100 mL);OTx为该化合物的感觉阈值/(μg/100 mL)。
2 结果与分析
2.1 冻结方式差异
由图1A可知,-18、-60 ℃和-60 ℃(Q)三组人乳样品到达各条件目标温度(-18 ℃/-60 ℃/ -60 ℃)的时间分别为117、72.5 min和55 min。在4 h监测期内,-18 ℃冷冻条件存在轻微的温度波动, -60 ℃两组条件下温度变化较为稳定。由图1B可知,当样品通过最大冰晶形成区时,样品中心温度在0~-1 ℃范围内下降速度最慢,3 组样品通过0~-1 ℃温度区间的时间分别为60、17.5 min和7.5 min。
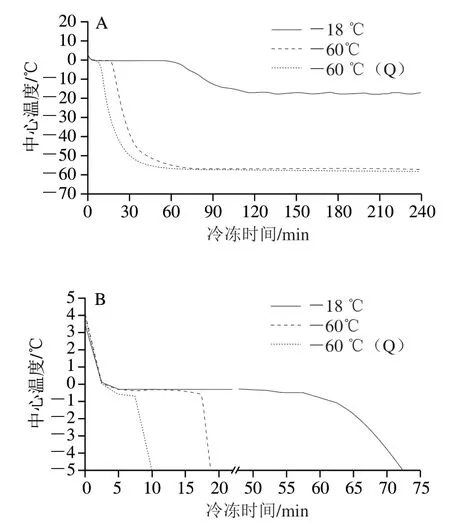
图1 不同冻藏条件下中心温度变化曲线Fig. 1 Freezing curves of human milk under different freezing conditions
-18、-60 ℃和-60 ℃(Q)三种冻结方式的主要差异在于冷冻温度及冷却速率。在食品冻藏过程中,冰晶的形成和变化对食品品质有至关重要的作用[12]。冰晶的大小与冷却速率和成核温度密切相关,冷却速率越低,成核温度越高,形成的冰晶越大[13]。本研究中设置的-18 ℃条件更贴合普通家用冰箱的冷冻环境,冻结速率缓慢且存在小幅温度波动;-60 ℃的2 组冷冻条件冻结速率显著高于-18 ℃且达到恒温冷冻效果, 其中-60 ℃(Q)条件在最大冰晶形成区的冻结速率约为-60 ℃条件的2 倍,这表明2 m/s风机在本研究体系中成功应用。
2.2 脂质含量变化
图2结果显示,人乳样品在-18 ℃条件下冻藏60 d后,脂肪含量出现明显下降。而在-60 ℃条件下,以不同速率冻藏的2 组样品,其脂肪含量在冻藏180 d后与新鲜样品在统计学上没有显著差异。该结果与翟英辰[10]监测-18 ℃与-80 ℃条件下人乳宏量营养素变化的结果相似。目前已有的相关研究表明,无论是冷藏还是冷冻,低温保存都可能引发乳中各营养素的一系列物理化学变化。人乳中的脂肪,主要以乳脂肪球(milk fat globules,MFG)的形式存在于水相中,约98%的甘油三酯(triacylglycerol,TAG)呈层状排列在内部,由极性酯(如磷脂、胆固醇等)组成的膜包裹在MFG外部[14]。造成不同低温条件下脂肪含量差异的原因主要是TAG分解程度不同,分解程度的关键在于脂肪酶活性的大小。此前有研究表明即使在-20 ℃条件下,脂肪酶也能够保持一定活性,从而造成TAG的水解[15-16]。因此,相比于普通-18 ℃低温条件,深低温条件能够更好地延缓脂肪的降解。另一方面,García-Lara等[17]测得超声匀化复温人乳的宏量营养素含量高于手动匀化样品,指出人乳中的营养素分子在冻融过程中可能附着于器壁表面。因此,除脂质分解外,-18 ℃条件下也可能出现脂肪附着的现象,使测得的脂肪含量下降。

图2 不同冻藏条件下人乳脂肪含量Fig. 2 Fat contents of human milk under different frozen storage conditions
2.3 NEFA含量变化
脂质除98%甘油三酯外,0.5%~1%的脂质含量由磷脂组成,0.2%的乳脂以甾醇的形式存在,极微量的游离脂肪酸、二甘油酯和单甘酯则以脂肪分解副产物的形式存在[18]。如图3所示,新鲜人乳中的NEFA较少,浓度仅为0.37 mmol/L。在-18 ℃冻藏期内,NEFA持续显著增加,由60 d的12.68 mmol/L增加至180 d的33.07 mmol/L; 在-60 ℃冻藏期内,NEFA含量增幅较小,维持在1.62~1.90 mmol/L范围内,且-60 ℃条件下的2种冻结速率对人乳脂解水平的影响并不显著。这与Ahrabi[19]及Berkow[20]等的研究报道相符,表明-18 ℃条件下脂质水解更严重(图3)。NEFA含量的增加对人乳品质及消化的影响尚无定论。一方面,Hernell等[21]指出当婴儿十二指肠内胆盐较低时,NEFA比酯化脂肪酸吸收更好,因此NEFA的增加有可能提高婴儿的生物利用度;另一方面,NEFA也可能会在贮存过程中形成离子化脂肪酸,与乳中的钙或其他成分结合,使其无法被吸收[22]。

图3 不同冻藏条件下NEFA含量Fig. 3 Contents of non-esterified fatty acids under different frozen storage conditions
NEFA的形成主要源于脂肪酶的作用。人乳中含有2种脂肪酶,分别为胆盐刺激脂肪酶(bile salt-stimulated lipase,BSSL)和脂蛋白脂肪酶或血清刺激脂肪酶(serum-stimulated lipase,SSL)[23]。BSSL能改善脂肪的消化和吸收,并在视黄醇酯、胆固醇酯等多种物质的消化中发挥作用[24]。SSL在婴儿消化中暂无相关功能报道,但其在乳腺中对循环脂肪酸的吸收有一定作用[25]。由于人乳中缺乏激活BSSL所需的胆盐浓度,学者们更倾向于将脂解现象的发生归因于SSL。目前有研究证实SSL与牛乳及人乳的脂解有关,且阐明了SSL在牛乳加工中的自发性和诱导性水解脂肪作用,而人乳贮藏过程的具体脂解机制还有待进一步探究[26]。
2.4 LPO含量变化
人乳中含有大量抗氧化物质,有助于新生儿应对氧化应激现象[27]。脂质过氧化作为氧化应激的一种指标,是氧或其他氧化剂对不饱和脂肪酸直接作用的结果[8]。当乳中自由基负荷超过抗氧化系统中和能力时,不饱和脂肪酸易受过氧化作用产生有细胞毒性的LPO,其分解产物有丙二醛(malondialdehyde,MDA)和4-羟基烯烃类等物质[28]。此前,Miranda等[8]对比了人乳在4 ℃下贮藏24 h和-20 ℃贮藏10 d的脂质氧化情况,发现MDA只在冷藏乳中增加,而不在冷冻乳中增加;Silvestre等[29]发现人乳在-20 ℃和-80 ℃贮藏1个月后,MDA含量均保持稳定,继续贮藏1个月后稳定性丧失。
本研究中的脂质过氧化情况与脂解趋势相似。新鲜人乳中LPO浓度约为1.33 μmol/L。-18 ℃条件下,LPO浓度持续显著增加,由60 d的3.34 μmol/L增加至180 d的7.60 μmol/L;LPO含量在-60 ℃两组条件下冻藏60 d后与新鲜样品无差异,但冻藏180 d后出现少量增加,-60 ℃浓度为3.02 μmol/L,-60 ℃(Q)浓度为2.94 μmol/L。 一方面,冷冻会造成乳脂肪球膜(milk fat globule membrane,MFGM)不同程度的破坏,使脂质暴露,加剧氧气与其他氧化剂对脂肪酸的作用,同时随着贮藏时间的延长,LPO含量逐渐增加(图4)。另一方面,乳中过氧化物的增加与抗氧化成分活性的下降有关[30]。本研究暂未探究相关活性的变化,但Miranda[8]和Silvestre[29]等均报道了在-20 ℃条件下,谷胱甘肽过氧化物酶活性下降的现象。因此,相比于普通-18 ℃条件,本研 究-60 ℃冷冻体系能够更好保护脂质免受过氧化伤害。然而,随贮藏时间的延长,脂质过氧化不可避免,如何评价脂质过氧化程度值得进一步探讨。
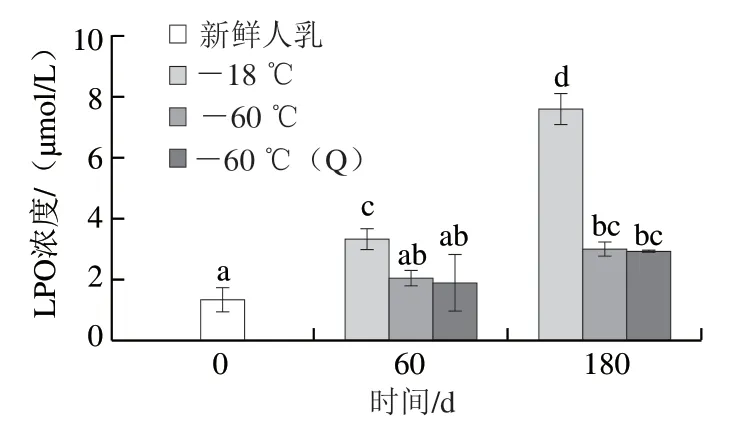
图4 不同冻藏条件下LPO含量Fig. 4 Lipid peroxide contents under different frozen storage conditions
2.5 脂肪酸组成变化
如表1所示,共测得10种饱和脂肪酸(saturated fatty acid,SFA),9种单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和13种多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)。总脂肪酸中SFA以棕榈酸(C16:0)为主,UFA以油酸(C18:1,ω-9)和亚油酸(C18:2,ω-6)为主。该结果与夏袁等[31]报道相似。

表1 不同冻藏条件下脂肪酸组成Table 1 Fatty acid compositions under different frozen storage conditions
目前关于冻藏条件下脂肪酸组成的研究较少。Lacomba等[9]观察到-20 ℃冷冻30 d后人乳脂肪酸含量没有显著降低;Romeu-Nadal等[32]分析了脂肪酸在-20 ℃和-80 ℃条件下贮藏12个月的变化,结果表明脂肪酸不受冷冻过程的影响。与该结果类似,本研究中SFA和PUFA占比在统计学上没有显著差异,而-18 ℃冻藏180 d的人乳MUFA占比略有下降。然而,本研究发现一些UFA,如棕榈油酸(C16:1,ω-7)、油酸、亚油酸和亚麻酸(C18:3,ω-3),在-18 ℃冻藏180 d后的绝对含量下降较为明显,而花生四烯酸(C20:4,ω-6)、EPA(C20:5,ω-3)和DHA(C22:6,ω-3)在3种条件下冻藏180 d后均出现下降。该结果表明,冷冻处理可能不会影响人乳脂肪酸的总体组成占比,但会造成DHA等长链多不饱和脂肪酸含量的下降。这种下降可能是贮藏过程中人乳脂质水解和氧化反应共同作用的结果。过长的冻藏时间可能会导致人乳脂所具备的生理功能作用下降。
2.6 微观结构的变化
对不同冻藏条件下的HMFG微观结构进行测定后,得到结构变化如图5所示。不同于新鲜样品的均匀分布,冷冻后的HMFG均有不同程度的聚集,其中,-18 ℃条件下的HMFG聚集融合现象最为明显。这主要是因为HMGF的组织结构对温度和变温速率高度敏感[33]。一方面,冻藏温度越低,MFGM上各磷脂的降解速率越慢[34]。 同时,MFGM也会在冷却过程中释放一些蛋白和磷脂,造成稳定性下降[14]。另一方面,在本研究冻结体系中,不同冷冻条件生成形态不一的冰晶,从而导致MFGM不同程度的破裂,而稳定性降低的MFG会相互聚集或在膜破裂处进行融合。由于-18 ℃属于普通低温而非深低温条件且冻结速率缓慢,因此MFGM的结构与组成在此条件下更易发生改变,微观结构与粒径的变化比-60 ℃更为明显(图5)。
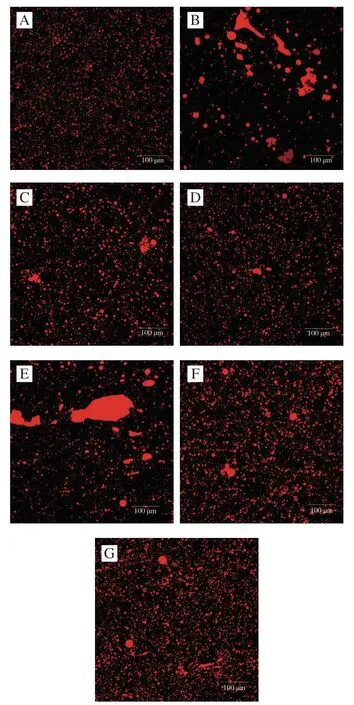
图5 不同冻藏条件下乳脂肪球微观结构Fig. 5 Microstructure of milk fat globules under different frozen storage conditions
值得注意的是,MFGM结构复杂独特,其上存在的多种蛋白和脂质在大脑发育与肠道微生物菌群等方面具有重要的生理学意义[35]。目前,有关人乳MFGM的研究多集中在物种差异或特定功能物质等方面,其在贮藏过程中的变化机制及功能影响还有待研究。
2.7 挥发性物质的变化
本研究体系共测得53种主要的挥发性成分,分别为19种烃类化合物、4种醇类化合物、9种醛类化合物、4种酮类化合物、6种酸类化合物、9种酯类化合物及2种含硫含氮化合物。各类化合物的具体组成如表2所示。
新鲜人乳含有的挥发性物质含量较少,风味特征并不明显;随冻藏时间的延长,各类物质均有所增加。其中-18 ℃条件下挥发性风味物质含量的增幅最为明显,而-60 ℃两种条件下的增速则显著放缓,增长物质以酸类及醛类为主,烃类物质次之。
基于所有挥发性物质的主成分分析(principal component analysis,PCA)评分结果(图6A)显示,在-60 ℃及-60 ℃(Q)条件下冻藏60 d的2 组样品的得分点与新鲜样品最为接近;其次是在-60 ℃及 -60 ℃(Q)条件下冻藏180 d的2 组样品,其中-60 ℃(Q)相比于-60 ℃略显优势;而在-18 ℃冻藏60 d与180 d的样品得分点则明显与其分开,且60 d与180 d的得分点按逆PC1方向逐渐分离,表明这2 组样品的挥发性组成物质存在显著差异。该结果表明,冻藏温度越低,时间越短,人乳原有风味物质保持越好。
计算各组分OAV并将OAV大于1的关键物质进行PCA后可知,各冻藏组得分的分布趋势(图6B)与基于所有挥发性物质的得分点分布一致。结合表2及图6B可知,醛类及酸类化合物含量高且阈值低,是冻藏过程中的主要挥发性化合物,2 类化合物的关键贡献性物质分别为己醛、庚醛、辛醛、壬醛、(E)-2-辛烯醛和(E,E)-2,4-壬二烯醛,以及己酸、辛酸和癸酸。酮类及醇类化合物含量虽低,但由于个别物质阈值较低,因而也对风味有一定程度的贡献,如1-辛烯-3-酮、2-壬酮及1-辛烯-3-醇。此外,烃类化合物虽增幅明显,但因其风味阈值较高,故在醛类及酸类等化合物风味强度较明显的情况下,其现有浓度对人乳风味的贡献程度较弱。

表2 不同冻藏条件下的挥发性物质组成Table 2 Composition of volatile compounds under different frozen storage conditions μg/100 mL

续表2 μg/100 mL
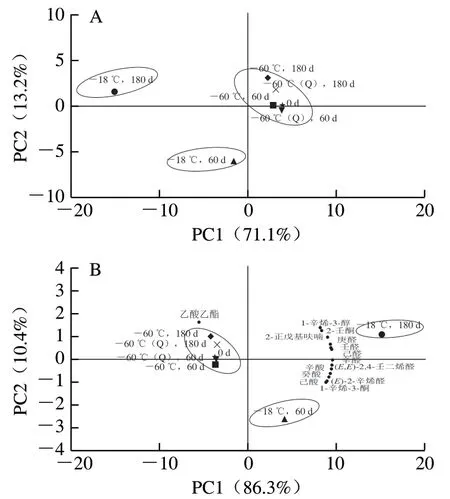
图6 不同冻藏条件下挥发性物质的PCA评分图 Fig. 6 Principal component analysis score plot of volatile compounds under different frozen storage conditions
具体分析看,烃类化合物来源复杂并且出现频率不稳定,它可能源自乳中游离脂肪酸的自动氧化[36]。相比于烃类化合物,醇类及酮类化合物的变化相对稳定,种类无明显变化,但阈值较低的1-辛烯-3-酮和1-辛烯-3-醇含量在-18 ℃有所提升,这2种物质具有蘑菇香气。酯类化合物整体呈现甜香、果香等令人愉悦的气味特征,OAV及PCA(图6B)结果表明,酯类化合物中只有乙酸乙酯对整体气味贡献较大,且主要存在于新鲜人乳及 -60 ℃冻藏人乳中。在酸类化合物中,具有脂肪味、汗臭味的癸酸、辛酸、己酸对冻乳风味贡献较大。醛类化合物是本研究中对气味变化贡献最大的一类化合物,主要呈现青草香、脂肪味及腐臭味。贡献显著的组分均主要存在于-18 ℃冻藏人乳中,按OAV评价贡献依次为己醛、壬醛、辛醛、(E,E)-2,4-壬二烯醛、庚醛以及(E)-2-辛烯醛,其中,(E,E)-2,4-壬二烯醛以及(E)-2-辛烯醛仅存在于-18 ℃冻藏人乳中(表2)。杂环化合物中,表现出黄油味和青豆味的2-正戊基呋喃在-18 ℃冻藏180 d后,气味特征开始显现。
综上所述,相比于-60 ℃两种条件,-18 ℃冻藏人乳各类物质增幅较大且更易产生青草香、脂肪味、腐臭味、汗臭味等异味物质。具有青草香、脂肪味等气味的物质,其生成机制主要是脂质的降解与氧化[37]。这些异味物质的前体以PUFA为主,典型前体是亚油酸或亚麻酸,也包含EPA和DHA,可通过酶催化过程或自动氧化机制形成相应的羰基氧化物[11,38]。酮类和醇类异味物质的产生主要源自亚油酸,亚油酸在脂肪氧化酶E2及裂解酶的作用下经过一系列氧化降解反应,生成C8及C10的羰基化合物,如1-辛烯-3-酮和1-辛烯-3-醇;醛类异味物质的产生主要源自亚麻酸,亚麻酸在脂肪氧化酶、裂解酶、氢化酶及异构酶的作用下可生成C6及C9的羰基化合物,如己醛、(E,E)-2,4-壬二烯醛等。具有腐臭味和汗臭味物质的增加可归因于游离脂肪酸浓度的增加[39]。该结果与NEFA、LPO、PUFA含量的变化,均表明-60 ℃两种条件可更好地维持人乳脂质在冻藏过程中的性能。
然而,有学者指出,虽然婴儿的嗅觉与味觉敏感度高于成人,但其对异味的接受度也高于成人,这主要与婴儿早起接触的环境与经历有关[40]。因此,即便是成人不可接受的风味,对于婴儿来说也可能在可接受范围内,这也为人乳风味研究带来了一定的难度。未来的研究可将对婴儿喂养行为的观察与风味化合物的定量分析相结合,以确定婴儿对异味风味物质的可接受阈值。
3 结 论
不同冻藏条件对人乳脂质及挥发性风味物质的影响具有显著差异。与传统的家庭-18 ℃冷冻条件相比, -60 ℃深低温冷冻条件具有冻藏温度低、冻结速度快、温度波动小的特点,有利于延缓脂质的降解和过氧化水平的升高,减少冰晶对脂质结构的破坏,减少醛类及酸类等异味物质的产生,尽可能保持人乳脂所具备的生理功能。虽然-60 ℃(Q)的快速冻结方式在脂质降解与氧化方面与-60 ℃无显著差异,但-60 ℃(Q)的快速冻结能够更有效地维持人乳的原有风味。该结果为研制人乳专用贮藏冰箱提供数据支撑,也为进一步研究人乳贮藏方式提供思路和依据。
