马氏珍珠贝肉蛋白水解特征及其ACE抑制肽的筛选
2022-03-05苏继磊
李 姣,苏继磊,陈 敏,尹 浩
(1.中国科学院南海海洋研究所,中国科学院热带海洋生物资源与生态重点实验室,广东 广州 510301;2.中国科学院大学地球与行星科学学院,北京 100049)
高血压是各种心脑血管疾病发生发展的主要病因之一,预计到2025年,发病人数将超过15亿[1]。在高血压的发病机理中,血管紧张素转化酶(angiotensin-converting enzyme,ACE)起着至关重要的作用,它一方面可以催化血管紧张素I转化为血管紧张素II,另一方面它还促进缓激肽的降解,这两个行为均会引起血压的升高[2-4]。因此,抑制ACE是目前临床上治疗高血压的有效方法。现阶段常用的ACE抑制剂包括卡托普利、依那普利和贝那普利等。然而,这些化学合成的药物通常表现出一些显而易见的不良作用[5-7]。根据最近的文献报道,某些食品诸如大豆、牛奶、鱼虾贝类的肉中含有丰富的蛋白质,它们的蛋白水解物呈现出一定生物活性,如抗氧化、降压、抗菌及降血糖等[8-12]。因此大量研究开始致力于从天然无毒的食品蛋白水解物中开发用于治疗高血压的活性肽,而对蛋白水解物的水解特征及起活性作用的关键结构进行研究是开发高价值活性肽最重要的一步。
马氏珍珠贝(Pinctada fucata)是我国南方沿海地带用作珍珠培育的经济贝类,然而,珍珠贝经采珠后,其贝肉大多仅具有食用价值。因此,使用蛋白酶对贝肉进行酶解,开发珍珠贝肉的附加价值,是实现珍珠贝蛋白资源高效利用的关键步骤。目前,对珍珠贝蛋白的酶解多集中在抗氧化、ACE抑制、促进创伤愈合等活性的研究[13-16]。其研究思路大多以活性为追踪目标,利用传统的分离纯化方法鉴定出活性肽,方法繁琐复杂,费时耗力,且纯化出的活性肽可能是由某几个肽组成的共洗脱组分,对于单个活性肽的鉴定依然很困难,并且鉴定出的肽的特征及活性机理仍不可知。
近年来,随着生物信息学的发展,大量具有预测肽序列及其理化特征的数据库应运而生,给多肽的初步筛选提供了极大的便捷。并且,计算机辅助药物筛选技术的更新对多肽筛选及大分子和小分子之间相互作用机制的研究也起到了推动作用。BIOPEP、PeptideCutter等各大网站被用于预测从特定蛋白质中释放出来的活性肽序列[17-21],然而,这些网站采用的是虚拟酶解法,其释放出的肽段可能在真实酶解中并不存在,因为真实酶解释放出的活性肽序列受蛋白质的空间结构、酶解温度及pH值等各种条件的影响。Fu等[22]采用虚拟酶解与体外真实酶解相结合研究了胶原蛋白α-1(I)和α-2(I)的酶解情况,发现胃蛋白酶酶解产物中经鉴定有序列为Gly-Pro-Arg-Gly-Phe的ACE抑制肽,然而,其在虚拟酶解中并未被发现,这主要是因为虚拟酶解中预测的肽是理论上释放的肽序列,而真实酶解则受多种外部条件的影响。因此,只有将酶解活性实验与以计算机为辅助的筛选相结合,才能高效地筛选出高活性的目标肽段。
本研究采用超滤及凝胶色谱Sephadex G-25对马氏珍珠贝肉酶解物进行初步分离,获得相对高活性的ACE抑制组分F2和F3。本实验目的在于研究马氏珍珠贝肉在不同酶解时间下的分子质量变化,以及随着酶解时间一些特征峰的变化,并对F2、F3组分进行鉴定,从而解析酶解物中活性肽的结构特征,最后采用分子对接的方法筛选其中潜在的ACE抑制肽,对其抑制机理进行初探,以期为珍珠贝来源活性肽应用于降血压功能性食品和药品开发提供理论基础。
1 材料与方法
1.1 材料与试剂
珍珠贝肉购于湛江海鲜市场,解冻后使用研磨机磨碎,采用贝肉-异丙醇1∶4(g/mL)脱脂3 h后,将其晾在空气中干燥并贮存在-20 ℃以备用。
碱性蛋白酶(200 000 U/g) 广西南宁庞博生物工程有限公司;马尿酰-组氨酸-亮氨酸(hippuryl-histidylleucine,HHL)、ACE(来自兔肺) 美国Sigma 公司;截留分子质量为3 kDa的超滤管 美国Millipore 公司;合成肽(纯度>98%) 吉尔生化(上海)有限公司;其他试剂均为分析纯或色谱纯。
1.2 仪器与设备
DK-8D数显恒温水浴锅 江苏金怡仪器科技有限公司; 5810R台式高速大容量离心机 德国艾本得公司;冷冻干燥机 德国Christ公司;电泳仪 北京君意东方电泳设备有限公司;1260分析型高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;Impact X高分辨四极杆飞行时间串联质谱 美国Bruker公司。
1.3 方法
1.3.1 酶解物的制备
称取一定量脱脂后的珍珠贝肉干,加入碱性蛋白酶酶解,温度50 ℃,pH 10.0,底物质量分数8%,酶-底物比8 000 U/g,酶解时间分别为2、4、6、8、10 h。酶解结束后将酶解产物放入沸水15 min灭酶活,接着8 000×g离心20 min,得上清液,过0.45 μm滤膜,即得珍珠贝肉酶解物,冻干,存放在-20 ℃下备用。
1.3.2 酶解物的Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
分别配制18%分离胶及5%浓缩胶,灌胶后等待胶凝固。将不同酶解时间的酶解物溶于水中,配制成 100 mg/mL多肽溶液。吸取多肽溶液20 μL,加入同等体积上样缓冲液,煮沸6 min,离心3 min,分别吸取20 μL多肽与上样缓冲液的混合溶液到胶孔中,以60 V电压将混合液在浓缩胶中压缩成一条线后,再以100 V电压跑分离胶。电泳完毕后加入固定液固定条带30 min,加入考马斯亮蓝R250染色1 h,随后脱色至背景颜色完全褪去。
1.3.3 酶解物的分子质量分布测定
配制1 mg/mL的标准品(细胞色素C、胰岛素、抑肽酶、VB12、N-HHL水合物),上样10 μL,经Agilent Bio SEC-5柱等度洗脱,洗脱液为0.5 mol/L磷酸缓冲液(含2 mol/L NaCl),流速0.5 mL/min,绘制出标准品与洗脱时间之间的标准曲线。同时,将样品配制成10 mg/mL,上样到HPLC系统中,在与标准品同样的条件下洗脱,对照标准曲线,计算出样品的分子质量分布。
1.3.4 酶解物在反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)上的洗脱
将不同水解时间的酶解物上样到RP-HPLC中,观察不同酶解时间样品的洗脱情况,进样20 μL,流速为1 mL/min,流动相A为0.1%三氟乙酸溶液,B为甲醇(色谱纯),洗脱程序为:0~5 min,99% A、1% B;5~35 min,99%~39% A、1%~61% B;35~38 min,39%~0% A、61%~100% B;38~46 min,0% A、100% B;46~48 min,0%~99% A、100%~1% B;48~56 min,99% A、1% B平衡至初始状态。
1.3.5 酶解物初分离及鉴定
将酶解物经超滤管(截留分子质量为3 kDa)及Sephadex G-25凝胶过滤柱(3.5 cm×30 cm)进行初步分离,活性跟踪得到2个ACE抑制活性相对较强的组分F2、F3,采用液相色谱-串联质谱对这两组分进行质谱鉴定。将F2、F3组分配制成一定质量浓度的溶液(20 μL,10 mg/mL),上样到安捷伦液相色谱系统中,色谱柱为安捷伦ODS-C18柱(4.6 mm×150 mm,5 μm),洗脱液A为0.1%甲酸溶液,洗脱液B为甲醇(色谱纯),洗脱梯度为:0~5 min,99%A、1% B;5~65 min,99%~39% A、1%~61% B。流速为1.0 mL/min。质谱为电喷雾电离源的maXis Impact MS质谱仪,以正离子模式进行,m/z范围为200~3 000。其他质谱参数设置如下:干燥温度180 ℃,电喷雾毛细管电压4.5 kV,干气流量4.0 L/ min。本研究采用PEAKS Studio 8.5中的从头测序法对质谱数据进行解析,母离子和碎片离子分别设置为10-5、0.02 Da,仅保留具有高平均置信度(average local confidence,ALC)值(>85%)的肽序列。
1.3.6 潜在的ACE抑制肽筛选及合成
为了筛选潜在的ACE抑制肽,使用Autodock vina对鉴定的肽进行分子对接。ACE的晶体结构(编码:4APH)从PDB网站(http://www.pdb.org)下载获得。删除了水和原始配体,并为受体蛋白添加了极性氢原子,随后该受体由Autodock Tools(版本1.5.6)保存为pdbqt文件。配体小分子结构由ChemOffice 2018生成,也使用Autodock工具打开,并自动添加了Gasteiger电荷,设置旋转键,保存为pdbqt文件。对接时采用文献[23]方法,搜索空间中心坐标为center_x=12.41,center_y= -4.333,center_z=-18.973,搜索空间大小为size_x=34, size_y=36,size_z=52,对接的结果以结合能值表示,值越低代表小分子与蛋白结合得越紧,其抑制活性越强。使用PyMOL分析具有最低结合能的稳定构象,然后生成3D图以显示肽与ACE之间相互作用的最佳构象。另外,使用Discovery Studio Visualizer可视化软件获得2D图。并且,多肽等电点(pI)、净电荷及水溶性通过多肽特性计算网站获得(https://pepcalc.com/)[24]。通过比较结合能,筛选活性肽进行固相合成以验证其活性。
1.3.7 ACE抑制活性的测定
根据Lan等[25]的方法作修改。首先,将实验所需的所有试剂溶解在硼酸盐缓冲液(100 mmol/L硼酸盐,300 mmol/L NaCl,pH 8.3)中,将30 μL 5 mmol/L HHL和10 μL的样品溶液混合,在37 ℃下预热6 min。同时,用10 μL硼酸盐缓冲液代替10 μL样品溶液制备空白溶液。然后,将30 μL预热过的ACE溶液(0.1 U)分别加入到空白和样品溶液中,37 ℃保温反应30 min,最后通过添加60 μL 0.1 mol/L HCl溶液终止整个反应。马尿酸的含量通过RP-HPLC测定,用25%乙腈和75% milli-Q水(0.05% TFA)作为流动相进行等度洗脱,流速为 1 mL/min,于228 nm波长处检测马尿酸的吸收峰。ACE抑制活性由下式计算:
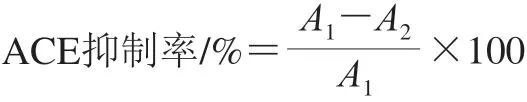
式中:A1为空白溶液中马尿酸峰面积;A2为含多肽的样品液中马尿酸峰面积。
1.4 统计分析
使用GraphPad Prism 8.0.1绘制图形,对数据进行单因素方差分析(ANOVA),所有实验均重复3 次,数据表示为±s,P<0.05,差异显著。
2 结果与分析
2.1 珍珠贝肉不同酶解时间样品的Tricine-SDS-PAGE
如图1所示,泳道1可以看出珍珠贝肉中的蛋白种类繁多,分子质量多集中在10~35 kDa之间。酶解2 h后大于35 kDa的条带基本消失,出现了大量小于35 kDa甚至10 kDa左右的条带。而酶解到第10小时,10~35 kDa之间的条带也消失,说明酶解产生了大量10 kDa以下的肽,这些分子质量较小的肽难以通过电泳完全跑开。在整个酶解过程中,有一条35 kDa左右的蛋白条带始终存在,推测它可能是珍珠贝肉中某种或几种难以被碱性蛋白酶酶解的蛋白。
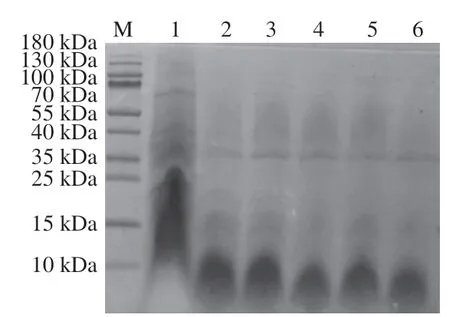
图1 珍珠贝肉蛋白水提物及其不同酶解时间酶解物的Tricine-SDS-PAGEFig. 1 Tricine-SDS-PAGE patterns of water-soluble protein extracted from P. fucata meat and its hydrolysates at different hydrolysis times
2.2 珍珠贝肉酶解物的分子质量分布特征
由表1可知,酶解2 h后,蛋白可能只是初步降解,产生的肽段分子质量仍在3 000 Da以上。在酶解时间达到4 h时,产生了大量小于3 000 Da的多肽,占总量的28.39%。在酶解时间为10 h时,产生的低于500 Da小分子肽含量达到最高,为5.82%。随着酶解时间的进行,大分子蛋白含量逐渐降低,小分子肽含量逐渐升高,这是因为随着酶解的进行,已产生的长肽链,可能再次被蛋白酶切割,导致了更多小分子肽的产生。同时,由于底物的消耗,反应产物的生成,以及酶切位点的有限性,使得新的小分子肽段产生的速率变慢。
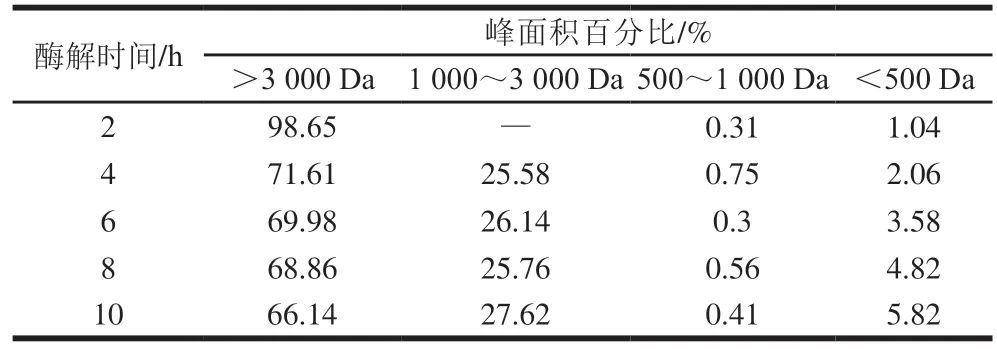
表1 不同酶解时间酶解物的分子质量分布Table 1 Molecular mass distribution of hydrolysates at different hydrolysis times
2.3 RP-HPLC对不同酶解时间酶解物的表征
如图2所示,可以观察到一个保留时间为20 min左右的特征峰(a),其在2、4、6、8、10 h酶解物样品中峰面积比分别为3.69%、6.49%、9.23%、10.42%、12.46%。随着酶解的进行,其相对含量越来越大,特别是从2~4 h之间增加的幅度最大。根据文献报道[26],具有ACE抑制活性肽的结构特点是含有大量疏水性氨基酸,这种疏水的特性会使得它们在反相柱上的保留时间相对较长,这与本研究相符,即疏水性的特征峰面积占比随着酶解时间逐渐增大,说明疏水性的肽含量在逐渐增加,其ACE抑制活性随着酶解进行可能在逐渐增强。并且,实验中使用的碱性蛋白酶因具有广泛的酶切位点,也使得酶解过程中更易产生疏水性的末端氨基酸[5],含疏水性末端氨基酸的肽随着酶解进行逐渐累积。
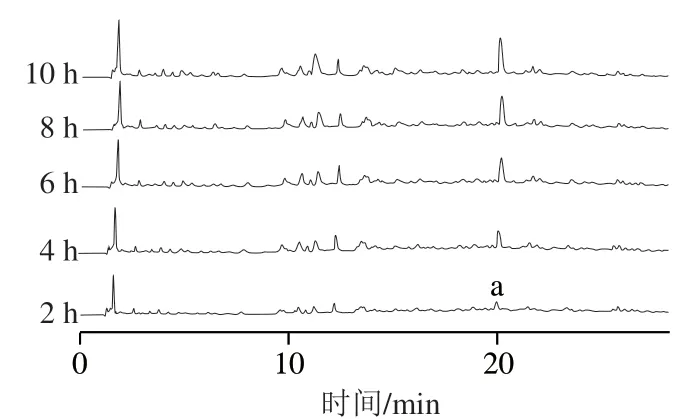
图2 不同酶解时间酶解物在RP-HPLC上的洗脱Fig. 2 RP-HPLC profiles of hydrolysates at different hydrolysis times
2.4 珍珠贝10 h酶解物活性肽的鉴定、筛选及理化特性
在本研究中,10 h酶解物中小分子肽含量占比最大,并且据报道ACE抑制活性肽大多为小分子肽[27],因此,在本实验中选择10 h的珍珠贝肉蛋白酶解物继续进行研究。采用超滤及凝胶色谱法对酶解物进行初步的分离及活性跟踪,经Sephadex G-25柱洗脱后,收集了4个组分(图3),发现F2和F3组分的ACE抑制活性最强,因此采用液相色谱-串联质谱对这两个组分进行鉴定。以PEAKS Studio软件对质谱数据进行de novo测序,选择ALC值大于85%的肽段进行分析。接着以Autodock vina软件对这些肽段进行分子对接,得到的理论结合能如表2所示。同时,通过在线网站对这些肽段的等电点、净电荷及水溶性进行了预测,发现其等电点范围在0.67~10.9,净电荷在-1~1之间,水溶性大部分都不好,说明它们的疏水性强,而疏水性强的肽相对亲水肽往往具有更高的生理活性[28]。可以看出PDFF、PPDPAAW、GLQW、FGPW、WFHAVFW、WHAFLW的结合能分别为-10.9、 -10.7、-10.6、-10.8、-10.8、-12.0 kcal/mol,相对其他的肽更低,与ACE结合得更为紧密,其活性可能更高,因此选择这6个肽进行了固相合成。
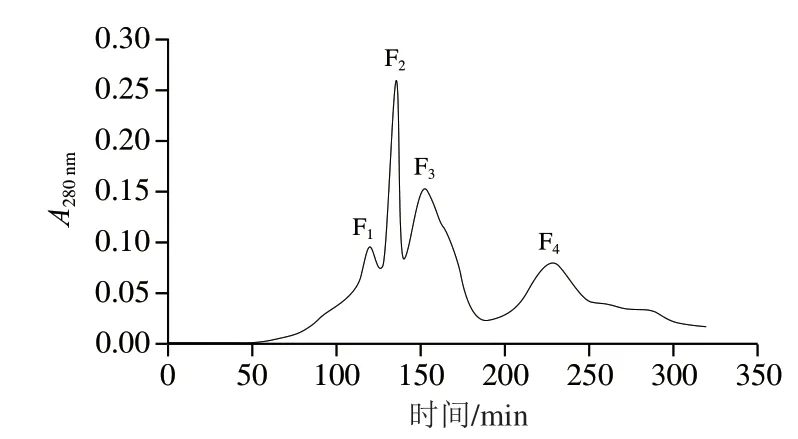
图3 Sephadex G-25的洗脱图谱Fig. 3 Elution of hydrolysates on Sephadex G-25
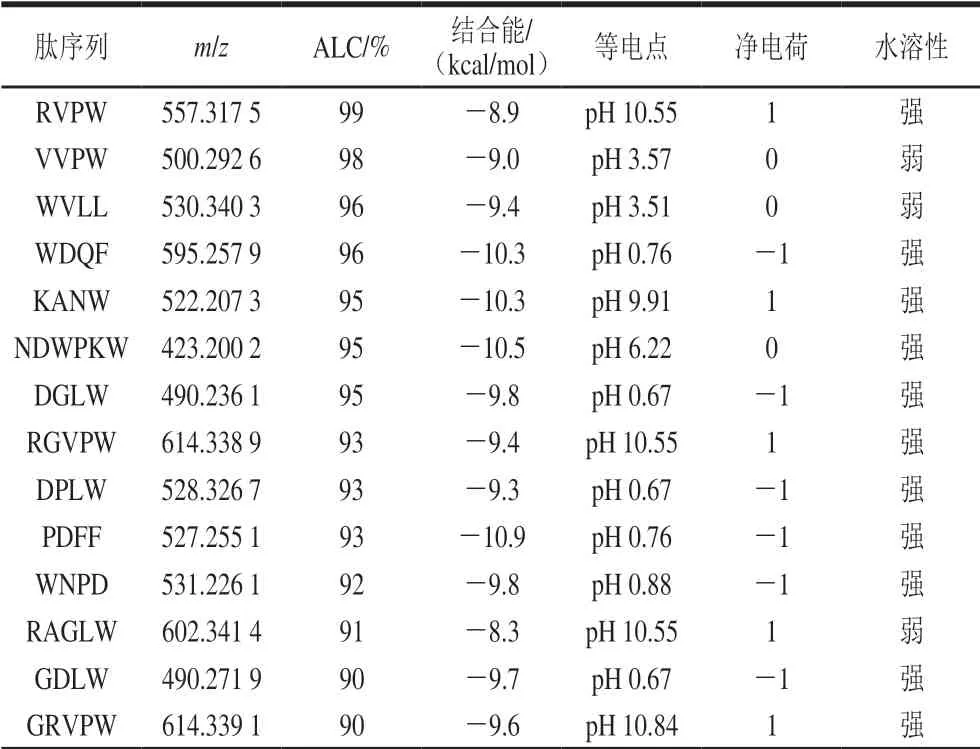
表2 F2及F3组分中肽段的鉴定及其他理化特征Table 2 Identification and physicochemical properties of peptides in fractions F2 and F3
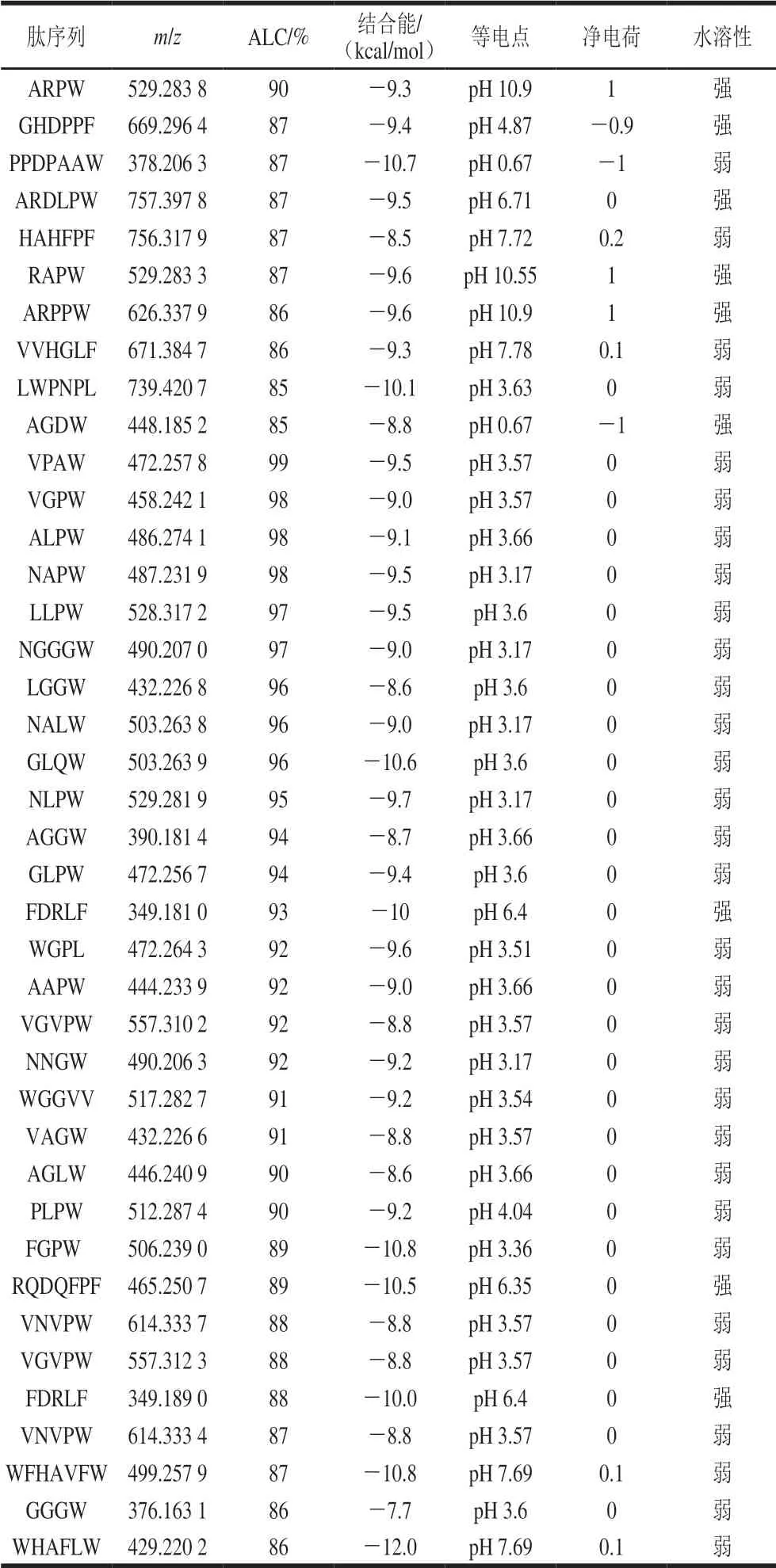
续表2
2.5 合成肽的活性验证及构效关系
取合成肽适量,配制成1 mg/mL的肽溶液,采用1.3.7节方法测定每个样品的ACE抑制活性,结果如图4 所示,可知,除了FGPW外,PDFF、PPDPAAW、GLQW、WFHAVFW及WHAFLW均表现出不同程度的ACE抑制活性,特别是肽WFHAVFW及WHAFLW,在 1 mg/mL时,其ACE抑制率分别达到了(95.57±0.37)%及(98.59±0.08)%。因此,肽WHAFLW相比于其他合成肽具有更高的ACE抑制活性,经鉴定,其二级质谱图如图5所示。将活性最高的WHAFLW稀释一系列梯度浓度,测得其IC50值为52.39 μmol/L。因此,该肽可作降压药物的先导物以进行后续的研究开发。WFHAVFW及WHAFLW这两条多肽序列的共同特点是两端均有疏水性极强的Trp(W),且中间位置均包含带正电的氨基酸His(H)。推测正是这个特征使得它们具有相对更高的ACE抑制活性。
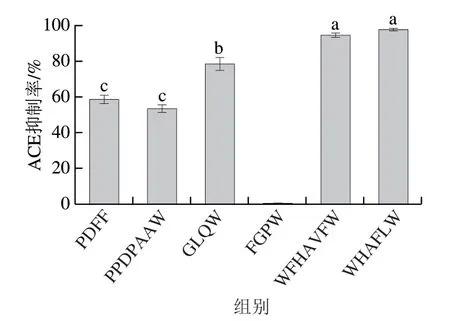
图4 合成肽的ACE抑制率Fig. 4 ACE inhibitory rates of synthetic peptides
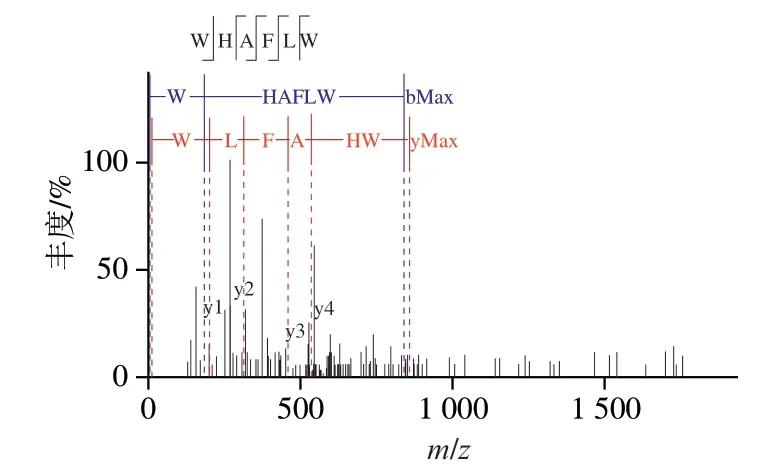
图5 六肽WHAFLW的二级质谱信息Fig. 5 MS/MS spectrum of hexapeptide WHAFLW
最近的构效关系表明,分子质量过大或过小的肽均不利于与ACE结合,其ACE抑制活性相对更低,最有潜力的ACE抑制肽由5个或6个氨基酸组成[27]。其次,C端具有疏水性氨基酸(Trp、Leu、IIe等),N端具有芳香族氨基酸(Trp、Tyr等),有利于ACE抑制活性的增加。并且,肽序列中如果含有带正电的氨基酸(比如Lys、Arg、His),也会增强其抑制ACE的能力,其原因是疏水性的氨基酸容易接近ACE活性口袋中的疏水性残基,与其形成相互作用。同时,带正电的氨基酸因为与ACE的C端活性口袋中带负电的氨基酸(Glu403、Glu162)结合,因此相比于N端,抑制剂更倾向于与C端结合,从而增强了ACE抑制活性。本研究2个高活性肽也是因为两端含有疏水性兼芳香族氨基酸Trp,中间带有正电性氨基酸His,从而使得其ACE抑制活性增强。Girgih等[29]报道了四肽WVYY和三肽WYT就是因为C-端氨基酸不同导致了活性差异,四肽WVYY的IC50为27 μmol/L,而WYT的IC50值为547 μmol/L,认为C-端的第3位置疏水性的Val(V),以及C端第1、2位置的2个疏水性Tyr(Y)促进了WVYY中ACE抑制活性的增强,而WYT则由于C端有1个亲水性的氨基酸苏氨酸(T),减弱了其ACE抑制活性,可见C端的疏水性对ACE抑制活性起重要作用。本研究2个高活性肽两端的Trp(W)也是一种高度疏水的氨基酸,常见的氨基酸疏水顺序如下:F>L=I> W=Y>V>M>P>C>A>G>T>S>K>Q>N>H>E> D>R。Xie Jingli等[30]对一种微藻蛋白进行胃肠道在线模拟消化,从消化的片段中筛选高活性的ACE抑制肽,其筛选的原则之一就是C端氨基酸为芳香族或者环状氨基酸,比如Trp、Tyr。最终,其筛选到了两种C端为Trp的高活性ACE抑制三肽TTW和VHW,其IC50值分别为(0.61±0.12)、(0.91±0.31)μmol/L。
2.6 肽与ACE相互作用机理
本研究筛选出的2个最高活性的ACE抑制肽,即七肽WFHAVFW与六肽WHAFLW,与ACE的结合模式如图6所示。可以看出,肽WFHAVFW(绿色)与WHAFLW(蓝色)中结合能最低的构象在ACE中有一部分存在着空间重叠,说明重叠的官能团可能与ACE存在相同的作用,而从2D图可以看出,两个肽中这一重叠结构的六元环及五元环中心均与ACE的Phe391形成了Pi-Pi相互作用。


图6 七肽WFHAVFW、六肽WHAFLW与ACE的分子对接Fig. 6 Molecular docking between peptides and ACE
另外,在抑制剂与酶的作用中,氢键也十分重要。氢键的数量以及长短影响抑制剂与酶的结合力。在本研究中,2个肽与ACE的残基均形成了多个氢键。七肽WFHAVFW与Ala356、Asn66各形成2个氢键,与Asn70、Ser517各形成了1个氢键,共6个氢键。而六肽WHAFLW与Ala356、Tyr523、Ala354、His513、Gln281、Lys511以及Cys370各形成了1个氢键,共7个氢键。ACE活性部位主要由3个活性口袋组成,即S1(Ala354、Glu384和Tyr523)、S2(Gln281、His353、His513、Lys511和Tyr520)和S1′(Glu162)[30],可以看出,与六肽WHAFLW形成氢键的氨基酸残基有一部分也属于这些活性口袋,比如Tyr523、Ala354属于S1口袋,His513、Gln281、Lys511属于S2口袋,而与七肽WFHAVFW形成氢键的氨基酸残基均不属于活性口袋,可见,与活性口袋的氨基酸形成氢键对于维持肽-酶复合物稳定性极其重要。因此,六肽WHAFLW的活性在一定程度上高于七肽WFHAVFW。并且,六肽与Zn2+也存在相互作用,有研究报道称,Zn2+还联合其他3个氨基酸残基(Glu411、His383、His 387)一起形成一个可扭转的四面体结构,对整个复合物的稳定起到了关键的 作用[31]。其次,除氢键和与金属离子的相互作用,范德华作用及Pi-Pi作用对复合物的稳定也不可或缺。
3 结 论
马氏珍珠贝肉蛋白是ACE抑制活性肽产生的重要来源,其酶解特征表明,合适的酶解时间可以定向产生一定分子质量的活性肽。另外,本研究还实现了传统的酶解实验与现代计算机辅助筛选技术相结合,高效筛选出了一个高活性的ACE抑制六肽,其氨基酸序列为WHAFLW,体外对ACE抑制的IC50值为52.39 μmol/L,对它的结构分析表明,两端具有疏水性的Trp(W),中间包含带正电的His(H),是其具有高ACE抑制活性的重要原因。
