肠道沙门氏菌双相亚利桑那亚种检验特征分析及检验方法比较研究
2022-03-05







摘 要:目的:通過参加中国食品药品检定研究院组织的能力验证,比对不同检验方法对巧克力样品中沙门氏菌的检出及鉴定效果,找出不同检验方法对样品中不典型沙门氏菌分离及鉴定的特性,有效提升实验室对不典型沙门氏菌检验能力及质量控制水平。方法:实验中样品前处理按照考核方案作业指导书进行,沙门氏菌的分离按照《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)要求进行操作,通过BAX® system Q7快速筛查可疑样品,MALDI-TOF-MS定位可疑菌株,VITEK 2 COMPACT全自动微生物分析系统确认阳性菌株,MLST技术对沙门氏菌阳性菌株进行分子生物学分型。结果:3个样品中两个样品检出沙门氏菌,样品CODE-0695检出鼠伤寒沙门氏菌,样品CODE-0050未检出沙门氏菌,样品CODE-0542检出肠道沙门菌双相亚利桑那亚种。结论:实验发现肠道沙门菌双相亚利桑那亚种在显色培养基上菌落形态及生化表征与常见沙门氏菌不一致,易漏检,实际工作中应加强对不典型沙门氏菌检验能力的建设。
关键词:肠道沙门菌双相亚利桑那亚种;菌株鉴定;血清分型;多位点序列分型;基质辅助激光解析电离飞行时间质谱
Comparative Study on Test Characteristics Analysis and Test Methods of Salmonella Enterica Subspecies Diarizonae
LIU Yang1, MA Bingcun2, LIU Zheng1, WANG Can1, QIN Yuan1, HE Qiaoling3*
(1.Sichuan Center for Medical Product Technical Inspection, Chengdu 610000, China; 2.Sichuan Institute for Drug Control, Chengdu 610000, China; 3.Sichuan Institute of Food Inspection, Chengdu 610000, China)
Abstract: Objective: By participating in the capability test organized by China food and drug testing and Research Institute, comparison of the detection and identification effects with different testing methods on Salmonella in chocolate samples, find out the characteristics of different testing methods on the isolation and identification of atypical Salmonella in samples, and effectively improve laboratory atypical Salmonella inspection capability and quality control level. Methods: The samples pre-treatment in this experiment were carried out in accordance with the assessment plan instructions. The isolation of Salmonella was carried out according to the requirements of GB 4789.4—2016 National food safety standard-Food microbiological testing-Salmonella testing. And the suspicious samples could be screened quickly through the BAX® system Q7. Suspicious strains were located by MALDI-TOF-MS. Using VITEK 2 COMPACT automatic microbial analysis system to confirm positive strains. Then performed the molecular biology typing for positive Salmonella by MLST. Results: Salmonella was detected in two of the three samples. Salmonella typhimurium was detected in sample CODE-0695, no Salmonella was detected in sample CODE-0050. Salmonella enterica subspecies diarizonae was detected in sample CODE-0542. Conclusions: The experiment found that the colony morphology and biochemical characteristics of Salmonella enterica subspecies diarizonae in the chromogenic medium were inconsistent with common Salmonella, which could be missed detection easily. The ability to test atypical Salmonella should be strengthened in practical work .
Keywords: salmonella enterica subspecies diarizonae; identification of strains; serotyping; multilocus sequence typing; MALDI-TOF-MS
肠道沙门氏菌(Salmonella enterica)是一种常见的人畜共患病病原菌,主要传播方式是食用被污染的食物、水及接触带菌者,该菌造成的食物中毒事件多发于夏季。肠道沙门氏菌造成的危害范围覆盖全球,在我国肠道沙门氏菌感染是造成食物中毒的主要原因之一[1]。因此,快速准确地将该菌污染的食物检出并进行有效的分型,对确定污染源进而采取有效措施切断污染源头,维护人们的饮食安全有重要意义。
实际工作中面对沙门氏菌污染的食品,传统国家标准检测方法虽然能准确可靠的检测出被污染样品,但面对生化表征不典型的沙门氏菌,如肠道沙门菌双相亚利桑那亚种(Salmonella enterica subspecies diarizonae),对检验人员的经验要求较高,且耗时较长。随着现代微生物学鉴定技术的发展,分子生物学及基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)鉴定技术开始大量应用于实际检验工作中,和传统检验方法相结合,能有效提高沙门氏菌的检出效率,减少因人员经验不足导致的漏检[2]。此次实验在采用传统国标进行沙门氏菌检验的同时引入最新的检验技术,比较了不同检验方法的优点及缺点,为今后实际工作中进行非典型沙门氏菌检验技术的选择提供了参考。
1 材料与方法
1.1 材料与试剂
食品中沙门氏菌能力验证样品,每份考核样品为装有巧克力基质的独立样品瓶,样品瓶编号分别为CODE-0695、CODE-0050和CODE-0542。
大肠埃希菌(Escherichia coli)〔CMCC(B)44 102〕、铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕、乙型副伤寒沙门菌(Salmonella paratyphi B)〔CMCC(B)50 094〕、阿贡纳沙门氏菌(Salmonella agona)。
缓冲蛋白胨水(BPW):BD;亚硒酸盐胱氨酸(SC)增菌液、四硫磺酸钠煌绿(TTB)增菌液、亚硫酸铋(BS)琼脂、沙门氏菌生化鉴定试剂盒:广东环凯微生物科技有限公司;沙门氏菌显色培养基:科马嘉;营养琼脂、胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB):北京三药科技开发公司;沙门氏菌属诊断血清:宁波天润生物药业有限公司。
1.2 仪器与设备
1300型生物安全柜:美国赛默飞公司;KB400培养箱:BINDER;FORMA 311培养箱:Thermo fisher;灭菌器-自动高压蒸汽:致微(厦门)仪器有限公司;均质器400型:IUL公司;BAX® system Q7全自动病原微生物检测系统:美国杜邦公司;VITEK 2 COMPACT全自动微生物分析系统:法国生物梅里埃公司;BX51显微镜:OLYMPUS;基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS):美国布鲁克道尔顿公司;PCR扩增仪:德国Eppendorf公司等。
1.3 实验方法
按照NIFDC-PT-135巧克力中沙门氏菌检验作业指导书进行沙门氏菌检验,依据《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)进行检验,同时辅以BAX® system Q7全自动病原微生物检测系统进行快速筛查,以基质辅助激光解析电离飞行时间质谱进行可疑菌株鉴定,VITEK 2 COMPACT全自动微生物分析系统对可疑菌株进行生化鉴定后,利用多位点序列分型(MLST)方法对沙门氏菌阳性菌株进行分型。以阿贡纳沙门氏菌作为阳性对照菌,大肠埃希菌作为阴性对照菌开展试验。
1.3.1 样品处理与前增菌
准备90 mL预热到45 ℃已灭菌的BPW,在生物安全柜内无菌操作打开样品瓶盖,加入20 mL灭菌BPW缓冲液,盖好瓶盖待巧克力样品融化后加入无菌均质袋内。取20 mL灭菌BPW清洗样品瓶2次,将洗液加入无菌均质袋内,最后向均质袋内加入30 mL灭菌BPW充分均质混匀,制成样品稀释液。阳性对照:取阿贡纳沙门氏菌的TSB液体培养物稀释液1 mL(含菌量约为50~100 CFU/mL)加入到盛有90 mL灭菌BPW增菌液的无菌均质袋中,混匀。阴性对照同法操作。空白对照:直接将90 mL灭菌BPW增菌液加入无菌均质袋中。将上述各组样品置36 ℃培养18 h。
1.3.2 BAX® system Q7全自动病原微生物检测系统检测
移取0.2 mL上述BPW培养物至10 mL脑心浸液培养基(BHI)中,于37 ℃培养3 h后移取5 μL培养物至盛有200 μL裂解液的裂解管中,于37 ℃金属浴
20 min,再95 ℃金属浴10 min,取出裂解管于4 ℃冷却5 min,再移取50 μL裂解物到PCR反应管中,采用BAX® system Q7全自动病原微生物检测系统检测。
1.3.3 增菌与分离
轻轻摇动混匀BPW培养物,移取1 mL培养物转种于10 mL的TTB培养基内,于42 ℃培养24 h。同时,另取1 mL培养物转种于10 mL的SC培养基内,于36 ℃培养24 h。分别用接种环取TTB和SC增菌液1环,划线接种于BS琼脂平板(36 ℃培养48 h)和沙门氏菌属显色培养基琼脂平板(36 ℃培养24 h),培养结束后观察平板上的菌落特征[3]。
1.3.4 基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)检测
分别从BS、沙门氏菌显色平板上挑取不同菌落,划线接種于同种培养基进行纯化培养后转接于TSA平板。挑取TSA平板上新鲜的纯培养物,在MALDI-TOF-MS金属靶点上涂成一个薄层,在上述靶点上覆盖1 μL的70%甲酸水溶液并在室温下自然晾干,然后再覆盖1 μL的HCCA基质并在室温下自然晾干,采用MALDI-TOF-MS进行鉴定(鉴定前对仪器进行校准),同时与实验室保存的大肠埃希氏菌、铜绿假单胞菌、乙型副伤寒沙门图谱进行比对。
1.3.5 生化鉴定
根据MALDI-TOF-MS鉴定结果,挑取相应可疑菌落,按照《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)进行生化鉴定试验。
1.3.6 VITEK 2 COMPACT全自动微生物分析系统鉴定
根据MALDI-TOF-MS鉴定结果,挑取相应可疑菌落,接种营养琼脂平板,取营养琼脂平板单个菌落,置于3 mL的0.45%生理盐水的试管中,调整菌悬液浓度达到革兰氏阴性鉴定卡要求的浊度,菌悬液加入到鉴定卡后,用VITEK 2 COMPACT全自动微生物分析系统进行鉴定。
1.3.7 血清学分型
按照《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)进行血清学分型。从营养琼脂平板上挑取多个仪器鉴定为沙门氏菌属的单菌落进行血清反应,根据上述反应结果,查沙门氏菌抗原表,得出分型结果。
1.3.8 MLST分型
实验中采用MLST数据库(https://enterobase.warwick.ac.uk/)提供的肠道沙门氏菌多位点序列分型引物和扩增程序,对实验中分离阳性菌株的7个等位基因(aroC、thrA、purE、dnaN、sucA、hisD 和hemD)进行扩增并测序。将获得的等位基因序列输入MLST数据库分析待测菌株序列型(Sequence Type,ST)[4-6]。
2 结果与分析
2.1 BAX®system Q7全自动病原微生物检测系统检测结果
BAX® system Q7检测结果如表1所示,CODE-0695、CODE-0542和阳性对照检出沙门氏菌,CODE-0050和阴性对照未检出沙门氏菌。实验中发现直接将样品BPW培养物进行BAX® system Q7检测,仪器无法给出检验结果,这可能是样品中巧克力基质干扰PCR反应造成的。将样品BPW培养物转接到BHI培养基培养后进行BAX® system Q7检测,仪器可以得出正确结果。因此BAX® system Q7可以快速确定样品中是否含有沙门氏菌,为后面进一步开展确认实验提供了参考。
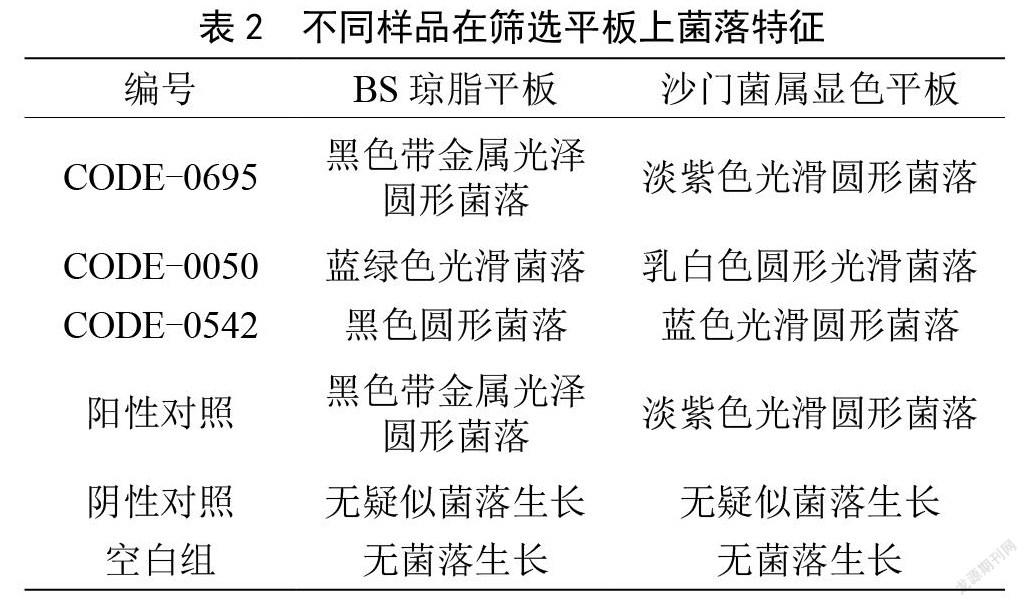
2.2 不同菌株在筛选平板上的菌落特征
将TTB、SC培养物划线于BS和沙门氏菌显色培养基进行培养,结果如表2所示。样品CODE-0695和阳性对照在BS琼脂平板和沙门氏菌显色培养基上显示典型的沙门氏菌菌落形态特征,判断为可疑沙门氏菌。样品CODE-0050在BS琼脂平板分离出蓝绿色光滑菌落,在沙门显色培养基分离出乳白色圆形光滑菌落,样品CODE 0542在BS琼脂平板分离出黑色圆形菌落,在沙门显色培养基分离出蓝色光滑圆形菌落,以上两个样品在筛选平板菌落特征均不显著,应进一步开展确认实验。
2.3 基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)对可疑菌株鉴定
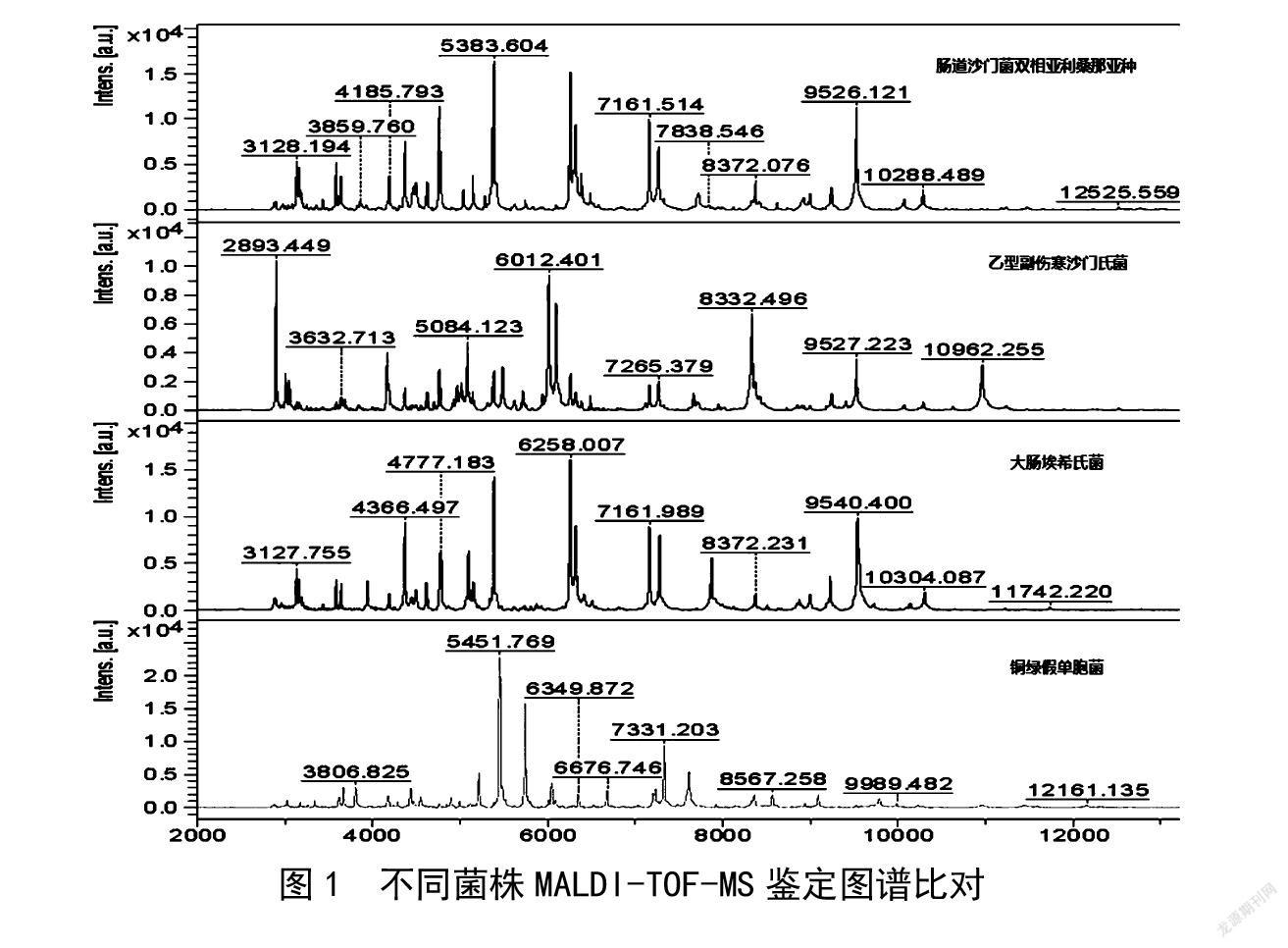
挑取不同样品TSA培养基上新鲜的纯培养物进行MALDI-TOF-MS鉴定,结果如表3所示。3个样品中CODE-0695、CODE-0542及阳性对照均检出沙门氏菌,同BAX® system Q7检测结果一致。比较不同菌株鉴定图谱,具体见图1,可以看出铜绿假单胞菌和沙门氏菌图谱有明显区别,大肠埃希氏菌和沙门氏菌图谱比较相似。由表4可知,实验中仪器能准确将沙门氏菌、大肠埃希氏菌、铜绿假单胞菌鉴定出来,且鑒定评估分数均在2.4分以上。根据鉴定结果显示MALDI-TOF-MS只能将上述两种不同血清型的沙门氏菌鉴定到属,无法鉴定出相应沙门氏菌的血清型。
2.4 生化鉴定结果
将样品中MALDI-TOF-MS鉴定结果为沙门氏菌阳性的菌落及样品CODE-0050中生长的菌落进一步纯化进行生化鉴定,结果如表5所示。样品CODE-0695筛选菌株生化鉴定结果与阳性对照结果一致,均符合GB 4789.4—2016中沙门氏菌生化反应特征;样品CODE-0050生化鉴定结果不符合GB 4789.4—2016中沙门氏菌生化反应特征。因此可以判断样品CODE-0695检出沙门氏菌,样品CODE 0050未检出沙门氏菌,检验结果和BAX® system Q7、MALDI-TOF-MS一致。样品CODE-0542需进一步进行生化鉴定。
2.5 VITEK 2 COMPACT全自动微生物分析系统对可疑菌株的鉴定结果
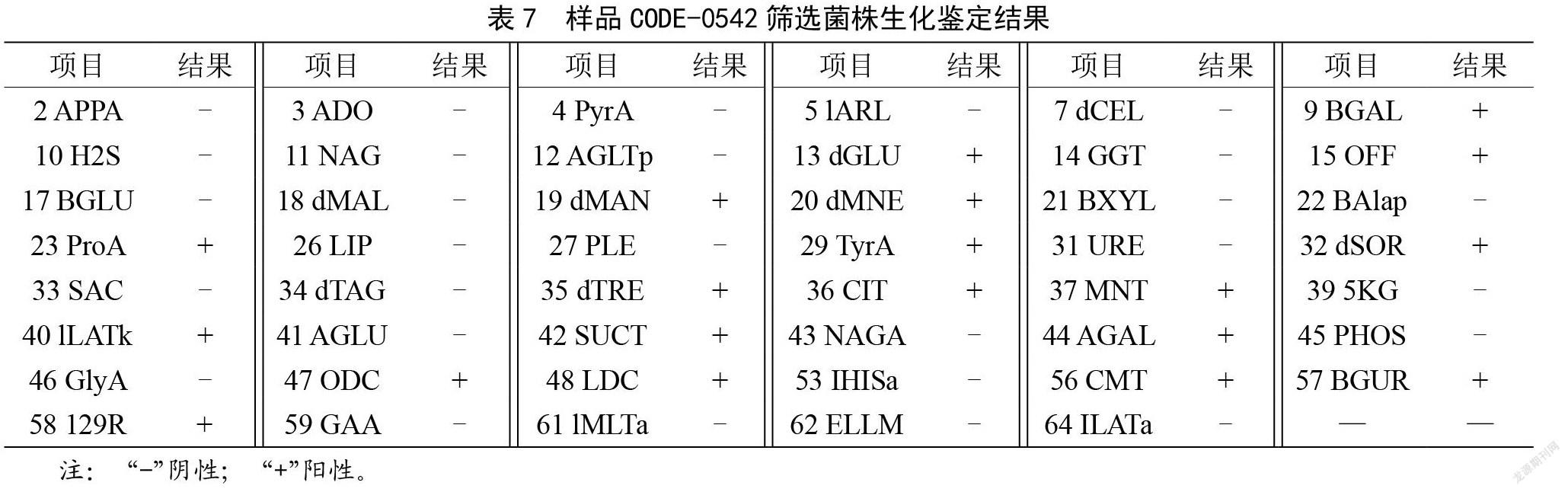
将筛选出的可疑沙门氏菌阳性菌株进行VITEK 2 COMPACT全自动微生物分析系统鉴定,结果如表6所示。样品CODE 0695、CODE 0542均检出沙门氏菌,其中CODE 0695鉴定结果为沙门菌属,需进一步进行补充实验,才能确定为哪一种血清型沙门氏菌,而样品CODE 0542可通过该仪器直接鉴定为为肠道沙门氏菌双相亚利桑那亚种,其生化反应结果如表7所示。
2.6 血清型分型结果
将筛选出的阳性菌株纯化后进行血清型实验,结果如表8所示。样品CODE-0695培养物自凝实验:无自凝,A-F O多价为阳性,O抗原:O4为阳性,O12为阳性,H抗原第1相:i为阳性,H抗原第2相:2为阳性;根据上述反应结果,查询沙门氏菌抗原表鉴定为鼠伤寒沙门氏菌(S.Typhimurium)。CODE 0542培养物自凝实验:无自凝,A-F O多价为阴性,通过实验室现有血清无法判定其血清型。
2.7 多位点序列分型(MLST)对沙门氏菌阳性菌株进行分子生物学分型结果
将样品CODE-0695、CODE0-0542阳性菌株的7个等位基因测序,经MLST数据库比对分析结果如表9所示,阳性菌株ST型分别为ST19、ST63。其中ST19抗原式为1,4,12︰i︰1,2,血清型为鼠伤寒沙门氏菌,与本实验血清型鉴定结果一致;ST63抗原式为60︰r︰e,n,x,z15,鉴定结果为肠道沙门菌Ⅲb亚种(肠道沙门菌双相亚利桑那亚种)[2],与本实验VITEK 2 COMPACT全自动微生物分析系统鉴定结果一致。
3 结论与讨论
本次实验通过分析肠道沙门菌双相亚利桑那亚种的生化特征及不同检验方法的检测特性,总结出以下几点经验为今后的一线检验工作提供参考。
(1)检验中通过对样品BPW培养物转接BHI培养基能有效避免巧克力基质对PCR反应的干扰,利用BAX® system Q7可以在30 h内准确快速的筛查出可疑阳性样品,为后续实验提供了参考。
(2)实验发现肠道沙门菌双相亚利桑那亚种在沙门氏菌显色平板上菌落特征及生化鉴定反应不典型,容易造成漏检。实验中使用不同筛选平板,挑选不典型菌落结合BAX® system Q7及MALDI-TOF-MS等检验方法能有效降低漏检风险。
(3)利用MALDI-TOF-MS高通量、快速鉴定的特点,对筛选平板上生长的各类型菌株纯化后进行鉴定,可快速、精准定位可疑的沙门氏菌菌落,有效降低沙门氏菌阳性菌落在筛选平板上特征不典型造成漏检的风险,为后期的生化鉴定提供了参考。比较MALDI-TOF-MS实验结果,该系统可以将沙门氏菌、大肠杆菌及铜绿假单胞菌有效鉴定区分,但无法指出沙门氏菌具体血清型,但该系统快速、高通量筛选出阳性沙门氏菌菌落的能力是其他鉴定手段暂时无法比拟的。
(4)实验中由于肠道沙门菌双相亚利桑那亚种血清凝集试验A-F O多价为阴性,很多实验室不一定常备相关的鉴定血清,通过MLST分型技术能有效的弥补实验室血清缺失造成无法分型的困境。
(5)比较VITEK 2 COMPACT全自动微生物分析系统对不同沙门氏菌的鉴定结果发现,该系统可以鉴定出肠道沙门菌双相亚利桑那亚种,鉴定结果同MLST结果一致,但无法对鼠伤寒沙门氏菌进行分型鉴定,系统提示需要做补充生化实验。
此次实验,在采用传统国标检验方法的基础上,结合现代检验仪器及分子分型,分析了肠道沙门菌双相亚利桑那亚种的生化特征,比对了不同检测方法对该菌的检测特性,不仅有效地提高了檢验效率,缩短了检验时间也提高了检验的准确性降低了漏检的可能,为今后更好地开展食品中非典型沙门氏菌检验,防止漏检提供了参考。
参考文献
[1]陈国强,陈扬,薛峰,等.多位点序列分型分析华东地区动物源产品中肠道沙门氏菌分离株[J].扬州大学学报(农业与生命科学版),2010,31(3):13-16.
[2]曲梅,黄瑛,吕冰,等.引起腹泻的肠道沙门菌双相亚利桑那亚种病原学鉴定[J].中国预防医学杂志,2016,17(6):405-408.
[3]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品微生物学检验 沙门氏菌检验:GB 4789.4—2016[S].北京:中国标准出版社,2016.
[4]刘雯静,邱少富,刘雪林,等.沙门氏菌的分子分型方法[J].现代生物医学进展,2010(20):3948-3950.
[5]刘慧玲,万志刚,洪小柳,等.进出口食品中不同血清型沙门氏菌PFGE和MLST分型比较研究[J].食品安全质量检测学报,2014,5(11):3454-3461.
[6]Aanensen D M,Spratt B G. The multilocus sequence typing network: mlst.net [J].Nucleic Acids Research,2005(33):728-733.
