三元体系在278.15 K和333.15 K条件下相平衡研究
2022-03-04卢子钰柳召刚
卢子钰,柳召刚
(内蒙古科技大学材料与冶金学院,轻稀土资源绿色提取与高效利用教育部重点实验室,内蒙古自治区稀土湿法冶金与轻稀土应用重点实验室,内蒙古包头 014010)
1 前言
氟化钠,化学式为NaF,属于离子化合物。常温为无色晶体或白色粉末,溶于水,微溶于醇。其在工业中有广泛应用,可作磷化催进剂、密封材料和防腐剂等。由于该物质有毒,在农业中也可作为杀虫剂使用。
碳酸钠,化学式为Na2CO3,是一种较为常见的强碱弱酸盐。常温为无色晶体,结晶水常温下为白色粉末,被广泛应用于化工中,用来制造清洗剂、洗涤剂等。
水盐相图一直是化学工业中的重要研究手段,它的研究可以分为两个方面,分别是实验部分和理论部分。学者需要通过大量实验得到上清液和湿渣的质量组分数据,然后通过数据绘制水盐相图,并对相图进行分析总结。该体系为Na2CO3-NaF-H2O三元水盐相图,很多学者的研究中包含或单独包含Na2CO3和NaF,例如NIZOMOV,SOLIEV研究了25 ℃时NaF-NaHCO3-H2O的相平衡[1];包头师范学院的李红霞研究了NaF-Na3PO4-NaOH-H2O及其子体系离子浓度测定方法探究[2]。
还有学者在实验的基础上结合Pitzer模型进行数据模拟,得到的模拟相图与通过实验数据绘制的相图进行对比,矫正模型的准确度,使其达到计算相图的作用。Linjun WANG等做了四元体系Na-F-CO3-HCO3-H2O温度在308.15 K和323.15 K下溶解度的测定及Na-F-Cl-SO4-CO3-HCO3-H2O体系Pitzer平衡模型的建立[3];Felmy研究了氟化物和磷酸盐成分在ESP中Pitzer模型的增强型热力学数据库的开发[4],Felmy的研究对于该研究具有极高的指导意义。郝晴做了Na2CO3-NaF-H2O三元水盐体系在313.15 K和343.15 K相平衡研究[5-6],文章是在前人的基础之上对其他温度进行了研究,力求数据更加准确和完整。
2 实验材料与方法
2.1 化学药品
氟化钠,AR(500 g),天津市化学试剂三厂;碳酸钠,AR(500 g),天津市化学试剂三厂;盐酸标准溶液,C=0.014 59 mol/L;氟标准溶液,C=0.100 0 mol/L(20 ℃),广检(广州)检测科技有限公司;氟离子强度调节剂(TISAB,pH值=5.0~5.5),广州臻萃质检技术服务有限公司;氯化钾溶液,C(KCl)=3.0 mol/L(20 ℃);酚酞指示剂(0.1%的90%乙醇溶液);甲基橙指示剂(0.05%的水溶液);去离子水,pH值=6,电导率<6×10-5S/m。
2.2 实验设备
pH/离子浓度测量仪(MP523型),上海三信仪器厂;pH计(PHS-3E型),上海雷磁仪器有限公司;日本理学XRD智能X射线多晶衍射仪(SmartLab-9kw);电子分析天平(MP5002型),精度1×10-4,上海精密仪器有限公司;X射线衍射仪(D8 ADVANCE),德国布鲁克;冰箱(DW-FL200A),中科美菱低温科技股份有限公司;H-4恒温水浴锅,金坛市城西丽华实验仪器厂;JJ-1精密磁力搅拌器,江苏金坛市金城国胜实验仪器厂;水银温度计0 ℃~100 ℃(精度0.5 ℃);移液枪,(0/200/400/800/1 000,单位:μL);枪头(1 000 μL)。
2.3 实验方法
此实验温度分别为278.15 K和333.15 K。由于温差很大,故两温度下的实验方法略有不同。实验温度278.15 K时,往该温度下饱和氟化钠溶液中以饱和碳酸钠的10%质量梯度加入碳酸钠固体,直至达到双饱和状态。然后将调配好的溶液盛放在聚乙烯瓶中并放入冰箱冷藏室保温,温度调至5 ℃(278.15 K),实验时间为30 d。在此期间需每隔8 h将试剂瓶充分摇晃。由于333.15 K较高,所以需要在耐高温塑料瓶中进行实验操作,重复以上步骤,并将调配好的溶液转移到塑料瓶中,然后放入磁力转子进行充分搅拌,塑料瓶口用保鲜膜密封。恒温水浴锅温度调至60 ℃(333.15 K),实验时间为3 h。实验完成后,静置溶液30 min,使沉淀充分沉降,然后用移液枪取1 mL清液于50 mL容量瓶中称重,加水至刻度线。再将塑料瓶中剩余上清液倒掉,将瓶中沉淀进行过滤,从中取少量湿渣于50 mL容量瓶中称重,加水至刻度线,摇匀使其充分溶解。此实验方法切忌使用玻璃容器进行实验,虽然氟化钠的水解微弱,但其水解后生成的氢氟酸与玻璃反应,对实验结果造成不良影响。
2.4 分析方法与检测
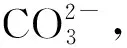
F-含量采用经过氟标液校准的pH/离子浓度测量仪测定。该仪器是采用离子选择电极法,测量前需要选择测量的离子。


(1)

(2)
在盐酸标液滴定时,由于碳酸钠和碳酸氢钠在水中pH值不同,需要先后加入酚酞指示剂和甲基橙指示剂[7]分别滴定。
平衡液相和平衡固相中H2O的质量组分用差减法得到。
溶液密度用密度瓶法[8]进行测量。用移液枪快速取样1 mL上清液,放入已称重的容量瓶中进行精确称量。
平衡固相用日本理学XRD智能X射线多晶衍射仪(SmartLab-9kw)进行检测,进行X射线多晶衍射分析时的光管为铜靶Kα[9],扫描范围10°~80°,扫描速率15(°)/min,步长0.01°。
3 结果与讨论
表1和表2是三元体系Na2CO3-NaF-H2O在278.15 K和333.15 K相平衡研究的实验数据。其中分别包含了278.15 K和333.15 K下平衡液相和湿固相NaF、Na2CO3和H2O的质量组分,上清液的密度,湿渣中平衡固相的物质组成。
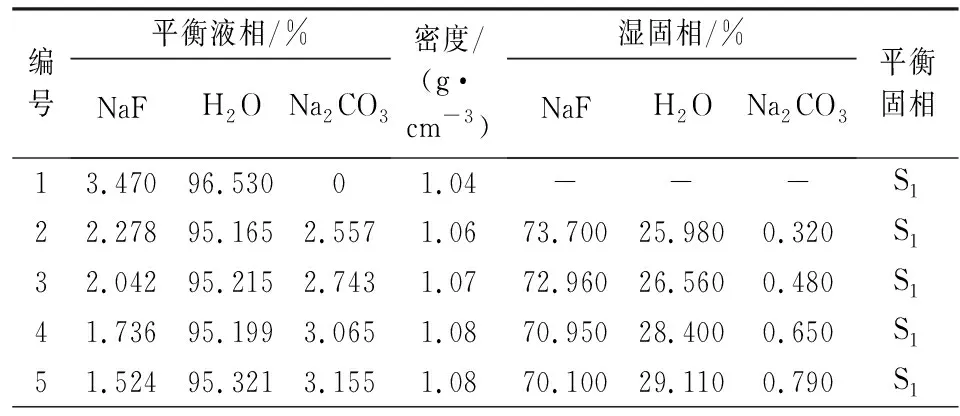
表1 三元体系Na2CO3-NaF-H2O 278.15 K相平衡组成Tab.1 The composition of the quaternary system Na2CO3-NaF-H2O at 278.15 K
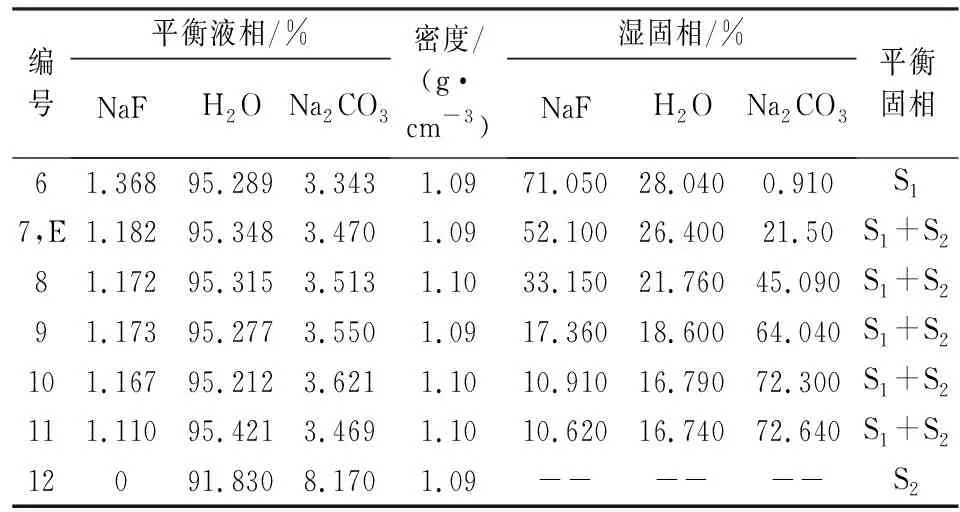
续表1 (Continue)

表2 三元体系Na2CO3-NaF-H2O 333.15 K固液平衡组成Tab.2 The composition of the quaternary system Na2CO3-NaF-H2O at 333.15 K
表1、表2中编号1和编号12分别是氟化钠和碳酸钠的饱和溶液,无湿固相。编号2-11可以看出,碳酸钠对氟化钠有盐析作用,且碳酸钠含量越高对氟化钠的盐析作用越强。
图1~图4是三元体系Na2CO3-NaF-H2O在278.15 K和333.15 K相同和局部放大图。
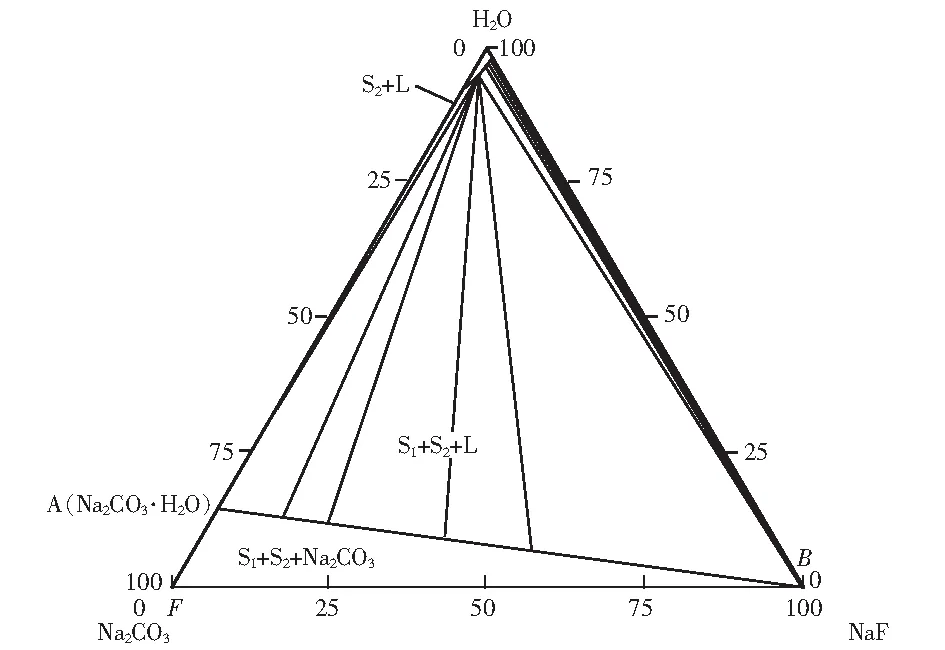
图1 Na2CO3-NaF-H2O在278.15 K下三元水盐体系Fig.1 Ternary water-salt system of Na2CO3-NaF-H2O at 278.15 K
图1、图3可知,温度278.15 K和333.15 K时三元体系Na2CO3-NaF-H2O相图中的相区大致相同,相图中没有复盐和固溶体产生,产生的只是该盐的水合物,属于简单共饱型体系。平衡相图中包含了1个不变点(共饱点);3条单变量曲线;1个液相区;3个结晶区,其中包含2个单盐结晶区,1个混合结晶区;1个全固相区。不变点E对应的平衡固相为NaF与Na2CO3·H2O,其平衡液相组成为w(NaF)=1.182%,w(Na2CO3)=3.470%。根据278.15 K条件下相图可知,液相线由H2O刻度线右上角开始向左下方移动,到达E点继续向下,在Na2CO3刻度线终止,液相线上方为液相区。

图2 Na2CO3-NaF-H2O体系在278.15 K下相图局部放大图Fig.2 Partial enlarged view of the phase diagram of the system Na2CO3-NaF-H2O at 278.15 K

图3 Na2CO3-NaF-H2O在333.15 K下三元水盐体系Fig.3 Ternary water-salt system of Na2CO3-NaF-H2O at 333.15 K
单变量曲线EB是NaF的溶解度曲线,是NaF+L区和NaF+Na2CO3·H2O+L区的分界线,对应的结晶区为NaF+L(EBC区域),说明从NaF+L区和NaF+Na2CO3·H2O+L区移动时,平衡固相中有Na2CO3·H2O不断析出,从右往左Na2CO3·H2O含量不断增加,NaF含量不断减少。单变量曲线EA是Na2CO3·H2O的溶解度曲线,是Na2CO3·H2O+L区和NaF+Na2CO3·H2O+L区的分界线,对应的结晶区为Na2CO3·H2O+L(EAD区域),平衡固相全部为Na2CO3·H2O,不存在NaF。单变量曲线AB是NaF+Na2CO3+L的溶解度曲线,是NaF+Na2CO3·H2O+L和NaF+Na2CO3·H2O+Na2CO3区的分界线,对应的结晶区为是NaF+Na2CO3·H2O+ Na2CO3(ABF区域),该结晶区为全固相区。
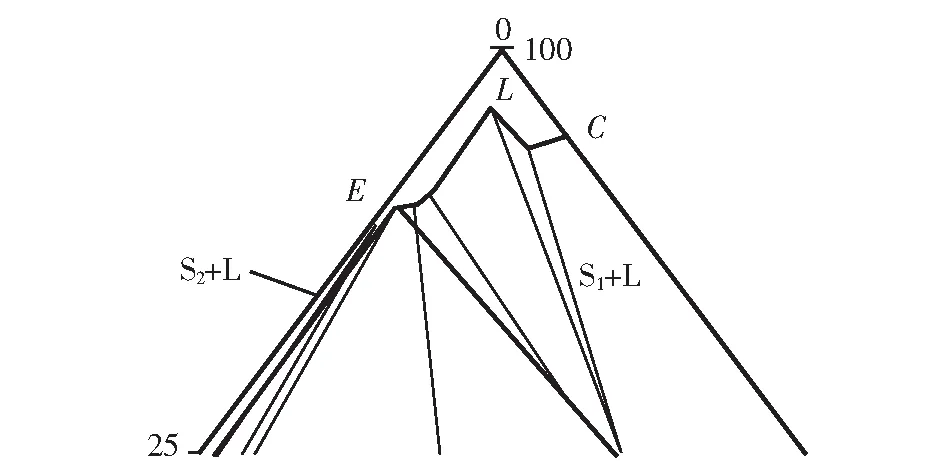
图4 Na2CO3-NaF-H2O体系在333.15 K下相图局部放大图Fig.4 Partial enlarged view of the phase diagram of the system Na2CO3-NaF-H2O at 333.15 K
图2、图4是Na2CO3-NaF-H2O体系分别在278.15 K和333.15 K下相图的局部放大图。区别在于333.15K的Na2CO3·H2O+L结晶区比278.15 K的Na2CO3·H2O+L结晶区小。
两幅相图为两温度下溶液成分变化图,该相图对实际生产中溶液内部物质变化关系具有重要帮助。
3.1 物化性质研究
3.1.1 密度分析(图5)
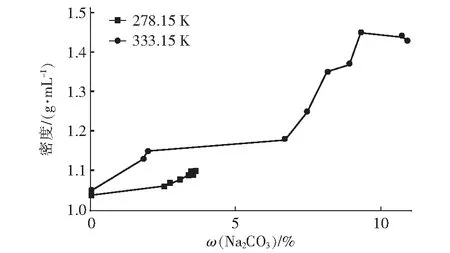
图5 三元体系Na2CO3-NaF-H2O 278.15 K和333.15 K时密度Fig.5 Density of ternary system Na2CO3-NaF-H2O at 278.15 K and 333.15 K
由图5可知,当温度达到278.15 K时,溶液的密度随溶液中碳酸钠含量增加变化不大,密度变化范围在1.04 g/mL~1.10 g/mL之间;当温度达到333.15 K时,溶液密度随溶液中碳酸钠含量的增加而明显增大,密度变化范围在1.05 g/mL~1.46 g/mL之间。
3.1.2 pH值分析
该溶液pH值是通过pH计(PHS-3E型)测试的,测试前需要用KCl溶液进行浸泡,结果见图6。
图6可以发现,Na2CO3含量相同时278.15 K比333.15 K的pH值高,说明强碱弱酸盐溶液pH值随温度的升高逐渐降低[10]。因为溶液中的两种溶质都是强碱弱酸盐,强碱弱酸盐随着温度的升高溶液中会水解出更多的[H+]。由pH值=-lg [H+]可知,[H+]越高pH值越低,故温度越高pH值越小。

图6 三元体系NaF-Na2CO3-H2O 278.15 K和333.15 K时pH图Fig.6 The pH diagram of the ternary system NaF-Na2CO3-H2O at 278.15 K and 333.15 K
3.1.3 共饱点固相鉴定研究
湿渣法由德国化学家Schreinermark提出,通过测定湿固相及其平衡的液相组成后,将两者的图形点连成直线。纯固相一定在这条连线上,可以确定纯固相的位置[11]。
图7、图8分别为该体系278.15K和333.15K共饱点E的X射线衍射分析图,图中2、3行分别对应Na2CO3·H2O和NaF的X射线衍射标准图谱。XRD图测的范围为10°~80°,实验图谱与标准图谱对比可知,共饱和点平衡固相中存在Na2CO3·H2O和NaF,而且333.15 K比278.15 K共饱点析出固相的形态更好,强度更高,说明温度越高,越有利于析出固相。
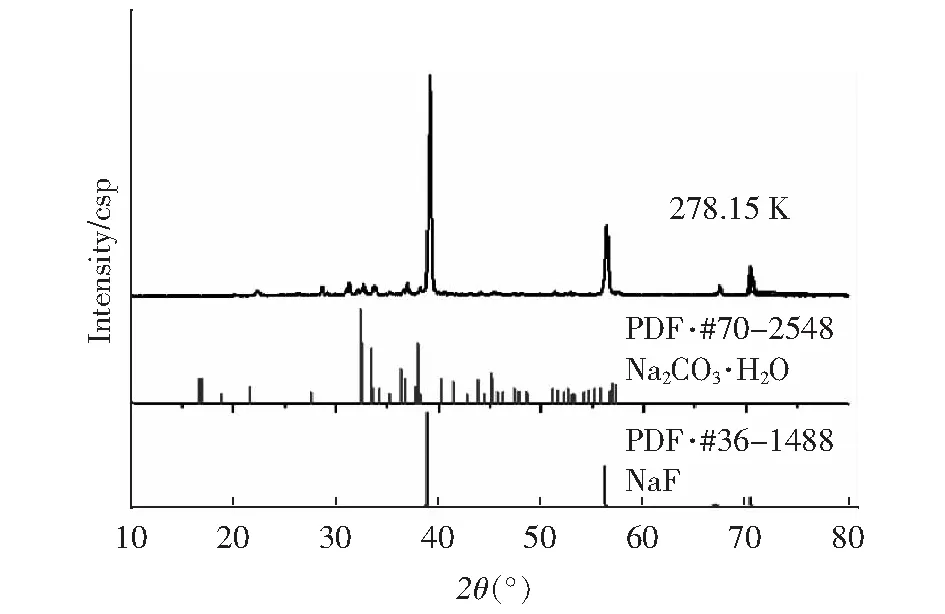
图7 三元体系Na2CO3-NaF-H2O 278.15 K时共饱点XRD图Fig.7 The XRD pattern of the total saturation point of the ternary system Na2CO3-NaF-H2O at 278.15 K
4 结论
1)碳酸钠对氟化钠有盐析作用,且碳酸钠含量越高对氟化钠的盐析作用越强。
2)相图中没有复盐和固溶体产生,属于简单共饱型体系,平衡相图中包含了1个共饱点;3条单变量曲线;1个液相区;3个结晶区,其中包含2个单盐结晶区,1个混合结晶区;1个全固相区。
3)强碱弱酸盐溶液pH值随温度的升高逐渐降低。
4)温度越高,更有利于共饱点固相析出。
